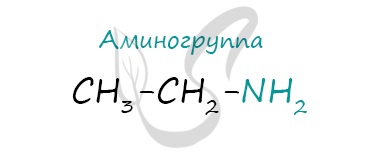Амины
Амины - органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа - NH2.
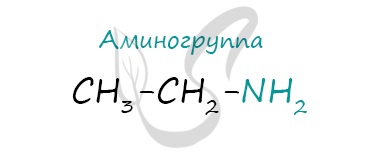
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
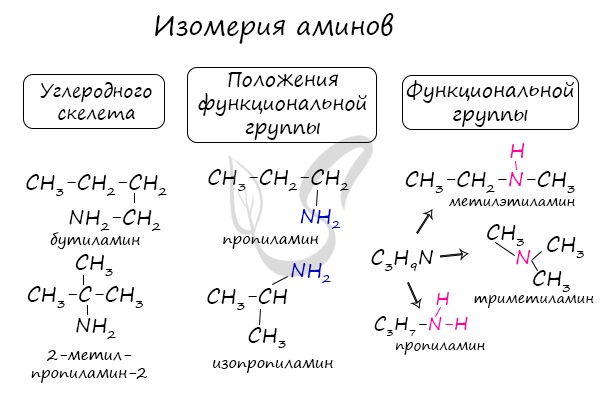
Названия аминов формируются путем добавления суффикса "амин" к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
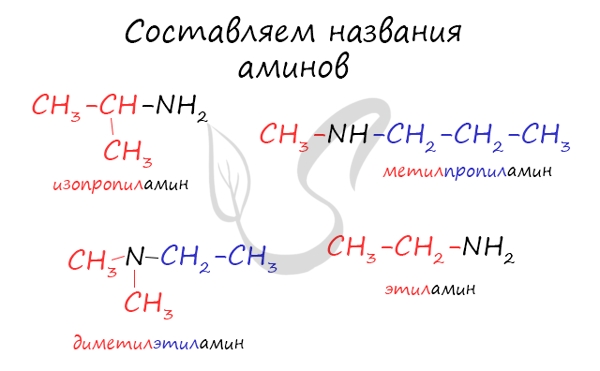
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
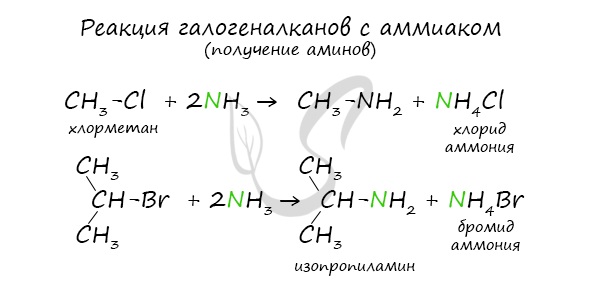
Нагревание галогеналканов с аммиаком
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
Восстановление нитросоединений
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
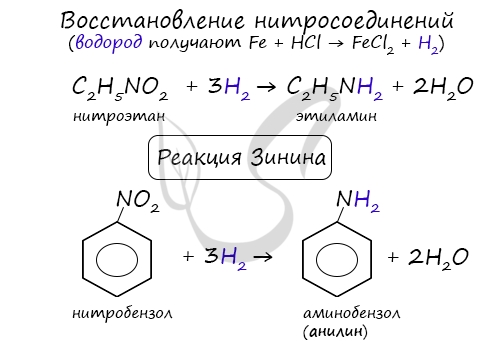
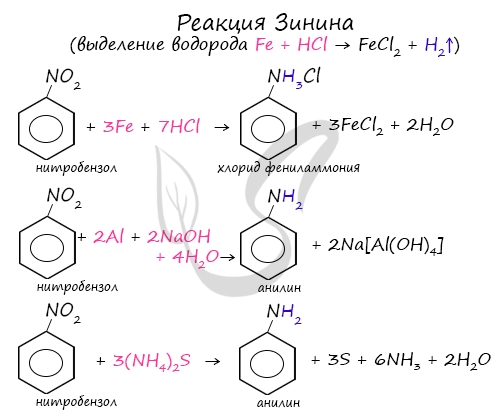
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
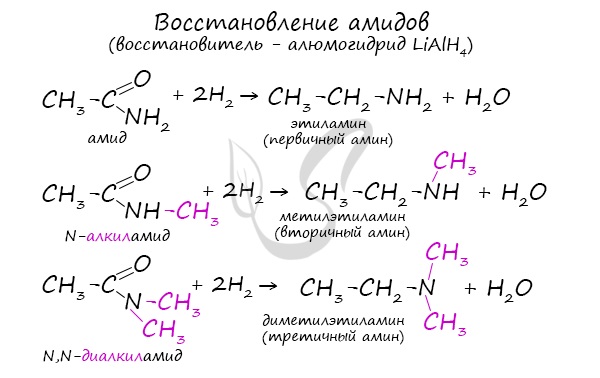
Восстановление амидов
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
Восстановление нитрилов
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна - нейлон.

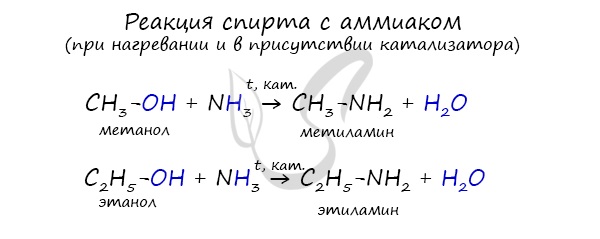
Реакция аммиака со спиртами
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
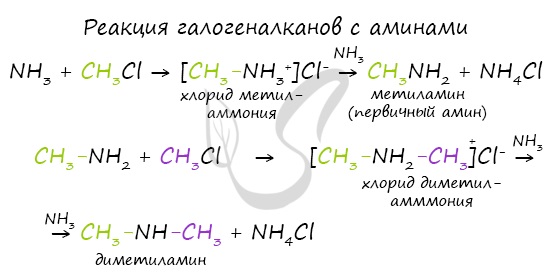
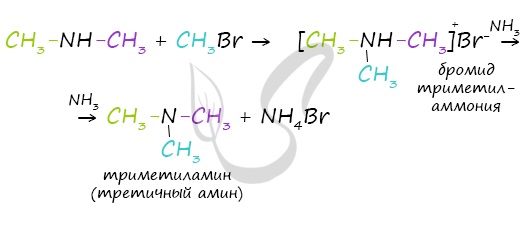
Реакция галогеналканов с аминами
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Основные свойства
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
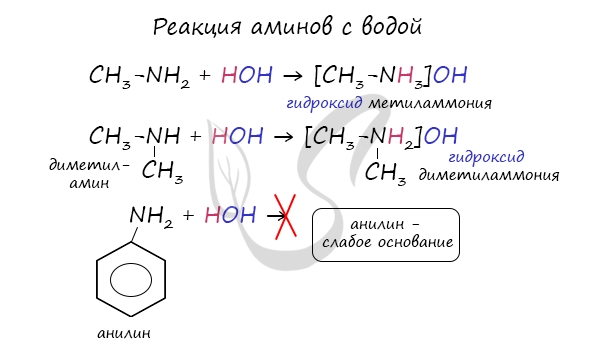
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
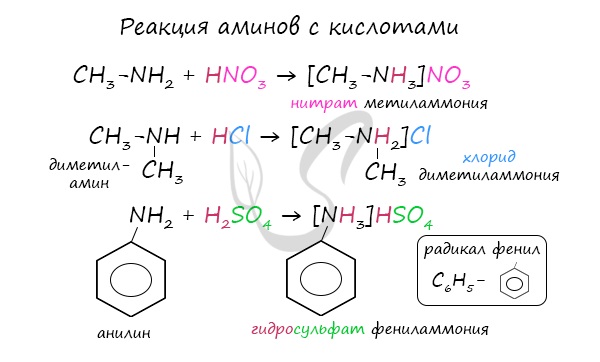
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
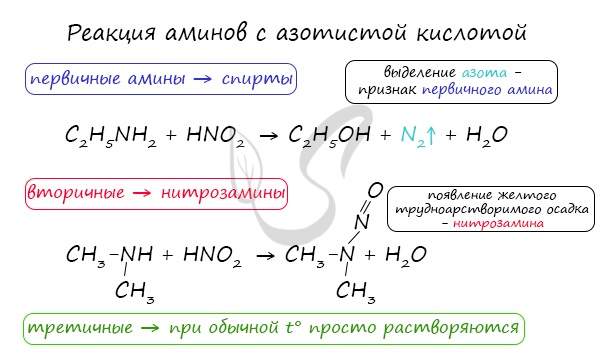
Реакция с азотистой кислотой
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
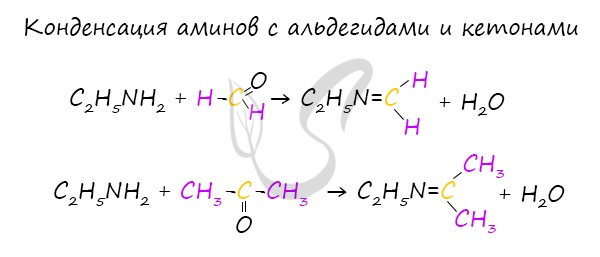
Конденсация аминов с альдегидами и кетонами
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент "N=C".
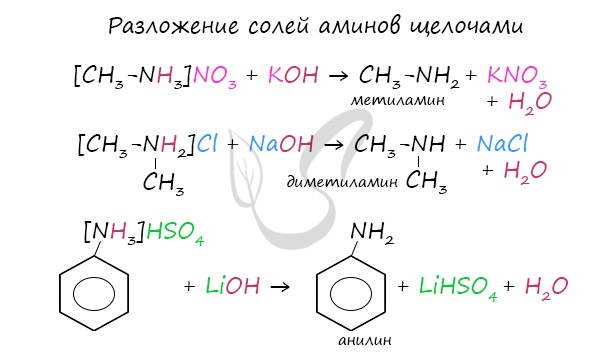
Разложение солей аминов
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
Горение аминов
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2