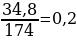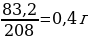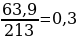Итоговая (стандартизированная) контрольная работа по химии
за курс «Химия. 9 класс»
Вариант № 1
А1. Распределение электронов по энергетическим уровням 2е, 8е, 2е соответствует частице 1) Мg0 2) О2- 3) Мg2+ 4) S2-
А2. В ряду элементов Na – Mg – Al - Si
уменьшаются радиусы атомов
уменьшается число протонов в ядрах атомов
увеличивается число электронных слоёв в атомах
уменьшается высшая степень окисления атомов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
природа реагирующих веществ
температура
концентрация реагирующих веществ
4)тип химической реакции
А4. Наиболее электропроводным металлом из перечисленных является
цинк 3) свинец
медь 4) хром
А5. Металл, не относящийся к щёлочноземельным,
1)магний 3) стронций
2)кальций 4) барий
А6. Наиболее активно реагирует с водой
скандий 3) калий
магний 4) кальций
А7. Агрегатное состояние иода при нормальных условиях
жидкое 2) твёрдое 3) газообразное
А8.Металл, с которым не взаимодействует концентрированная серная кислота,
1)железо 2)магний 3)цинк 4)натрий
Часть В. Тестовые задания на соответствие.
В1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Реагирующие Продукты их
вещества взаимодействия
А) Cu +Cl2 1) Cu(OH)2 и Cl2
Б) CuО + HCl 2) CuCl
В) Cu 2О + HCl 3) CuCl2 и H2O
4) CuCl2
5) CuCl и H2O
В2. Установите соответствие между типами и уравнениями химических реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) соединения, ОВР, необратимая
Б) разложения, ОВР, эндотермическая
В) соединения, ОВР, гомогенная
УРАВНЕНИЯ РЕАКЦИЙ
N2(г) + 3H2(г) ↔ 2NH3(г) + Q
2КNO3 = 2KNO2 + O2 +Q
FeO + C → Fe + CO -Q
4Fe + 3O2 + 6H2O = 4Fe(OH)3
2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения Zn → ZnCl2 → Zn(OH)2 → ZnO
Для перехода 2 запишите ионное уравнение.
С2. . К 34,8г сульфата калия прилили раствор, содержащий 83,2 г хлорида бария. Определите массу образовавшегося осадка. (5б).
С3.Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu +HNO3→Cu(NO3)2+NO +H2O.
Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс».
Вариант № 2
А1. Распределение электронов по энергетическим уровням 2е, 8е, 6е соответствует атому
углерода 3) фосфора
серы 4) хлора
А2. В ряду элементов С –N - О - F
уменьшается высшая степень окисления элементов в соединениях
увеличиваются радиусы атомов
уменьшается восстановительная способность простых веществ
увеличивается высшая степень окисления элементов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
катализатор
способ получения реагентов
природа реагирующих веществ
концентрация реагирующих веществ
А4. Металл, не относящийся к щелочным металлам,
калий 3) литий
кальций 4) натрий
А5. Свойство ртути, которое ограничивает её применение в бытовых термометрах
агрегатное состояние
температура плавления
токсичность
высокая плотность
А6. Водород нельзя получить путём взаимодействия металлов с кислотой
азотной 3) соляной
серной 4) фосфорной
А7. Свойство, характерное для озона,
хорошо растворяется в воде
не имеет запаха
бактерициден
легче воздуха
А8. Вода взаимодействует с каждым из веществ, формулы которых
1)Ca и Na2O 2) Na2O и Cu 3)CuO и N2O5 4)ZnO и SO2
Часть В. Тестовые задания на соответствие.
В2. Установите соответствие между исходными веществами и продуктами реакций.
Исходные вещества Продукты реакции
А) Na и H2O 1) Na2SO3 и H2O
Б) Na2O и H2O 2) NaOH и H2O
В ) NaOH и SO2 3) NaOH и H2
4) NaOH
В2. Установите соответствие между типами и уравнениями реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) замещения, ОВР, эндотермическая
Б) разложения, ОВР, экзотермическая
В) соединения, ОВР, необратимая
УРАВНЕНИЯ РЕАКЦИЙ
N2(г) + 3H2(г) ↔ 2NH3(г) + Q
2КNO3 = 2KNO2 + O2 +Q
FeO + C → Fe + CO -Q
4Fe + 3O2 + 6H2O = 4Fe(OH)3
2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения MgO→ MgCI2→Mg(OH)2→ Mg(NO3)2
Для перехода 3 запишите ионное уравнение.
С2. К раствору, содержащему 63,9г нитрата алюминия, прилили раствор, содержащий 39,2г фосфорной кислоты. Определите массу фосфата алюминия.
С3. Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu + HNO3→ Cu(NO3)2 + NO2 + H2O
Рекомендации по оцениванию работы
Максимальное количество баллов – 21 балл
Задания базового уровня (А1-А8), только один правильный ответ. (1 балл)
Задания повышенного уровня (В1-В2), найти соответствие. (2 балла)
Задание С1, С2, С3 - требуют полного ответа. (3 балла)
Соответствие баллов, полученных за выполнение заданий, отметке/оценке по пятибалльной шкале оценивания
| Отметка | 2 | 3 | 4 | 5 |
| Число баллов за работу | 0-9 | 10-13 | 14-17 | 18-21 |
Ответы: Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс
| Вариант 1. Часть А. 1 1 4 1 1 3 2 1
Часть В. А-4, Б-3, В-5. А-4, Б-2, С- 1. Часть С. 1. Zn + Cl2 = ZnCl2 ZnCl2 + 2KOH = Zn(OH)2 + 2KCl Zn(OH)2 = ZnO + H2O
2. Задача 34,8г 83,2г х К2SO4 + BaCl2 → BaSO4 + 2KCl 1*174г 1*208г 1*233
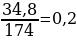 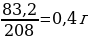
Х = 0,2*233 = 46,6г
3. 3Cu⁰+8HN⁺⁵O3(разб.)=3Cu⁺²(NO3)2+2N⁺²O+4H2O
Сu⁰ - 2e⁻ = Cu⁺² | 3 - восстановитель
N⁺⁵ + 3e⁻ = N⁺² | 2 - окислитель
| Вариант 2 Часть А. 3 3 2 2 3 1 3 1
Часть В. А-3, Б-4, В-1. А-3, Б-2, В- 4. Часть С. 1. MgO+2HCl=MgCl2+H2O MgCl2+2KOH=Mg(OH)2+2KCl Mg(OH)2+2HNO3=Mg(NO3)2+2H2O
2. Задача 63,9г 39,2г х Al(NO3)3 + H3PO4 → AlPO4 + 3HNO3 1*213г 1*98г 1*122г
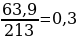 
Х = 0,3*122 = 36,6г
3. Cu⁰+4HN⁺⁵O3(конц.)=Cu⁺²(NO3)2+2N⁺⁴O2+2H2O
Сu⁰ - 2e⁻ = Cu⁺² | 1 - восстановитель
N⁺⁵ + e⁻ = N⁺⁴ | 2 - окислитель
|