Из опыта работы по дистанционному обучению в школе
учителя химии ГОУ ЛНР «Стахановская СОШ №32 им. П.Л. Дрёмова»
Дистанционное обучение стремительно ворвалось в систему школьного образования на период затяжного карантина, связанного с пандемией «короновируса». Как проводить уроки, как их создавать? Для меня, и я думаю, для многих учителей, это стало проблемой. Конечно, каждый педагог подошёл к этому вопросу самостоятельно, творчески. Ведь это не просто переписать с учебника задание, указав параграф. Нужно так составить урок, чтобы ученику было интересно его изучать, чтобы он захотел выполнить задания к уроку. Значит, задания должны быть посильны для него, чтобы он с удовольствием их выполнял, и, получив хорошую оценку, захотел и дальше получать задания. По времени урок должен продолжаться 20-25 минут. Поэтому, за такой небольшой промежуток времени необходимо дать минимум знаний и в то же время проверить как ученик их усвоил. Чаще всего прибегаю к тестированию, продолжить предложение, указать ложные или верные утверждения, и так далее.
Начинать урок можно с видеоурока по ссылке. Это всем известные российские сайты https://resh.edu.ru, https://videouroki.net/video/himiya/
Затем можно предложить ученику либо составить краткий конспект по данному уроку, либо дать задания по видеоуроку. А дальше я применяю свою методику контроля. Ну, а если нет видеоурока, тогда я использую презентации по ссылке, или могу брать из учебника материал в вопросах.
Наблюдая за учащимися, делаю вывод, что многим интересно на таких уроках, и с каждым разом их ответы становятся точными. Мне интересно читать ответы учащихся, которые требуют рассуждения, из которых можно узнать, насколько он эту тему понял.
Осуществляя контакт с учащимися, я не ощущаю большого расстояния. Наоборот, мне они становятся ближе.
Предлагаю два дистанционных урока:
Дата 07. 05 2020
7 класс Химия
Тема урока: Повторение темы « Валентность»
Цель урока: .Повторить материал, выполнить задания.
Записать в тетрадях число : Седьмое мая
Классная работа
Повторение темы « Валентность»
Посмотри ещё раз видео урок по ссылке:
https://resh.edu.ru/subject/lesson/1520/ 8 кл. урок №6
Выполни задания:
1. Что такое валентность?
2. Для чего нужна валентность?
3. Какими цифрами обозначается валентность и где она ставится?
4. Чему равна валентность водорода? кислорода?
5 Лови ошибку, химик! Какое вещество с неправильной формулой? Почему?
SO2 BaO2 P2O5 N2O5
6 . Определи валентность элементов в веществах :
SiH4 CrO3 H2S CO2 SO3 Fe2O3 SO2 FeO Na2O MnO2 PH3 Au2O3
7. Составь химические формулы по валентности элементов:
III III IV II III II I IV
NH AIO CH CuO РН CaCl SnO
8. Исправь ошибки, допущенные в некоторых формулах:
AIO3 СаO3 NaO MnО3
Успехов в изучении химии!
Дата. 09.04 .2020 Химия
Класс. 8
Тема: Составление электронных формул первых 20 элементов ПС Д.И. Менделеева
Цель: Изучить материал, выполнить задания, усвоить тему.
Запиши в тетради число: Девятое апреля
Классная работа.
Тема: Составление электронных формул первых 20 элементов ПС Д.И. Менделеева
Посмотри видео урок по ссылке https://resh.edu.ru/subject/lesson/2050/main/
Прочти внимательно конспект
I. Чтобы читать электронные формулы, необходимо понять строение атома. Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
Орбитали могут иметь разную геометрическую конфигурацию:
s-орбитали – сферические;
р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
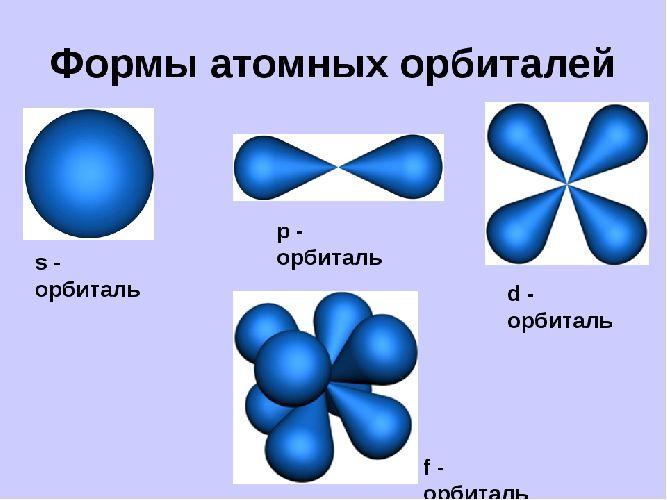
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
| Виды электронных орбиталей | Форма орбитали в пространстве | Количество орбиталей в атоме. Условное обозначение орбитали – клетка:
|
| s – орбиталь (электронное облако s – электрона) | 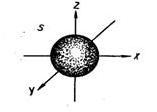 сфера (шар) сфера (шар)
| Электронное облако такой формы может занимать в атоме одно положение (условное обозначение)
|
| p – орбиталь (электронное облако p – электрона) | гантель (восьмёрка) | Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. (условное обозначение)
|
| d – орбиталь (электронное облако d – электрона) | четырёхлепестковая форма | Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре.
А пятая - вроде гантели, продетой в бублик. (условное обозначение) |
| f – орбиталь (электронное облако f – электрона) | сложная форма | Электронное облако такой формы может занимать в атоме семь положений. (условное обозначение) |
II. Условное обозначение электрона – стрелка, направленная вверх ↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз ↓ (электрон вращается вокруг собственной оси против часовой стрелки).
Число электронов в атоме определяют по порядковому номеру :
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг
своей оси в противоположных направлениях (по часовой стрелке и против часовой
стрелки) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s2); на p – орбитали максимально может разместиться шесть электронов (p6) на d – орбитали максимально может разместиться десять электронов (d10); f – четырнадцать электронов (f14).
III. Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Условное обозначение уровня – скобка )
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.
IV.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя
электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
Формулы, отражающие строение атома водорода:
H +1 )1e – схема строения атома, отображает распределение электронов по энергетическим уровням.
+1 Н 1s1 – электронная формула, отображает число электронов по орбиталям.
- электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
Чтобы уметь составлять электронные формулы посмотри видео урок по ссылке https://www.youtube.com/watch?v=Li7nScgVwRs
Внимание! Тебе смотреть видео, заканчивая заполнение атома кальция. В учебнике этого нет, поэтому наберись терпения!!!
Задание
Составить электронные формулы элементов: углерода, фосфора, аргона, кальция.
Для закрепления знаний прочти § 53 учебника Химия 8 класс
Успехов в познании химии!!!






 сфера (шар)
сфера (шар)

















