
Лекция №5
Классификация неорганических веществ и их свойства

- Классификация неорганических веществ.
- Способы получения, номенклатура, физические и химические свойства основных, кислотных и амфотерных оксидов; амфотерных гидроксидов, кислот, оснований.
- Генетическая связь между классами неорганических веществ.
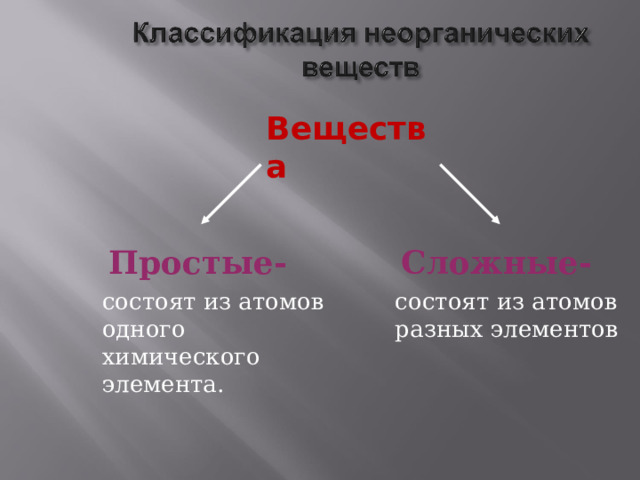
Вещества
Простые-
состоят из атомов одного химического элемента.
Сложные-
состоят из атомов разных элементов
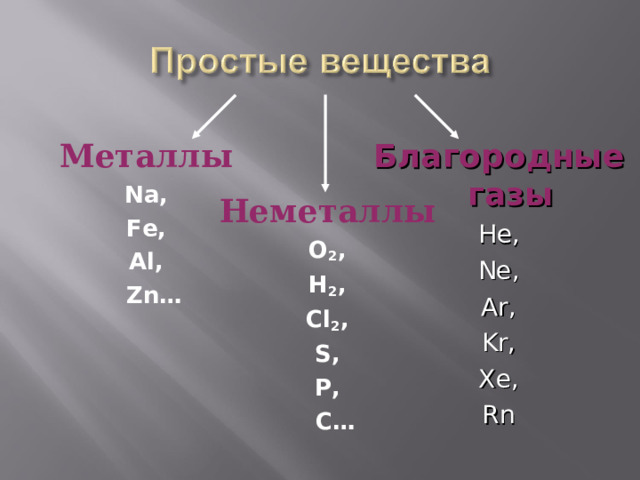
Благородные газы
He,
Ne,
Ar,
Kr,
Xe,
Rn
Металлы
Na,
Fe,
Al,
Zn…
Неметаллы
O 2 ,
H 2 ,
Cl 2 ,
S,
P,
C…
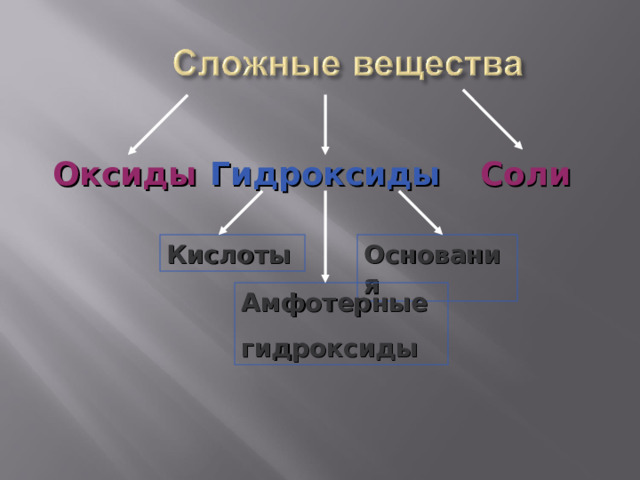
Гидроксиды
Соли
Оксиды
Кислоты
Основания
Амфотерные
гидроксиды

- Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
- Na 2 O, Mg +2 O , Al 2 O 3
NaO Н , Mg +2 O Н , Al ( O Н) 3
- В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз.
+3
+1
основные амфотерный
+3
+1
щелочь
Амфотерный
гидроксид
Слабое
основание

Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2
Общая формула:
Э m O n
m число атомов элемента Э ,
n – число атомов кислорода.
Называют так – «оксид элемента» (степень окисления), если она переменна.
Примеры C O 2 оксид углерода ( IV )
Fe O оксид железа ( II )
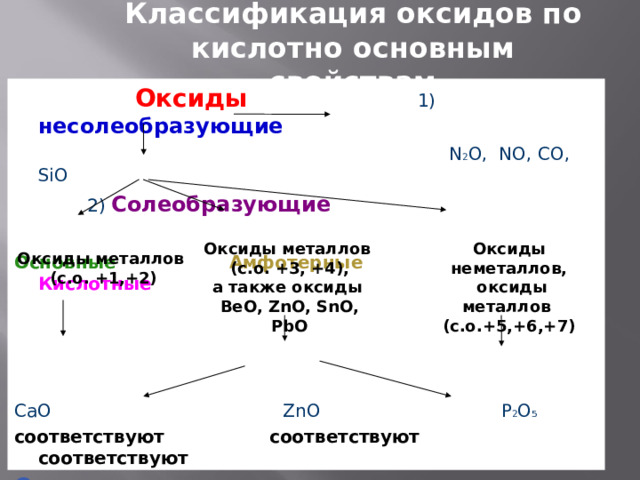
Классификация оксидов по кислотно основным свойствам
Оксиды 1) несолеобразующие
N 2 O, NO, CO, SiO
2) Солеобразующие
Основные Амфотерные Кислотные
CaO ZnO P 2 O 5
соответствуют соответствуют соответствуют
Основания кислоты
Ca(OH) 2 H 3 PO 4
Оксиды неметаллов,
оксиды металлов
(с.о.+5,+6,+7)
Оксиды металлов
(с.о. +3, +4),
а также оксиды
ВеО, ZnO, SnO, PbO
Оксиды металлов
(с.о. +1,+2)

Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли
Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием соли и воды. Им соответствуют гидроксиды, содержащие элемент в той же степени окисления.

Общая формула Ме 2 О, МеО
Физические свойства
- При комнатной температуре основные оксиды твердые , кристаллические вещества чаще всего нерастворимые в воде ;
- Окрашенные в различные цвета, например Cu 2 O – красного цвета, СаO – белого.
CuO
CaO
В aO
Cu 2 O

ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.)
1) О.О. + кислота =соль + вода (реакция обмена)
CaO + H 2 SO 4 → CaSO 4 + H 2 O
2) О.О. + кислотный оксид = соль
(реакция соединения)
С aO + SiO 2 = CaSiO 3
3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na 2 О + H 2 O → 2NaOH
4) О.О. + амфотерный оксид = соль
Na 2 О + ZnO → Na 2 ZnO 2

Агрегатное состояние различное: Р 2 О 5 – твердый, SiO 2 – твердый, СО 2 – газообразный, SO 3 – жидкий при комнатной температуре, затвердевающий уже при 17°С в твердую кристаллическую массу.
Имеют различный цвет .
Все кислотные оксиды, кроме SiO 2 , растворимы в воде.
SiO 2
Р 2 О 5

Химические свойства кислотных оксидов (К.О.)
1) К.О. + основание = соль + вода (реакция обмена )
CO 2 + Mg ( O Н) 2 = MgCO 3 + H 2 O
2) К.О. +О.О. = СОЛЬ (реакция соединения)
SO 3 + MgO = MgSO 4
3) К.О. + вода = кислота (кроме SiO 2 )
(реакция соединения)
Р 2 O 5 + 3 H 2 O = 2 H 3 Р O 4

- Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства.
- Примеры: ZnO, Al 2 O 3 , Cr 2 O 3 , V 2 O 3
- Амфотерные оксиды с водой непосредственно не соединяются.

Al 2 O 3 (оксид алюминия) очень твердые прозрачные кристаллы. Температура плавления – 2053 °C, температура кипения – 3000 °C.
Оксид алюминия как минерал называется корунд.
Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: рубин, сапфир.
Cr 2 O 3 (оксид хрома(III)) – кристаллы зеленого цвета, нерастворимые в воде.
Используют как пигмент при изготовлении декоративного зеленого стекла и керамики .
ZnO (оксид цинка) – бесцветный кристаллический порошок, нерастворимый в воде. И спользуется для приготовления белой масляной краски (цинковые белила)

Элементы, образующие амфотерные оксиды и гидроксиды
Неметаллы, исключая элементы побочных подгрупп
Металлы
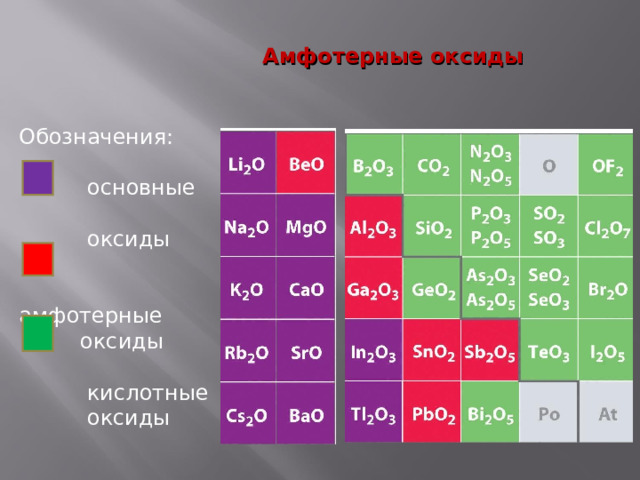
Амфотерные оксиды
Обозначения:
основные
оксиды
амфотерные
оксиды
кислотные
оксиды

Основные свойства
- С кислотами: ZnO + 2НС l → Zn С l 2 + Н 2 О
- С кислотными оксидами: ZnO + SiO 2 = ZnSiO 3
силикат цинка
Кислотные свойства
- С основаниями: ZnO + 2 Na ОН = Na 2 ZnO 2 +Н 2 О
цинкат натрия
2. С основными оксидами: ZnO + Mg О = MgZnO 2

1) Взаимодействие простых веществ с кислородом.
S + O 2 —› SO 2
4Al + 3 O 2 —› 2Al 2 O 3
2) Взаимодействие простых веществ и солей с кислотами-окислителями.
C + 4HNO 3 (р-р) —› С O 2 + 4NO 2 + H 2 O
Cu + 4HNO 3 (конц.) —› Cu(NO 3 ) 2 + 2NO 2 + + 2H 2 O
Na 2 SO 3 + 2H 2 SO 4 —› 2 NaHSO 4 + SO 2 + H 2 O
3) Горение
- сложных веществ: СН 4 + 2О 2 = СО 2 + 2Н 2 О
- простых веществ: 2 Mg + О 2 = 2 Mg О

4) Термическое разложение
Cu ( O Н) 2 = Cu О + H 2 O
CaCO 3 = CaO + CO 2
Mg(OH) 2 = MgO + H 2 O
2. Некоторых кислот
H 2 SiO 3 = SiO 2 + H 2 O
2H 3 BO 3 = B 2 O 3 + H 2 O
3. Некоторых солей
СаСО 3 = СО 2 + Н 2 О

Гидроксиды – это неорганические соединения, содержащие в составе гидроксильную группу (- ОН )
Общая формула:
Э(ОН) n
где Э – элемент (металл или неметалл)
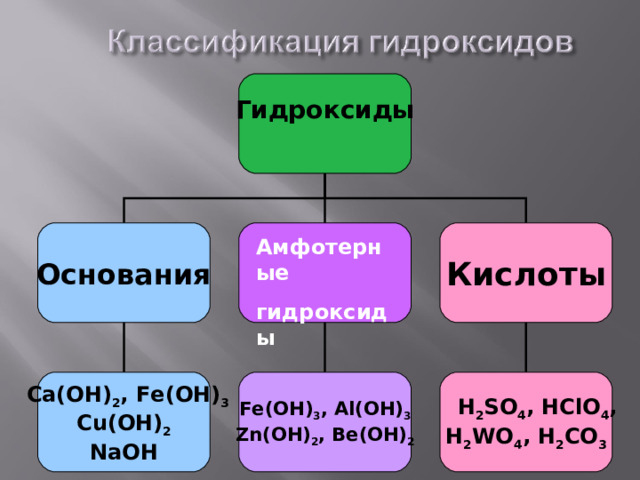
Гидроксиды
Основания
Кислоты
Амфотерные
гидроксиды
Ca (ОН) 2 , Fe ( O Н) 3
Cu (ОН) 2
Na ОН
Fe ( O Н) 3 , Al ( O Н) 3
Zn ( O Н) 2 , Be ( O Н) 2
Н 2 SO 4 , Н ClO 4 ,
Н 2 WO 4 , Н 2 СО 3

Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов ( ОН )
-
где М – металл, n – число групп ОН и в то же время заряд иона металла
М(ОН) n
+2
+3
+
NaOH Ca(OH) 2 Fe(OH) 3
Называем: гидроксид металла
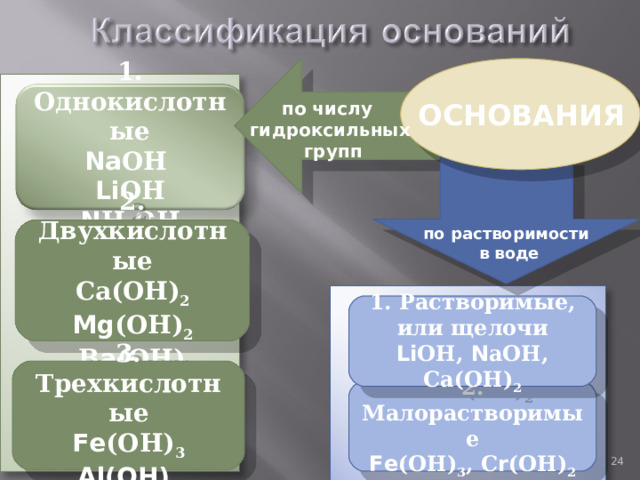
1. Однокислотные
Na ОН
Li ОН
N Н 4 ОН
ОСНОВАНИЯ
по числу
гидроксильных
групп
2. Двухкислотные
Са(ОН) 2
Mg (ОН) 2
В a (ОН) 2
по растворимости
в воде
1. Растворимые, или щелочи
Li ОН, N аОН, Са(ОН) 2
3. Трехкислотные
Fe (ОН) 3
Al(OH) 3
2. Малорастворимые
Fe (ОН) 3 , С r (ОН) 2
24

Основания.
Гидроксиды щелочных металлов
- Общая формула – МеОН
- Щелочи.
- Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
LiOH - гидроксид лития
Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH

Гидроксиды металлов II А группы
- Общая формула – Ме(ОН) 2
- Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН) 2 – в воде нерастворим.
- Основные свойства усиливаются в ряду:
Ве(ОН) 2 → Mg (ОН) 2 → Ca (ОН) 2 → Sr (ОН) 2 → В a (ОН) 2
- Ве(ОН) 2 – амфотерный гидроксид
- Mg (ОН) 2 – слабое основание
- Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи.

- Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый

2. Взаимодействуют со всеми кислотами ( реакция нейтрализации )
NaOH + HCl → NaCl + H 2 O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
4. Взаимодействуют с растворами солей, если образуется газ или осадок
2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4
![5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными гидроксидами 2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ]](https://fsd.multiurok.ru/html/2022/07/19/s_62d65b3391623/img28.jpg)
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными гидроксидами
2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ]

1. Взаимодействуют с кислотами ( реакция нейтрализации )
Fe(OH) 2 + H 2 SO 4 → FeSO 4 + 2H 2 O
2. Разложение при нагревании. Нерастворимые основания при нагревании разлагаются на основный оксид и воду:
t o
Cu(OH) 2 ↓ → CuO + H 2 O

1. Взаимодействие щелочных и щелочно-земельных металлов их оксидов с водой
2 Na + 2H 2 O = 2 NaOH + H 2
Са O + H 2 O = Са( O Н) 2

2. Взаимодействие раствора щелочи с раствором соли
3 NaOH + А lCl 3 = Al(OH) 3 + 3 NaCl
2Na ОН + CuSO 4 → Cu(OH) 2 + Na 2 SO 4

Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
При электролитической диссоциации кислот в водном растворе образуются катионы водорода и анион кислотного остатка
НС l H + + С l - H 2 SO 4 3H + +PO 4 3-

- При обычных условиях кислоты могут быть жидкими и твердыми (борная, ортофосфорная, вольфрамовая)
- Кислоты –едкие жидкости (кроме кремневой), с кислым вкусом, без запаха, разъедают многие вещества, ткани .

Признаки
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
А) кислородные;
Б) бескислородные
Основность
А) H 3 PO 4 , H 2 SO 4 ;
, Б) HBr, H 2 S
А) одноосновные;
Б) многоосновные
Растворимость в воде
Летучесть
А) растворимые;
Б) нерастворимые
А) HNO 3 , HCl ;
Б) H 2 SO 4 , H 3 PO 4
А) HNO 3 , HCl ;
Б) H 2 SiO 3
А) летучие;
Б) нелетучие
Степень диссоциации
А) H 2 S, HNO 3
Б) H 2 SO 4 , H 3 PO 4
А) сильные;
Б) слабые
Стабильность
А) HNO 3 , HCl ;
Б) H 2 SO 3 , H 2 CO 3
А) стабильные;
Б) нестабильные
А) H 2 SO 4 , HCl
Б) H 2 SO 3 , H 2 CO 3
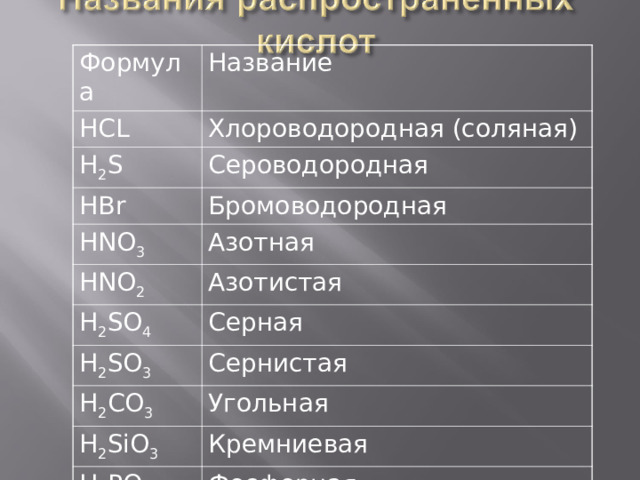
Формула
Название
HCL
Хлороводородная (соляная)
H 2 S
Сероводородная
HBr
Бромоводородная
HNO 3
Азотная
HNO 2
Азотистая
H 2 SO 4
Серная
H 2 SO 3
Сернистая
H 2 CO 3
Угольная
H 2 SiO 3
Кремниевая
H 3 PO 4
Фосфорная
HF
Фтороводородная (плавиковая)

1. Кислота + основание = соль + вода
H 2 SO 4 +2 NaOH = Na 2 SO 4 + 2H 2 O
2. Кислота + оксид металла = соль + вода
2 HCL+CuO = CuCL 2 + H 2 O

3. Кислота + металл = водород + соль
2HCL +Zn = ZnCL 2 + H 2
Условия : - в ряду напряжений металл должен стоять до водорода
- в результате реакции должна получиться растворимая соль
4. Кислота + соль = новая кислота + новая соль
Условия : - в результате реакции должны получиться газ, осадок или вода.
BaCL 2 + H 2 SO 4 = BaSO 4 + 2HCL

1. Взаимодействие кислотных оксидов с водой
SO 3 + H 2 O = H 2 SO 4 ; CO 2 + H 2 O = H 2 CO 3 ;
2. Вытеснение более летучей кислоты из её соли менее летучей кислотой
NaCl + H 2 SO 4 ( конц.) = HCl + Na 2 SO 4
3. Гидролиз галогенидов или солей
P Cl 5 + 4 H 2 O = 3H 3 PO 4 + 5 HCl
4. Из простых веществ (для бескислородных кислот)
H 2 + Cl 2 = HCl
H 2 + S = H 2 S

Амфотерными называются гидроксиды , которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, проявляя основные свойства.

Гидроксид алюминия можно записать как основание и как кислоту
Al( OH ) 3
=
Al O 3 H 3
=
Основание
H 3 AlO 3
=
Кислота

Некоторые гидроксиды с кислотно-основными свойствами:
элемент
Гидроксид-основание
Ве
Гидроксид-кислота
Ве(ОН) 2
Zn
Zn(OH) 2
Н 2 ВеО 2
Al
Cr
H 2 ZnO 2
Al(OH) 2
Cr(OH) 3
H 3 AlO 3 - алюминивая кислота (ортоформа).
HAlO 2 – метаалюминиевая кислота (метаформа)
Pb
H 3 CrO 3- хромовая кислота (ортоформа)
HCrO 2- метахромовая кислота (метаформа)
Pb(OH) 4 PbO(OH) 2
(PbO nH 2 O)
H 4 PbO 4 – (ортоформа)
H 2 PbO 3- (метаформа)
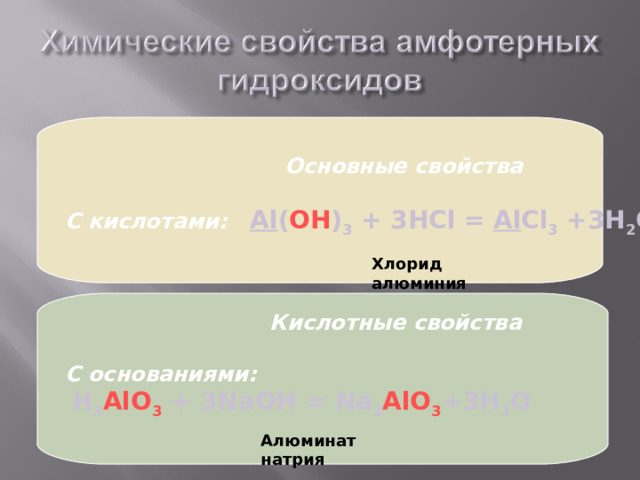
Основные свойства
С кислотами: Al ( OH ) 3 + 3HCl = Al Cl 3 +3H 2 O
Хлорид алюминия
Кислотные свойства
С основаниями:
H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O
Алюминат натрия

Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента
AlCl 3 + N а OH = Al(OH) 3 + 3N а Cl
ZnCl 2 + 2KOH = Zn(OH) 2 + 2KCl.

Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Ba SO 4 K 3 N Na 3 PO 4
Соли образуются при замещении атомов
водорода в кислоте на ионы металлов.
Например:
HCl Na Cl HNO 3 Na NO 3
H 2 S Na 2 S H 2 SO 4 Na 2 SO 4
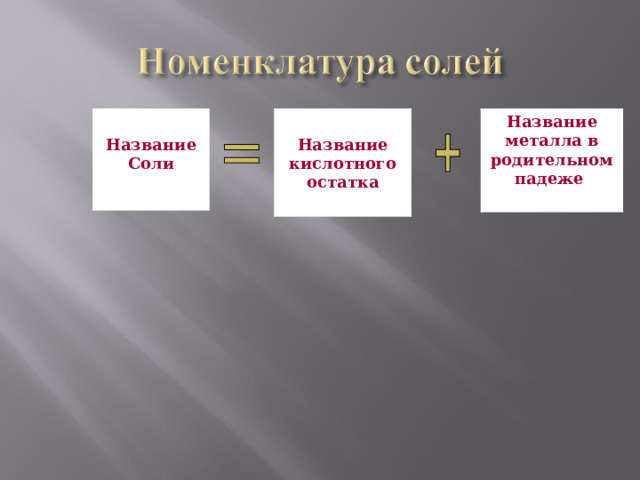
Название металла в родительном падеже
Название
Соли
Название кислотного остатка

- называем неметалл ( латинское название) с суффиксом – ид (в им. падеже);
- Металл (в род. падеже).
NaCl – хлор ид натрия
Al 2 S 3 – сульф ид алюминия
FeBr 2 – бром ид железа ( II )
FeBr 3 – бром ид железа ( III )

- Называем ион кислотного остатка (в именительном падеже);
с суффиксами:
-ат для высшей степени окисления;
-ит для низшей степени окисления.;
- Называем металл (в родительном падеже).
Na 2 SO 4 – сульф ат натрия
Na 2 SO 3 - сульф ит натрия
Fe (NO 2 ) 2 – нитр ит железа ( II )
Fe (NO 3 ) 3 – нитр ат железа ( III )
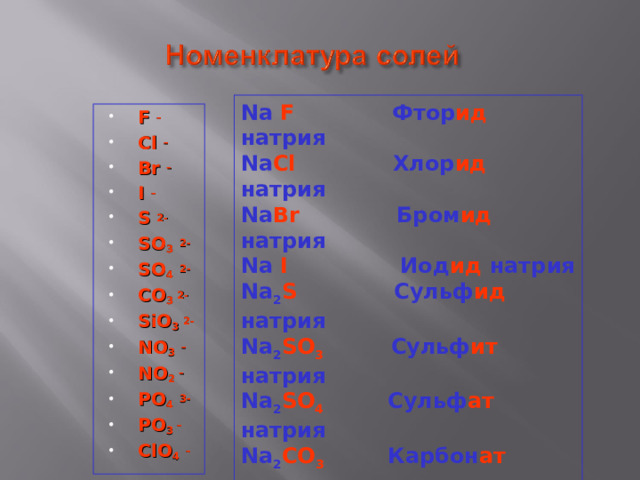
Na F Фтор ид натрия
Na Cl Хлор ид натрия
Na Br Бром ид натрия
Na I Иод ид натрия
Na 2 S Сульф ид натрия
Na 2 SO 3 Сульф ит натрия
Na 2 SO 4 Сульф ат натрия
Na 2 CO 3 Карбон ат натрия
Na 2 SiO 3 Силик ат натрия
Na NO 3 Нитр ат натрия
Na NO 2 Нитр ит натрия
Na 3 PO 4 Орто фосф ат натрия
Na PO 3 Мета фосф ат натрия
NaClO 4 Хлор ат натрия
- F –
- Cl –
- Br –
- I –
- S 2-
- SO 3 2-
- SO 4 2-
- CO 3 2-
- SiO 3 2-
- NO 3 –
- NO 2 –
- PO 4 3-
- PO 3 –
- ClO 4 –

Первое действие: записываем
степени окисления элементов,
находим наименьшее общее кратное
Al 3+ S 2-
Второе действие: находим
индекс алюминия
6 : 3 = 2
Третье действие: находим
индекс серы +3 2 -
6 : 2 = 3 Al 2 S 3
6

Первое действие: находим
наименьшее общее кратное
Второе действие: находим Ca 2+ (PO 4 ) 3-
индекс кальция
6 : 2 = 3
Третье действие: находим
индекс кислотного остатка 2 + 3 -
6 : 3 = 2 Ca 3 (PO 4 ) 2
6
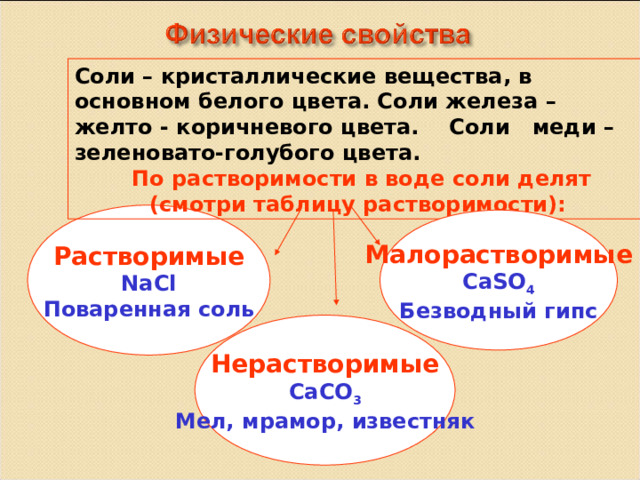
Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
NaCl
Поваренная соль
Малорастворимые
CaSO 4
Безводный гипс
Нерастворимые
CaCO 3
Мел, мрамор, известняк
![Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы металла. NaCl, Na 2 SO 4 , Na 3 PO 4 Кислые - это соли, в которых атомы водорода замещены только частично. NaHSO 4 , Na 2 HPO 4 , NaH 2 PO 4 Основные - это соли, в которых группы ОН соответствующего основания частично замещены на кислотные остатки. MgOHCl, Al(OH) 2 NO 3 Двойные ( смешанные ) - это соли, в которых содержится два разных катиона и один анион. KAl(SO 4 ) 2 , Fe(NH 4 ) 2 (SO 4 ) 2 Комплексные - это соли, в состав которых входит комплексный йон. Na 2 [Zn(OH) 4 ], K 3 [Fe(CN) 6 ]](https://fsd.multiurok.ru/html/2022/07/19/s_62d65b3391623/img52.jpg)
Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы металла.
NaCl, Na 2 SO 4 , Na 3 PO 4
Кислые - это соли, в которых атомы водорода замещены только частично.
NaHSO 4 , Na 2 HPO 4 , NaH 2 PO 4
Основные - это соли, в которых группы ОН соответствующего основания частично замещены на кислотные остатки.
MgOHCl, Al(OH) 2 NO 3
Двойные ( смешанные ) - это соли, в которых содержится два разных катиона и один анион.
KAl(SO 4 ) 2 , Fe(NH 4 ) 2 (SO 4 ) 2
Комплексные - это соли, в состав которых входит комплексный йон.
Na 2 [Zn(OH) 4 ], K 3 [Fe(CN) 6 ]

- Соли реагируют с металлами ( исключения активные металлы: Li , Na , K , Ca , Ba - которые при обычных условиях реагируют с водой):
Fe + CuSO 4 = FeSO 4 + Cu
- Соли реагируют с кислотами:
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O
- Карбонаты, сульфиты разлагаются при нагревании :
СaCO 3 = CaO + CO 2

- Соли реагируют с некоторыми кислотными оксидами:
CaCO 3 + SiO 2 = CaSiO 3 + CO 2
- Соли реагируют с другими солями с образованием новых нерастворимых солей:
Na 2 SO 4 + BaCl 2 = BaSO 4 + 2NaCl
- Соли реагируют с растворимыми основаниями с образованием нерастворимого основания:
AlCl 3 + 3KOH = Al(OH) 3 + 3KCl

- Взаимодействие металлов и неметаллов:
2Fe + 3Cl 2 = 2FeCl 3
- Взаимодействие кислотных оксидов с основными и амфотерными оксидами:
CaO + CO 2 = CaCO 3
ZnO + SiO 2 = ZnSiO 3
- Взаимодействие двух разных солей с образованием новой
нерастворимой соли:
Na 2 CO 3 + CaCl 2 = CaCO 3 + 2NaCl
- Взаимодействие оснований и кислот:
NaOH + HCl = NaCl + H 2 O
- Взаимодействие более активного металла с солями:
FeCl 2 + Zn = ZnCl 2 + Fe
- Действие кислот на металлы, стоящие в ряду напряжений металлов до H 2 :
Zn + 2HCl = ZnCl 2 + H 2

Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого класса, называется генетической.
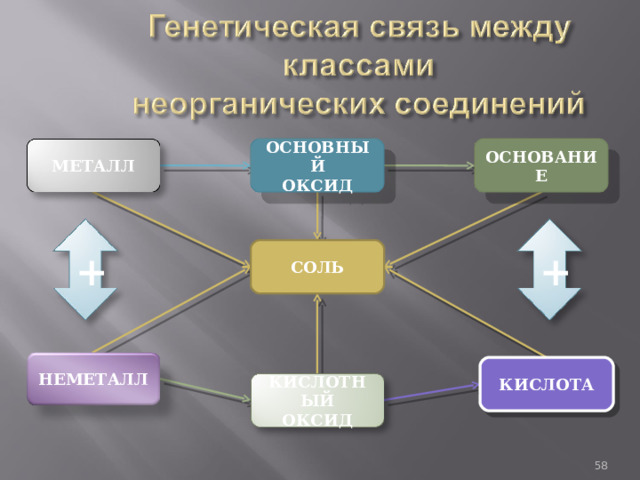
ОСНОВНЫЙ
ОКСИД
ОСНОВАНИЕ
МЕТАЛЛ
+
+
СОЛЬ
НЕМЕТАЛЛ
КИСЛОТА
КИСЛОТНЫЙ
ОКСИД

Генетическая связь отражается в генетических рядах. В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Генетический ряд металла показывает:
Металл → Основной оксид → Соль → Основание → Новая соль.
Уравнения реакций к генетическому кальция Ca → CaO → Ca(OH) 2 → CaCO 3 :
2Ca + O 2 = 2 CaO
CaO + H 2 O = Ca(OH) 2
Ca(OH) 2 + H 2 CO 3 = CaCO 3 + 2 H 2 O

Генетический ряд неметалла отражает такие превращения:
Неметалл→ Кислотный оксид →Кислота → Соль.
Уравнения реакций к генетическому ряду углерода C → CO 2 → H 2 CO 3 → CaCO 3 :

- Составить уравнения реакций к генетическому ряду углерода
- C → CO 2 → H 2 CO 3 → CaCO 3
- Назвать все вещества.
генетический ряд калия
K → K 2 O → KOH → KCl.

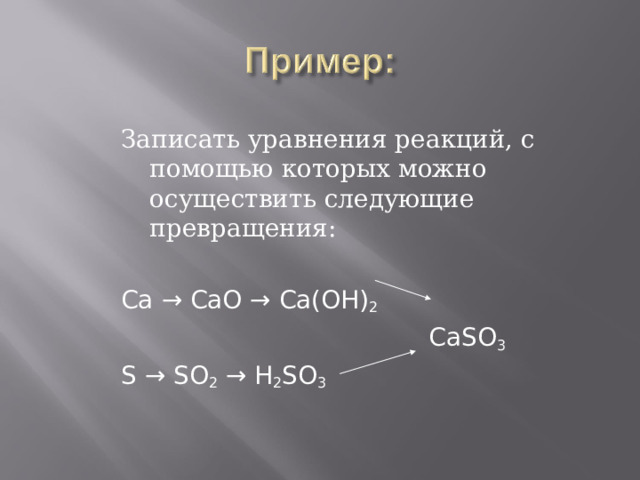
Записать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca → CaO → Ca(OH) 2
CaSO 3
S → SO 2 → H 2 SO 3

Решение:
2Ca + O 2 → CaO
CaO + H 2 O → Ca(OH) 2
Ca(OH) 2 + SO 2 → CaSO 3 + H 2 O
Ca(OH) 2 + H 2 SO 3 → CaSO 3 + 2H 2 O
S + O 2 → SO 2
SO 2 + H 2 O → H 2 SO 3
H 2 SO 3 + Ca(OH) 2 → CaSO 3 + 2H 2 O

Составьте уравнения реакций, схема которой дана ниже:
CaCO 3 → CaO → Ca(OH) 2 → CaCO 3 → Ca(NO 3 ) 2
- СaCO 3 = CaO + CO 2
- CaO + H2O = Ca(OH)2
- Ca(OH)2 + CO2 = CaCO3 + H2O
- CaCO3 + 2HNO3 = Ca(NO3)2 + 2H2O
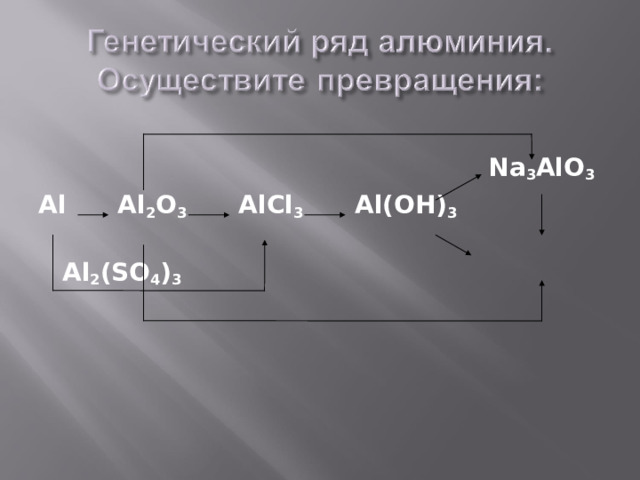
Na 3 AlO 3
Al Al 2 O 3 AlCl 3 Al(OH) 3
Al 2 (SO 4 ) 3

Для металлов можно выделить две разновидности рядов:
1 . Генетический ряд , в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следуюших превращений:
металл-- основный оксид -- щёлочь -- соль, например
генетический ряд калия
K → K 2 O → KOH → KCl.

2 . Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл--основный оксид--соль--нерастворимое основание--основный оксид--металл.
генетический ряд меди
Cu → CuO → CuCl 2 → Cu(OH) 2 → CuO → Cu

Среди неметаллов также можно выделить две разновидности рядов:
1 . Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл--кислотный оксид--растворимая кислота--соль.
генетический ряд фосфора
P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4 .

2 . Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота :
неметалл--кислотный оксид--соль--кислота--кислотный оксид--неметалл,
генетический ряд кремния
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
![Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента AlCl 3 + N а OH = Al(OH) 3 + 3N а Cl ZnCl 2 + 2KOH = Zn(OH) 2 + 2KCl. Существует опасность, что щелочь окажется в избытке: ZnSO 4 + 4NaOH ( изб.) = Na 2 [Zn(OH) 4 ] + Na 2 SO 4](https://fsd.multiurok.ru/html/2022/07/19/s_62d65b3391623/img70.jpg)
Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента
AlCl 3 + N а OH = Al(OH) 3 + 3N а Cl
ZnCl 2 + 2KOH = Zn(OH) 2 + 2KCl.
Существует опасность, что щелочь окажется в избытке:
ZnSO 4 + 4NaOH ( изб.) = Na 2 [Zn(OH) 4 ] + Na 2 SO 4

При составлении формулы соли необходимо:
- расставить заряды ионов металлов и заряды ионов кислотных остатков;
- по правилу креста расставить коэффициенты .
- Чётные коэффициенты сократить .

- Соли реагируют с металлами ( исключения активные металлы: Li , Na , K , Ca , Ba - которые при обычных условиях реагируют с водой):
Fe + CuSO 4 = FeSO 4 + Cu
- Соли реагируют с кислотами:
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O
- Карбонаты, сульфиты разлагаются при нагревании :
СaCO 3 = CaO + CO 2
- Некоторые соли способны реагировать с водой с образованием кристаллогидратов:
CuSO 4 + 5H 2 O = CuSO 4 * 5 H 2 O + Q

Солеобразующие оксиды ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
- Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
- Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами.
- Амфотерными оксидами , называют оксиды которые проявляют свойства как кислот, так и оснований .

































![5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными гидроксидами 2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ]](https://fsd.multiurok.ru/html/2022/07/19/s_62d65b3391623/img28.jpg)























![Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы металла. NaCl, Na 2 SO 4 , Na 3 PO 4 Кислые - это соли, в которых атомы водорода замещены только частично. NaHSO 4 , Na 2 HPO 4 , NaH 2 PO 4 Основные - это соли, в которых группы ОН соответствующего основания частично замещены на кислотные остатки. MgOHCl, Al(OH) 2 NO 3 Двойные ( смешанные ) - это соли, в которых содержится два разных катиона и один анион. KAl(SO 4 ) 2 , Fe(NH 4 ) 2 (SO 4 ) 2 Комплексные - это соли, в состав которых входит комплексный йон. Na 2 [Zn(OH) 4 ], K 3 [Fe(CN) 6 ]](https://fsd.multiurok.ru/html/2022/07/19/s_62d65b3391623/img52.jpg)

















![Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента AlCl 3 + N а OH = Al(OH) 3 + 3N а Cl ZnCl 2 + 2KOH = Zn(OH) 2 + 2KCl. Существует опасность, что щелочь окажется в избытке: ZnSO 4 + 4NaOH ( изб.) = Na 2 [Zn(OH) 4 ] + Na 2 SO 4](https://fsd.multiurok.ru/html/2022/07/19/s_62d65b3391623/img70.jpg)





















