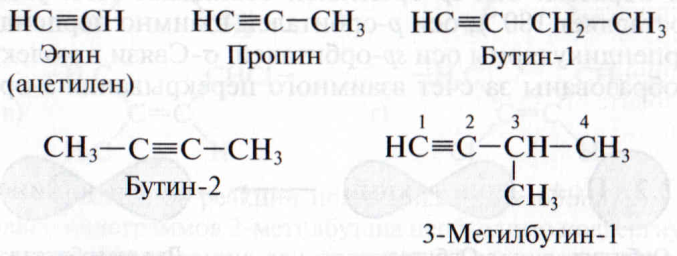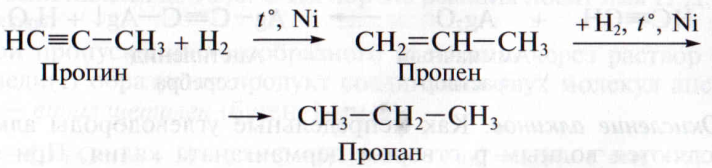Лекция № ____
Тема: Диеновые углеводороды. Ацетиленовые углеводороды
План:
Понятия «Алкадиены»
Электронное и пространственное строение молекул бутадиена
Гомологический ряд алкадиенов
Номенклатура и изомерия алкадиенов
Физические свойства алкадиенов
Химические свойства алкадиенов
Получение и применение алкадиенов
Понятия «Алкины»
Электронное и пространственное строение молекул этина
Гомологический ряд алкинов
Номенклатура и изомерия алкинов
Физические свойства алкинов
Химические свойства алкинов
Получение и применение алкинов
В молекулах углеводородов может содержаться не одна, а две или более двойных связей.
Алкадиенами (или диеновыми) называют углеводороды с открытыми углеродными цепями, в молекулах которых содержатся две двойные связи
Термин «диены» объясняется очень легко: суффикс «-ен-» указывает на наличие в углеводороде двойной углерод-углеродной связи. Следовательно, в «диенах» двойных связей две.
Диеновые углеводороды содержат на два атома водорода меньше, чем алкены. Нетрудно вывести их общую формулу: СnН2n-2.
В зависимости от взаимного расположения в молекуле диена двойные связи называют изолированными, кумулированными или сопряженными.
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями, их называют изолированными:
СН2=СН – СН2 – СН=СН2
Пентадиен-1,4
Свойства таких углеводородов полностью аналогичны свойствам алкенов. В реакциях присоединения может участвовать либо только одна двойная связь, либо обе независимо друг от друга.
Если две двойные связи располагаются при одном атоме углерода, их называют кумулированными:
СН2=С=СН2
Пропадиен (аллен)
Свойства кумуленов значительно отличаются от свойств алкенов и в нашем курсе рассматриваться не будут.
Если двойные связи разделены в молекуле одной s-связью, их называют cопряженными:
CH2=CH – СН=СН – СН3
Пентадиен-1,3
По международной номенклатуре положение двойных связей в молекуле диена указывают цифрами после названия вещества. Не забывайте о том, что цифры от названия отделяют дефисом, цифры между собой - запятой.
Наиболее важны в практическом отношении сопряженные алкадиены, строение и свойства которых рассмотрим далее.
В сопряженных диенах атомы углерода, связанные двойными связями, находятся в состоянии sр2- гибридизации. За счет sр2-гибридных орбиталей каждый из них образует три s-связи с соседними атомами. Оставшиеся р-орбитали всех четырех атомов углерода перекрываются между собой и образуют единое π-электронное облако. В сопряженной системе π-электроны уже не принадлежат определенным связям, они д е л о к а л и з о в а н ы по всем атомам, при этом связи имеют как бы промежуточный порядок между одинарной и двойной (рис.3.5).

Первый представитель гомологического ряда алкадиенов с сопряженными двойными связями - бутадиен-1,3 (дивинил) можно получить по реакции, предложенной в 1932 г. выдающимся советским химиком С. В.Лебедевым. Этот способ называют реакцией Лебедева; он заключается в дегидратации этилового спирта с одновременным дегидрированием:
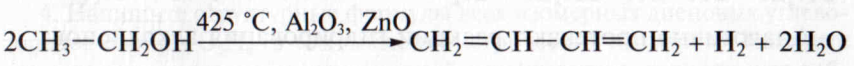
В настоящее время основным промышленным способом получения диеновых углеводородов с сопряженными связями является дегидрирование алканов. Например, 2-метилбутадиен-1,3 (изопрен) получают из 2-метилбутана в присутствии оксида xpoмa(III) в качестве катализатора:
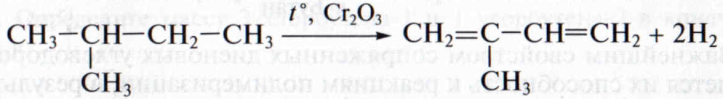
Наличие в молекуле диенов двойных связей обусловливает легкость протекания реакций присоединения, окисления и полимеризации. Особенность реакций присоединения и полимеризации состоит в том, что две сопряженные связи могут проявлять себя как единое целое. Например, при присоединении галогенов или галогеноводородов к бутадиену-1,3 наряду с продуктом 1,2-присоединения (по одной С=С связи) образуется продукт 1,4-присоединения (по концам сопряженной системы) с образованием новой двойной связи между центральными атомами углерода:
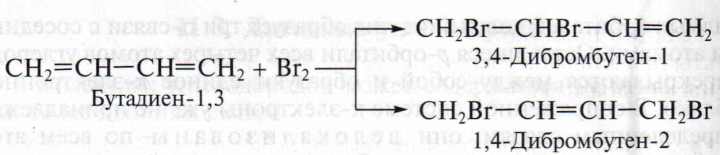
При прочих равных условиях реакция протекает преимущественно как 1,4-присоединение.
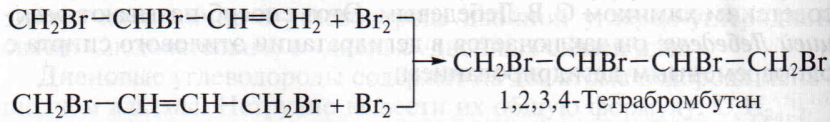
В молекулах образующихся дигалогенпроизводных остается двойная связь, способная присоединить вторую молекулу брома:
Аналогично протекают реакции гидрирования алкадиенов:
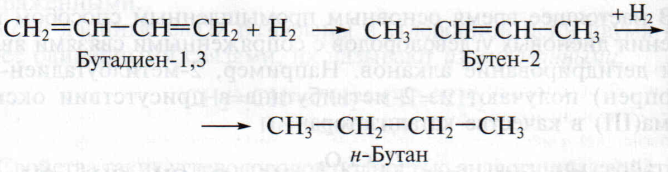
Важнейшим свойством сопряженных диеновых углеводородов является их способность к реакциям полимеризации, в результате которых получают синтетические каучуки. Например, при полимеризации бутадиена образуется полимерный продукт называемый бутадиеновым каучуком:
nСН2=СН – СН=СН2 à (–c СН2 – СН=СН – СН2 – )n
Следует обратить внимание, что процесс полимеризации протекает как 1,4-присоединение. Упрощенно течение реакции можно представить таким образом. Под действием внешних условий (нагревание, специальные реагенты) двойные углерод-углеродные связи разрываются, каждый из четырех атомов углерода приобретает неспаренный электрон.
Крайние атомы углерода (первыи и четвертыи) соседних молекул образуют друг с другом s-связи, соединяясь в длинную цепочку. «Средние» атомы углерода за счет неспаренных электронов образуют друг с другом вторую связь π-типа:
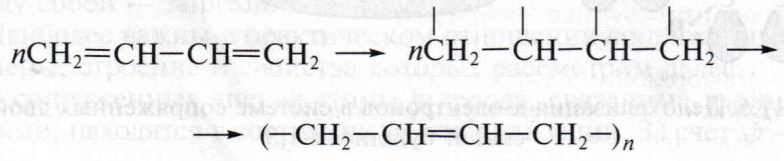
Реакции полимеризации и образующиеся в их результате продукты представляют особый интерес; они подробно будут рассмотрены в подразд.3.4.
3.4. Основные понятия химии высокомолекулярных соединений
Первые синтетические полимеры были получены случайно. По мере изучения процесса полимеризации и свойств образующихся продуктов эти исследования становились все более систематическими. В настоящее время нашу жизнь невозможно представить без полимеров. Они всё в большей степени вытесняют из нашего быта природные материалы, поскольку обладают уникальными и самыми разноплановыми свойствами, сравнительно дешевы, легко обрабатываются, многие подлежат вторичной переработке.
Полимерами (высокомолекулярными соединениями) называют вещества с очень высокой относительной молекулярной массой, молекулы которых состоят из множества повторяющихся структурных фрагментов .
Повторяющийся фрагмент полимерной цепи называют элементарным (или структурным) звеном полимера, а число элементарных звеньев в цепи - степенью полимеризации (n).
Поскольку степень полимеризации для разных молекул не является постоянной, говорят о ее среднем значении для полимера в целом и, следовательно, средней молекулярной массе. Полимеры получают из исходных низкомолекулярных веществ - мономеров:
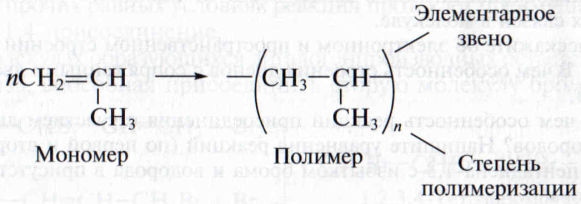
• Если в результате превращения мономера в полимер не выделяются никакие побочные вещества, реакцию называют полимеризацией; если образуются побочные низкомолекулярные продукты (вода, галогеноводороды, аммиак) – поликонденсацией.
В зависимости от строения цепи полимеры подразделяют на линейные, разветвленные и сетчатые (сшитые) (рис. 3.6). Линейные и в некоторых случаях разветвленные полимеры способны образовывать нитевидные волокна и пленки; они эластичны, имеют относительно невысокие температуры плавления, иногда растворяются в различных растворителях. В сетчатых (сшитых) полимерах отдельные углеродные цепи связаны (сшиты) поперечными связями, и вещество представляет собой как бы единую гигантскую молекулу. Примером линейного полимера является полиэтилен, разветвленного – крахмал, сетчатого – фенолформальдегидные смолы, с которыми вы познакомитесь в гл.8, 10. Свойство полимера изменять свою форму в нагретом состоянии и сохранять ее при охлаждении называют термопластичностью. Если полимер при нагревании теряет свою пластичность, становится твердым и последующей обработке уже не поддается, его называют термореактивным
Ниже приведены свойства некоторых наиболее важных полимеров, которые получают из алкенов и диенов.

Рис. 3.6. Строение линейного (а), разветвленного (б) и сетчатого (в) полимера
Полиэтилен. Один из первых синтетических полимеров – полиэтилен – был синтезирован в 1933 г. американскими исследователями Э. Фоссетом и Р. Гиббсоном. Он представляет собой прозрачный в тонком слое термопластичный материал, получаемый полимеризацией этилена:
nСН2=СН2 à (– СН2 – СН2)n
В зависимости от условий получения молекулярная масса полимера может составлять от 20 тыс. до нескольких миллионов. Это отражается на физических свойствах полиэтилена. Он может представлять собой вязкую жидкость, используемую для смазки трущихся деталей. Эластичный полиэтилен – незаменимый материал для изготовления водо- и газонепроницаемых пленок, бытовых предметов, упаковочных материалов, изоляции проводов. Поскольку эластичный полиэтилен получают полимеризацией этилена при высоком давлении, его так и называют – полиэтилен высокого давления (ПЭВД). Из-за сильной разветвленности молекул этот материал имеет небольшую механическую прочность.
Новые перспективы использования полиэтилена появились в 1953 г. с открытием немецким ученым К. Циглером особых катализаторов процесса полимеризации – металлоорганических соединений. К. Циглер установил, что в присутствии очень малых количеств TiCl4 и Al(С2Н5)3 (триэтилалюминий) полимеризация протекает при комнатной температуре и атмосферном давлении. При этом получают полимер молекулярной массой несколько миллионов, большой плотностью за счет компактной упаковки практически линейных молекул и очень высокой механической прочностью. Такой продукт стали называть полиэтиленом низкого давления (ПЭНД). Твердый полиэтилен идет на изготовление химической посуды, труб, различных предметов домашнего обихода. Многие потребительские свойства полиэтилена обусловлены его химической инертностью: он не реагирует с горячими концентрированными кислотами и щелочами, с трудом окисляется.
Полипропилен. Следующим логическим шагом в изучении полимеров стала попытка полимеризации пропилена. Впервые это удалось сделать в 1954 г. итальянскому ученому Д. Haттa с применением катализатора Циглера. Д. Haттa модифицировал катализатор таким образом, что полимерные цепочки стали «расти» с его поверхности, как волосы:
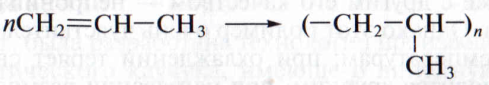
Полипропилен более ценен; обладает кристаллической структурой. Он тверд и прочен, из него изготавливают трубы, пленки, химическое оборудование, детали машин, канаты, нити для ковровых покрытий, детские игрушки. Однако можно синтезировать полипропилен мягкий и гибкий; он идет на изготовление водостойких покрытий, кровельных материалов.
За выдающийся вклад в развитие химии полимерных материалов К. Циглер и Д. Натта в 1963 г. были удостоены Нобелевской премии по химии.
Поливинилхлорид и политетрафторэтилен. Галогенопроизводные алкенов образуют очень ценные полимеры – поливинилхлорид (ПВХ) и политетрафторэтилен (тефлон):
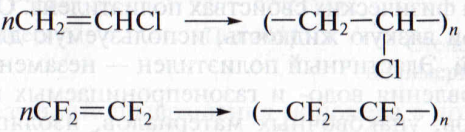
Эти линейные полимеры отличает исключительная химическая устойчивость. Поливинилхлорид используют для изготовления электроизоляционных материалов, трубок, пленок, искусственной кожи. Тефлон более устойчив, чем платина и золото; он устойчив в интервале температуры от –250 до +2600С, не горит, отличный диэлектрик, имеет очень низкий коэффициент трения, не хрупок. Из него изготавливают детали химических аппаратов, втулки, шайбы, детали машин.
Натуральный каучук. Каучуками называют продукты полимеризации диеновых углеводородов и их производных. Природный, или натуральный, каучук получают из млечного сока (латекса) каучуконосных растений, например гевеи. Химический анализ показал, что элементарным звеном этого линейного полимера является продукт 1,4-присоединения молекул изопрена; практически все звенья имеют цис-расположение заместителей при двойной связи:
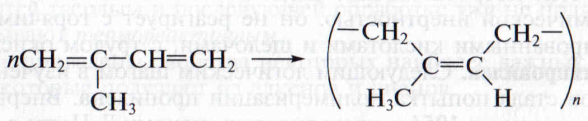
Каучуки относят к полимерам, называемым эластомерами. Такие материалы обладают эластичностью, т. е. способностью обратимо изменять форму под действием силы. Применение каучука связано также с другим его качеством – непроницаемостью для воды и газов. Однако этот полимер очень чувствителен к высоким и низким температурам: при охлаждении теряет свою эластичность и становится хрупким, при нагревании размягчается.
Этот недостаток устраняется с помощью процесса, называемого вулканизацией. Он заключается в нагревании каучука с серой, при этом отдельные полимерные цепи сшиваются между собой за счет образования дисульфидных мостиков:
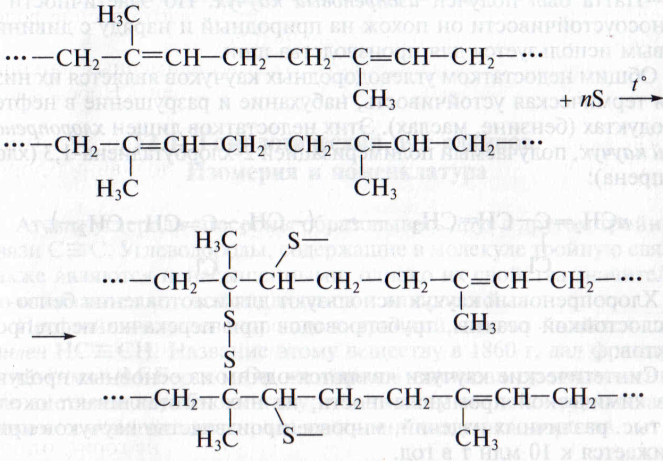
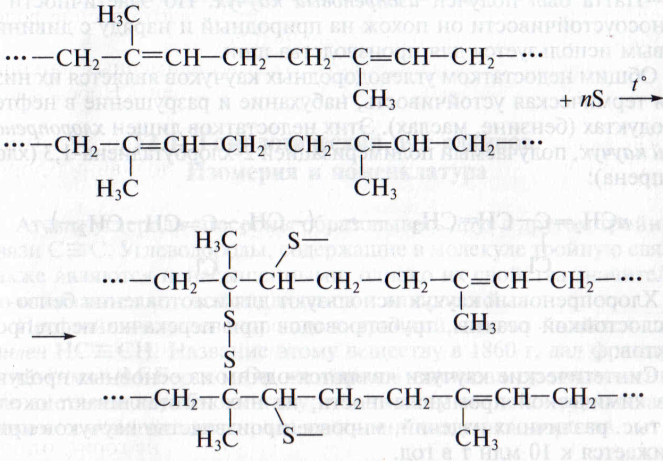
Продукт частичной вулканизации каучука называют резиной. Она имеет сетчатую структуру и менее эластична, чем каучук, но обладает значительно большей прочностью. При увеличении количества серы продукт вулканизации (эбонит) полностью теряет эластичность. Эбонит является хорошим диэлектриком, из него изготавливают детали электрической арматуры.
Синтетические каучуки. Потребности промышленности в каучуке значительно превосходят возможности природных источников. Первый синтетический каучук был получен в СССР под руководством академика С.В.Лебедева в 1932 г. Радикальной полимеризацией бутадиена -1,3 в присутствии металлического натрия осуществлен синтез каучука, получившего название бутадиенового:
nСН2=СН – СН=СН2 à (– СН2 – СН=СН – СН2 – )n
Бутадиеновый каучук обладает хорошей водо- и газоuепроницаемостью, однако менее эластичен, чем натуральный каучук. В его цепи цис- и транс-звенья распределены хаотично. Кроме того, полимеризация протекает не только как 1,4-, но и как 1,2-присоединение, при этом образуется полимер с разветвленной структурой.
В 1950-х гг. была разработана технология производства из бутадиена синтетического каучука, имеющего линейную структуру, и по износоустойчивости и эластичности превосходящего натуральный. Этот каучук назвали дивиниловый.
Попытки получить синтетический аналог натурального каучука увенчались успехом. С использованием катализаторов Циглера–Натта был получен изопреновый каучук. По эластичности и износоустойчивости он похож на природный и наряду с дивиниловым используется для производства шин.
Общим недостатком углеводородных каучуков является их низкая термическая устойчивость, набухание и разрушение в нефтепродуктах (бензине, маслах). Этих недостатков лишен хлоропреновый каучук, получаемый полимеризацией 2-хлорбутадиена-l,3 (хлоропрена):
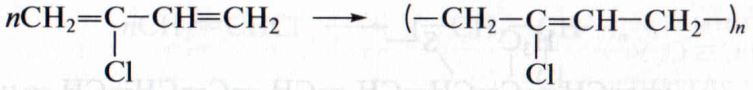
Хлоропреновый каучук используют для изготовления бензо- и маслостойкой резины, трубопроводов при перекачке нефтепродуктов.
Синтетические каучуки являются одним из основных продуктов химической промышленности; из них изготавливают около 50тыс. различных изделий; мировое производство каучуков приближается к 10 млн. т. в год.
Атомы углерода способны образовывать друг с другом тройные связи С≡С. Углеводороды, содержащие в молекуле тройную связь, также являются ненасыщенными, однако их свойства значительно отличаются от свойств алкенов и алкадиенов.
Простейшим углеводородом с тройной связью является ацетилен НС≡СН. Название этому веществу в 1860г. дал французский химик М. Бертло. Он же первым высказал предположение, что ацетилен подобно метану и ацетилену является родоначальником гомологического ряда ацетиленовых углеводородов.
Алкинами (ацетиленовыми) называют углеводороды с открытыми углеродными цепями, содержащие в молекуле одну тройную углерод-углеродную связь.
Электронное и пространственное строение молекулы ацетилена.
Атомы углерода, связанные тройной связью, находятся в состоянии sр-гибридизации. Гибридизации подвержены одна s- и одна р-орбиталь, при этом образуются две новые sр-гибридные орбитали (рис. 4.1), а две р-орбитали остаются без изменения.

В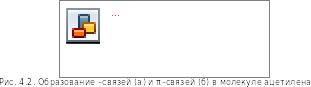 результате атом углерода в состоянии sр-гибридизации имеет четыре орбитали: две гибридные sр-орбитали и две негибридизованные р-орбитали. На каждой из них имеется по одному неспаренному электрону. В результате взаимного отталкивания неспаренных электронов орбитали располагаются в пространстве следующим образом: оси sр-орбиталей совпадают (т. е. угол между ними составляет 1800); оси р-орбиталей взаимно перпендикулярны и перпендикулярны оси sp-орбиталеЙ. s-связи в молекуле ацетилена образованы за счет взаимного перекрывания s-орбиталей атомов водорода и sр-орбиталей атомов углерода. Кроме того, атомы углерода образуют друг с другом еще две π-связи за счет бокового перекрывания р-орбиталей (рис. 4.2).
результате атом углерода в состоянии sр-гибридизации имеет четыре орбитали: две гибридные sр-орбитали и две негибридизованные р-орбитали. На каждой из них имеется по одному неспаренному электрону. В результате взаимного отталкивания неспаренных электронов орбитали располагаются в пространстве следующим образом: оси sр-орбиталей совпадают (т. е. угол между ними составляет 1800); оси р-орбиталей взаимно перпендикулярны и перпендикулярны оси sp-орбиталеЙ. s-связи в молекуле ацетилена образованы за счет взаимного перекрывания s-орбиталей атомов водорода и sр-орбиталей атомов углерода. Кроме того, атомы углерода образуют друг с другом еще две π-связи за счет бокового перекрывания р-орбиталей (рис. 4.2).
Таким образом, молекула ацетилена линейная, т. е. центры ядер всех четырех атомов лежат на одной прямой (рис. 4.3). Длина тройной связи меньше, чем двойной, и составляет всего 0,120нм.

Линейное строение молекул алкинов относительно тройной связи исключает возможность геометрической изомерии.
Гомологический ряд, изомерия и номенклатура алкинов. Ацетилен является первым представителем гомологического ряда алкинов, или ацетиленовых углеводородов. Общая формула углеводородов этого класса СnН2n-2, т. е. точно такая, как и у алкадиенов. Таким образом, ацетиленовые и диеновые углеводороды являются межклассовыми изомерами.
Для алкинов характерна изомерия углеродного скелета и положения тройной связи. Изомерия начинается с третьего члена гомологического ряда бутина С4Н6, для которого возможны два изомера: бутин-1 и бутин-2. Простейшим алкином с разветвленным углеродным скелетом является 3-метилбутин-l C5H8:
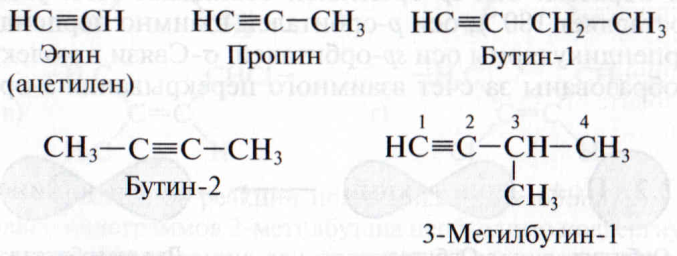
Международные названия алкинов строят аналогично названиям алкенов. Самая длинная цепь должна обязательно включать тройную связь и нумеруется с того конца, к которому она ближе. Основой служит название алкана с тем же числом углеродных атомов, что и в пронумерованной цепи, при этом суффикс «-ан -» изменяют на «-ин -». для этина более широко распространено тривиальное (исторически сложившееся) название ацетилен, пропин часто называют метилацетиленом.
Физические свойства алкинов. При обычных условиях алкины от С2Н2 до С4Н6 являются газами, от C5H8 до С16Н30 – жидкостями, начиная с С17НЗ2 – твердыми веществами. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов. Чистый ацетилен практически лишен запаха. Ацетилен и его газообразные гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Получение и химические свойства алкинов
Ацетилен является одним из важнейших продуктов химической промышленности, поскольку на его основе получают практически важные соединения: кислородсодержащие вещества различных классов, растворители, мономеры для производства пластмасс и каучуков.
Промышленные и лабораторные способы получения ацетилена.
1. Основным промышленным способом получения ацетилена является пиролиз метана:

При температуре 15000С ацетилен является промежуточным продуктом разложения метана до углерода и водорода, поэтому основной технологический прием заключается в быстром выводе ацетилена из сферы реакции и его охлаждении (рис. 4.4).
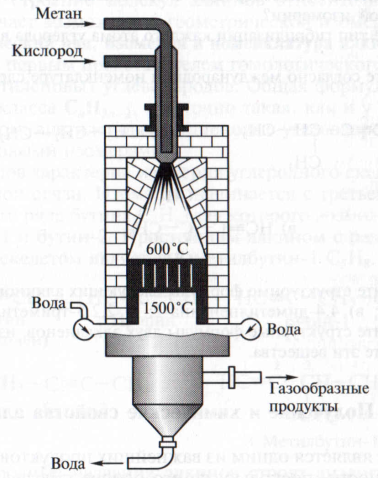
Рис. 3.4. Получение ацетилена окислительным пиролизом метана
2. Получение ацетилена путем разложения карбида кальция широко используют как в промышленности, так и в технике и лабораторной практике. При взаимодействии карбида кальция с водой происходит бурное выделение газа:
СаС2 + 2Н2О à НС≡ CH + Са(ОН)2
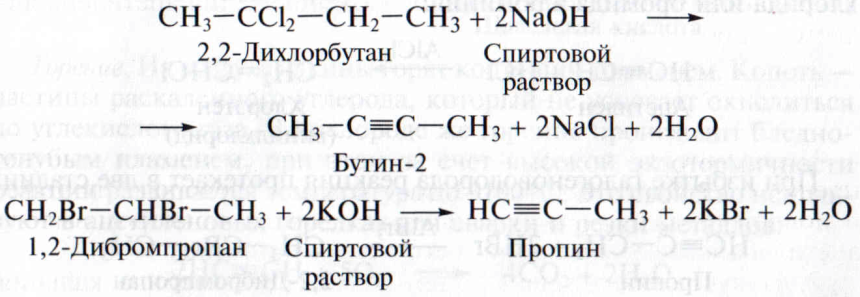
3. Ацетилен и его гомологи в лаборатории можно получить дегидрогалогенированием дигалогеналканов. Тройная связь образуется путем отщепления двух молекул галогеноводорода от дигалогеналканов под действием спиртового раствора щелочи. В качестве исходных веществ берут дихлор- или дибромалканы, содержащие атомы галогена у одного или у соседних атомов углерода:
Химические свойства ацетиленовых углеводородов. Особенности химических свойств алкинов связаны, прежде всего, с наличием в молекуле тройной связи. Для представителей этого гомологического ряда характерны реакции присоединения, реакции замещения атома водорода при sр-гибридном атоме углерода, реакции окисления.
Реакции присоединенuя. Типичной реакцией для ацетилена и его гомологов является присоединение по кратной связи. Так же как для диеновых углеводородов, реакции присоединения алкинов протекают в две стадии, т. е. ступенчато. На первой стадии тройная связь превращается в двойную, на второй - происходит присоединение по двойной связи.
1. Г а л о г е н и р о в а н и е. Присоединение к ацетиленовым углеводородам хлора или брома позволяет получить на первой стадии галогенпроизводное с двойной связью, на второй стадии – продукт предельного характера. Например, при взаимодействии ацетилена с бромом образующийся на первой стадии 1,2-дибромэтен при избытке галогена превращается в 1,1,2,2-тетрабромэтан:
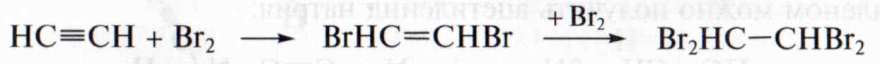
Таким образом, алкины, так же как и алкены, обесцвечивают бромную воду.
2. Г и д р и р о в а н и е. При повышенной температуре в присутствии катализаторов алкины присоединяют водород. Реакция также проходит в две стадии:
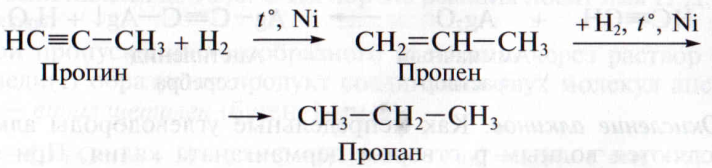
3. Г и д р о г а л о г е н и р о в а н и е. В отличие от гидрогалогенирования этиленовых углеводородов галогеноводороды присоединяются по тройной связи алкина в присутствии катализатора – хлорида или бромида алюминия:
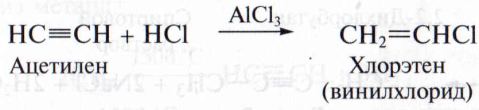
При избытке галогеноводорода реакция протекает в две стадии:
4. Г и д р а т а ц и я. Важное значение для получения кислородсодержащих соединений имеет реакция присоединения воды. Она протекает в кислой среде в присутствии солей ртути(II):
Соли ртути в качестве катализатора процесса гидратации алкинов были впервые использованы выдающимся русским химиком М.Г.Кучеровым в 1881г., с тех пор эта реакция носит название реакции Кучерова.
Кислотные свойства алкинов. Атом водорода ацетилена и его гомологов, содержащих тройную связь на конце молекулы, довольно подвижен. Он может замещаться на металл, что обусловливает кислотные свойства алкинов. Продукты замещения можно отнести к классу солей; их называют ацетиленидами.
При взаимодействии металлического натрия со сжиженным ацетиленом можно получить ацетилен ид натрия:
Ацетиленид серебра может быть легко получен при пропускании ацетилена через аммиачный раствор оксида серебра:
Окисление алкинов. Как непредельные углеводороды алкины окисляются водным раствором перманганата калия. При этом происходит исчезновение характерной окраски раствора перманганата:
Горение. На воздухе алкины горят коптящим пламенем. Копоть – частицы раскаленного углерода, который не успевает окислиться до углекислого газа. В кислороде же горение происходит бледно – голубым пламенем, при этом за счет высокой экзотермичности реакции развивается температура до 31000C. Это свойство используют в ацетиленовых горелках для сварки и резки металлов:
Полимеризация алкинов. Многие свойства ацетиленовых углеводородов напоминают свойства олефинов, однако последние более активны. Та же тенденция наблюдается и в реакциях полимеризации. Очень длинные цепи молекулы ацетилена образуют с трудом, а вот несколько молекул ацетилена соединяются друг с другом относительно легко.
При нагревании ацетилена до 6000C ему удалось получить небольшое количество вещества молекулярной формулы С6Н6 – бензола. Судя по составу, продукт представляет собой соединение трех молекул ацетилена
Спустя 60 лет русский химик Н.Д. Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). Даже при более низкой температуре в присутствии катализатора скорость реакции значительно возрастала; выход бензола увеличивался до 90%. С тех пор эта реакция носит имя Н. Д. Зелинского.
При пропускании газообразного ацетилена через раствор солей меди(I) образуется продукт соединения двух молекул ацетилена - винилацетилен (бутен-1-ин-3):
Получение винилацетилена совершило революцию в промышленности синтетического каучука. В 1932г. была разработана технология получения 2-хлорбутадиена-1,3 (хлоропрена), а два года спустя на его основе – хлоропренового каучука:
Хлоропреновый каучук обладает высокой термической устойчивостью, не набухает в нефтепродуктах, поэтому его широко используют для изготовления бензостойкой и маслостойкой резины, трубопроводов для перекачки нефтепродуктов.
Применение алкинов. Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ в производстве синтетических каучуков, поливинилхлорида, других полимеров. Из ацетилена получают уксусный альдегид и уксусную кислоту, органические растворители. Ацетилен используют в технике для сварки и резки металлов.
Контрольные вопросы:
Какие углеводороды называют алкадиенами? Приведите классификацию диенов в зависимости от взаимного расположения двойных связей в молекуле.
В чем особенность реакций присоединения с участием диеновых углеводородов?
Дайте определения понятиям: полимер, мономер, полимеризация, элементарное звено, степень полимеризации, стереорегулярность, термореактивность, термопластичность.
Средняя относительная молекулярная масса образца полипропилена равна 420000. Определите среднюю степень полимеризации этого вещества.
Какой процесс называют вулканизацией каучука? Какие продукты при этом получаются?
Какие углеводороды называют алкинами? Какова их общая формула? На примере ацетиленовых углеводородов дайте определение понятия «межклассовая изомерия».
Опишите электронное и пространственное строение молекулы ацетилена. За счет перекрывания каких орбиталей образованы связи между атомами углерода? Сравните длину тройной связи с длиной двойной и одинарной связей.
Сравните типы изомерии, характерные для предельных, этиленовых и ацетиленовых углеводородов. С чем связано отсутствие у алкинов геометрической изомерии?
Перечислите реакции присоединения, в которые вступают ацетиленовые углеводороды. В чем отличие реакций присоединения алкинов и алкенов?
Используемая литература:
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с









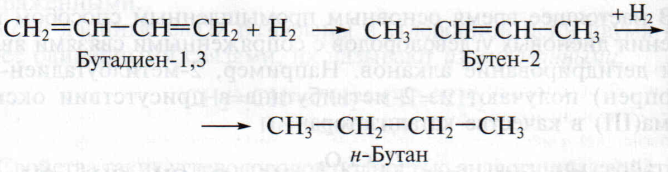
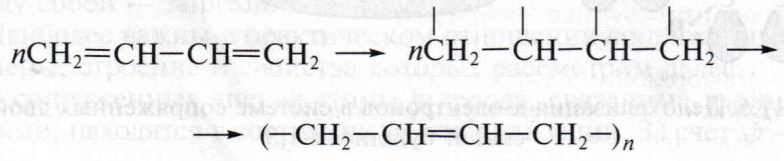




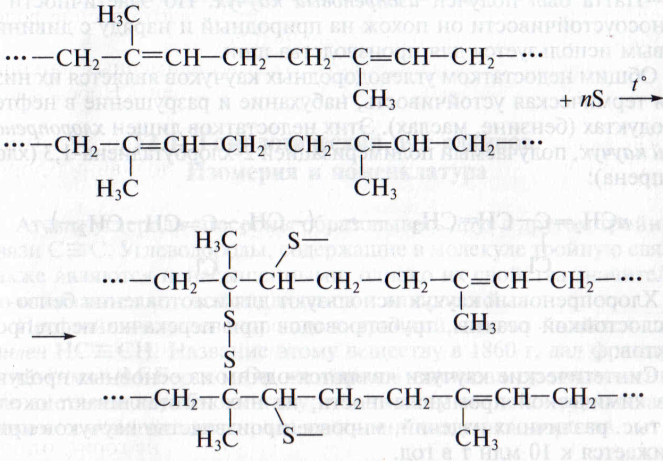

 результате атом углерода в состоянии sр-гибридизации имеет четыре орбитали: две гибридные sр-орбитали и две негибридизованные р-орбитали. На каждой из них имеется по одному неспаренному электрону. В результате взаимного отталкивания неспаренных электронов орбитали располагаются в пространстве следующим образом: оси sр-орбиталей совпадают (т. е. угол между ними составляет 1800); оси р-орбиталей взаимно перпендикулярны и перпендикулярны оси sp-орбиталеЙ. s-связи в молекуле ацетилена образованы за счет взаимного перекрывания s-орбиталей атомов водорода и sр-орбиталей атомов углерода. Кроме того, атомы углерода образуют друг с другом еще две π-связи за счет бокового перекрывания р-орбиталей (рис. 4.2).
результате атом углерода в состоянии sр-гибридизации имеет четыре орбитали: две гибридные sр-орбитали и две негибридизованные р-орбитали. На каждой из них имеется по одному неспаренному электрону. В результате взаимного отталкивания неспаренных электронов орбитали располагаются в пространстве следующим образом: оси sр-орбиталей совпадают (т. е. угол между ними составляет 1800); оси р-орбиталей взаимно перпендикулярны и перпендикулярны оси sp-орбиталеЙ. s-связи в молекуле ацетилена образованы за счет взаимного перекрывания s-орбиталей атомов водорода и sр-орбиталей атомов углерода. Кроме того, атомы углерода образуют друг с другом еще две π-связи за счет бокового перекрывания р-орбиталей (рис. 4.2).