Министерство образования Новосибирской области
Искитимский филиал ГБПОУ НСО «Новосибирский строительно – монтажный колледж»
|
| Рассмотрено: |
| «Утверждаю» |
|
| На заседании ПЦК |
| Зав. Учебной частью |
|
| Технологических дисциплин |
| Пицына Т.М. __________ |
|
| Протокол № ___ от «__»_____2020г. |
| «___»____________2020г. |
|
| ППЦК Горбачева М.М. ___________ |
|
|
|
|
|
|
МАТЕРИАЛЫ ДЛЯ ПРОВЕДЕНИЯ
ПРАКТИЧЕСКИХ РАБОТ ПО ДИСЦИПЛИНЕ
Теоретические основы химической технологии»
Специальности 18.02.05 Производство тугоплавких неметаллических и силикатных материалов и изделий
Составитель Голенок Елена Владимировна
2020г.
ПЕРЕЧЕНЬ ПРЕДСТАВЛЕННЫХ ПРАКТИЧЕСКИХ РАБОТ
ПО ДИСЦИПЛИНЕ «Теоретические основы химической технологии»
| 1. Расчет расходных коэффициентов 2. Расчет технико-экономических показателей химико-технологических процессов 3. Составление и расчет материальных балансов химико-технологических процессов 4. Равновесие ХТП 5. Расчет поверхности теплообменных аппаратов 6. Составление технологических схем производства серной кислоты 7. Составление технологических схем производства азотной кислоты 8. Составление технологических схем производства соляной кислоты 9. Составление технологических схем производства изделий стеновой керамики 10. Составление технологических схем производства керамических плиток 11. Составление технологических схем производства гипсовых вяжущих веществ 12. Составление технологических схем производства известковых вяжущих веществ 13. Составление технологических схем производства цемента 14. Составление технологических схем производства листового стекла
|
Пояснительная записка
Методические указания к практическим работам составлены в соответствии с рабочей программой дисциплины Теоретические основы химической технологии специальности СПО 18.02.05 Производство тугоплавких неметаллических и силикатных материалов и изделий.
Цель методических указаний: оказание помощи студентам по выполнению практических работ по дисциплине Теоретические основы химической технологии, направленных на формирование следующих профессиональных компетенций (ПК):
- Соблюдать условия хранения сырья;
- Подготавливать, дозировать и загружать сырьё согласно рецептуре технологического процесса;
- Осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий;
- Выполнять технологические расчёты, связанные с приготовлением шихты;
- Проверять исправность оборудования, технологических линий и средств автоматизации;
- Контролировать работу основного и вспомогательного оборудования;
- Осуществлять контроль параметров технологического процесса и их регулирование.
- Осуществлять контроль качества полупродуктов и готовой продукции.
- Рассчитывать технико-экономические показатели технологического процесса для выявления резервов экономии.
- Организовывать работу коллектива и поддерживать профессиональные отношения со смежными подразделениями.
- Обеспечивать выполнение производственного задания по объёму производства и качеству продукции.
- Повышать производительность труда, снижать трудоёмкость продукции на основе оптимального использования трудовых ресурсов и технических возможностей оборудования.
Требования к результатам освоения дисциплины:
- Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
- Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
- Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
- Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
- Использовать информационно-коммуникационные технологии в профессиональной деятельности.
- Работать в коллективе и в команде, эффективно общаться с коллегами, руководством.
- Брать ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
- Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
- Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
В результате освоения дисциплины обучающийся должен
уметь:
- выполнять материальные и энергетические расчёты технологических показателей химических производств;
- определять оптимальные условия проведения химико – технологических процессов;
- составлять и делать описание технологических схем химических процессов;
- обосновывать целесообразность выбранной технологической схемы и конструкции оборудования;
знать:
- теоретические основы физических, физико – химических и химических процессов;
- основные положения теории химического строения веществ;
- основные понятия и законы физической химии и химической термодинамики;
- основные типы, конструктивные особенности и принцип работы технологического оборудования производств;
- основы теплотехники, теплопередачи, выпаривания;
- технологические системы основных химических производств и их аппаратурное оформление.
Форма оформления практической работы
Работа оформляется на двойном листе, на первой странице указывается:
- название учебного заведения;
- номер практической работы;
- название практической работы;
- номер группы;
- Ф.И.О. студента;
- вариант.
Критерии оценки практической работы:
«Отлично» 1. Ответы даны на все вопросы, последовательно и грамотно
«Хорошо» 1. Ответы даны не достаточно подробно, содержат несущественные ошибки.
«Удовлетворительно» 1. Ответы обнаруживают знания и понимание материала.
Рекомендуемая литература:
1. Москвичев Ю.А., Павлов О.С., Григоричев А.К. «Теоретические основы химической технологии» Метрология, стандартизация и сертификация: учебное пособие–М.: «Академия», 2016 –272 с.
2. Дытнерский Ю.И. Процессы и аппараты химической технологии. Изд. 2-е. В 2 книгах: [Часть 1] Теоретические основы процессов химической технологии. Гидромеханические и тепловые процессы и аппараты.- М.: Химия, 2015– 400с.
3. Сулименко Л.М. Общая технология силикатов / Л.М. Сулименко. – М.: ИНФРА – М, 2016 – 336 с.
4. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
Практическая работа № 1
Расчёт расходных коэффициентов
Цель работы: освоить методику расчета теоретических и практических расходных коэффициентов
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Расходные коэффициенты - величины, характеризующие расход различных видов сырья, воды, топлива, электроэнергии, пара на единицу вырабатываемой продукции. На практике обычно, чем меньше расходные коэффициенты, тем экономичнее процесс и соответственно тем меньше себестоимость продукции. Однако снижение расходных коэффициентов ниже определенного минимума связано с необходимостью повышения чистоты исходных материалов, степеней извлечения, выхода продукта, что требует значительных расходов и может повести к увеличению себестоимости продукта.
Для расчета расходных коэффициентов необходимо знать все стадии производства, в результате осуществления которых происходит превращение исходного сырья в готовый продукт. Теоретические расходные коэффициенты учитывают стехиометрические соотношения, по которым происходит это превращение. Практические расходные коэффициенты, кроме этого, учитывают производственные потери на всех стадиях процесса, а также возможные побочные реакции.
Расходные коэффициенты для одного и того же продукта зависят от состава исходных материалов и могут значительно отличаться друг от друга. Поэтому в тех случаях, когда производство и сырье отдалены друг от друга, необходима предварительная оценка по расходным коэффициентам при выборе того или иного типа сырья с целью определения экономической целесообразности его использования.
Теоретические расходные коэффициенты АТ учитывают стехиометрические соотношения, по которым происходит превращение исходных веществ в целевой продукт.
Практические расходные коэффициенты АПР кроме этого учитывают производственные потери на всех стадиях процесса, а также побочные реакции, если они имеются.
Коэффициенты рассчитывают по следующей формуле:
АТ (либо АПР) = mС / mПР,
где mС – количество сырья, кг, необходимого для получения продукции массой mПР, кг.
Задача 1. Определить теоретические расходные коэффициенты железных руд шпатовый железняк FeCO3, лимонит 2Fe2О3∙3Н2О, гетит 2Fe2О3∙2Н2О, красный железняк Fe2О3,магнитный железняк Fe3О4),применяемых при производстве 1000 кг чугуна, который содержит 92 % железа, при условии, что руды не содержат пустой породы и примесей.
Решение.
Молекулярные массы веществ:
Шпатовый железняк FeCO3 (М FeCO3 = 115,8 г/моль);
Лимонит 2Fe2О3∙3Н2О (М2Fe2О3∙3Н2О = 373 г/моль);
Гетит 2Fe2О3∙2Н2О (М2Fe2О3∙2Н2О = 355 г/моль);
Красный железняк Fe2О3 (М Fe2О3 = 159,7 г/моль);
Магнитный железняк Fe3О4 (М Fe3О4 = 231,5 г/моль).
Расчет расходного коэффициента по FeCO3.
Из 1 кмоль FeCO3 можно получить 1 кмоль Fe или можно записать:
115,8 кг FeCO3 → 55,9 кг Fe (где 55,9 – молекулярная масса железа). Отсюда для получения 1000 кг чугуна с содержанием железа 92 % необходимо:
АТ = (1000 ∙ 0,92 ∙ 115,8) / 55,9 = 1905 кг шпатового железняка.
Аналогично находим значения теоретических расходных коэффициентов для других руд:
Для лимонита:
АТ = (1000 ∙ 0,92 ∙ 373) / 4 ∙ 55,9 = 1535 кг.
Для гетита:
АТ = (1000 ∙ 0,92 ∙ 355) / 4 ∙ 55,9 = 1461 кг.
Для красного железняка:
АТ = (1000 ∙ 0,92 ∙ 159,7) / 2 ∙ 55,9 = 1314 кг.
Для магнитного железняка:
АТ = (1000 ∙ 0,92 ∙ 231,5) / 3 ∙ 55,9 = 1270 кг.
Задания для выполнения практической работы № 1(по вариантам).
Задание 1. Решить задачу, используя данные таблицы 1.
Таблица 1.
| Вариант | Содержание железа, Х% |
| 1 | 90 |
| 2 | 91 |
| 3 | 93 |
| 4 | 94 |
| 5 | 95 |
| 6 | 80 |
| 7 | 81 |
| 8 | 82 |
| 9 | 83 |
| 10 | 84 |
| 11 | 85 |
| 12 | 86 |
| 13 | 87 |
| 14 | 88 |
| 15 | 89 |
| 16 | 79 |
| 17 | 72 |
| 18 | 73 |
| 19 | 74 |
| 20 | 75 |
| 21 | 76 |
| 22 | 78 |
| 23 | 79 |
| 24 | 69 |
| 25 | 68 |
Задача 2. Рассчитать практический расходный коэффициент алунитовой руды, содержащей 23 % Al2O3, для получения 1000 кг алюминия, если потери алюминия на всех технологических стадиях составляет 12 % по массе. Алунит имеет формулу: 3Al2O3∙K2O∙4SO3∙6H2O (М = 828 г/моль).
Схематично производство алюминия можно отобразить следующим образом:
3Al2O3∙K2O∙4SO3∙6H2O → Al2O3 → Аl.
Решение.
Для получения 1000 кг алюминия теоретически потребуется следующее количество Al2O3:
АТ = (102 ∙ 1000) / (2 ∙ 27) = 1888,9 кг
или чистого алунита:
АТ = 1888,9 ∙ 828 / (3 ∙ 102) = 5111,1 кг.
Содержание Al2O3 в алуните составляет:
ω = (3 ∙ 102 ∙ 100 %) / 828 = 37 %.
По условию в алунитовой руде содержится 23 % Al2O3. Следовательно, расход алунитовой руды заданного состава на1000 кг алюминия при условии полного ее использования составит:
АТ = 5111,1 кг ∙ 37 % / 23 % = 8222,2 кг.
Практический расход, учитывающий производственные потери алюминия на всех стадиях составит:
Апр = 8222,2:0,88 = 9343,4 кг
Ответ: для получения 1000 кг алюминия необходимо 9343,4 кг алунита.
Задание 2. Решить задачу, используя данные таблицы №2.
Таблица 2.
| Вариант | Содержание Al2O3, % | Потери алюминия , % |
| 1 | 50 | 13 |
| 2 | 47 | 14 |
| 3 | 46 | 15 |
| 4 | 45 | 16 |
| 5 | 44 | 17 |
| 6 | 43 | 18 |
| 7 | 2 | 19 |
| 8 | 41 | 20 |
| 9 | 40 | 21 |
| 10 | 39 | 22 |
| 11 | 38 | 23 |
| 12 | 37 | 24 |
| 13 | 36 | 25 |
| 14 | 35 | 26 |
| 15 | 34 | 27 |
| 16 | 33 | 28 |
| 17 | 32 | 29 |
| 18 | 31 | 30 |
| 19 | 30 | 32 |
| 20 | 29 | 33 |
| 21 | 28 | 34 |
| 22 | 27 | 35 |
| 23 | 26 | 36 |
| 24 | 25 | 37 |
| 25 | 24 | 38 |
Практическая работа № 2
Расчет технико – экономических показателей химико-технологических процессов
Цель работы: освоить методику расчета технико – экономических показателей ХТП.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Эффективность любого химического производства оценивается рядом технологических, экономических, эксплуатационных и социальных показателей.
Технологические показатели. В качестве технологических показателей, которые отражают физико-химическую сущность явлений, происходящих при том или ином химико-технологическом процессе, принято использовать, прежде всего, следующие:
- расходные коэффициенты;
- степень превращения исходных реагентов;
- селективность;
- выход продукта;
- производительность (мощность);
- интенсивность процесса;
- удельные капитальные затраты;
− качество продукта.
Расход каждого вида сырья, отнесенный к единице целевого продукта, называют расходным коэффициентом (А) и выражают в тоннах (т),килограммах (кг), метрах кубических (м3).
Теоретические расходные коэффициенты (Атеор) рассчитывают на основании стехиометрических соотношений, по которым происходит превращение сырья в целевой продукт.
Атеор = m1/m2,
где Атеор – теоретический расходный коэффициент (в т, кг, м3);
m1 –расход сырья, реагента;
m2 – масса целевого продукта.
Практические расходные коэффициенты (Апракт) учитывают также побочные реакции и производственные потери.
Выход продукта η – это отношение массы полученного целевого продукта к его массе, которая должна быть получена по стехиометрическому уравнению, выраженное в процентах:
η = mпракт/mтеорет
где mпракт – масса или объем целевого продукта, полученного практически;
mтеорет – масса или объем целевого продукта, полученного теоретически.
Производительность аппарата (процесса) (П) – это масса выработанного
продукта или переработанного сырья в единицу времени:
П = m/τ,
где П – производительность (в кг/ч, т/сут, м3/сут);
m – масса продукта (в т, кг, м3);
τ – время (в ч, сутки).
Максимально возможная производительность аппарата (при оптимальных условиях) называется мощностью (N):
N = Попт,
где N – мощность аппарата (в кг/ч, т/сут).
Интенсивность аппарата (процесса) (I) – это производительность,
отнесенная к единице полезного объема или к единице полезной площади.
I = П/Vn = m/ Vnτ
I' = П/Sn = m/ Snτ,
где I – интенсивность (в кг/м3·ч, кг/м2·ч); Vn – полезный объем аппарата;
Sn – полезная площадь аппарата.
Экономическая эффективность является самым важным показателем,
отражающим совершенство химико-технологического процесса, и
характеризуется: капитальными затратами, себестоимостью продукции и
производительностью труда.
Удельные капитальные затраты (Ку) – отношение общей стоимости
установки (цеха) к ее годовой мощности:
Ку = К/N,
где Ку – удельные капитальные затраты (руб·г/т);
К – капитальные затраты (в руб);
N – мощность установки (в т/г).
Зависимость удельных капитальных затрат от единичной мощности
установки, т.е. от одного производственного агрегата, выражается уравнением:
Ку = а · N-0.4
где Ку – удельные капитальные затраты (в руб·г/т); а – коэффициент,
зависящий от характера химического производства, его находят для каждого
продукта с использованием практических данных; N – мощность агрегата (в
т/г).
Себестоимость (С) – денежное выражение затрат данного предприятия на
изготовление и сбыт единицы продукции. Зависимость между себестоимостью
и единичной мощностью производственного агрегата выражается уравнением:
С = m · Nn
где С – себестоимость продукта (в руб/т);
N – мощность цеха или установки (в т/г);
m, n – коэффициенты (n = 0.2 или 0.3).
Пример 1.
Определите производительность в сутки роторного резиносмесителя закрытого типа, если из его камеры каждые 10 мин выгружают 250 кг резиновой смеси.
Решение.
Производительность резиносмесителя:
П =260 · 60 · 24/10 = 36000 кг/сут.
Пример 2.
Определите снижение капитальных затрат при увеличении единичной мощности установки в два раза, т.е. при изменении мощности от N1 до N2 (2N1).
Решение.
Подставим в уравнение данные задачи и определим отношение:
К2/К1 = а N2-0.4/а N1 –0.4 = (2N1)-0.4/N1-0.4 = (1/2) 0.4 = 0.76
или К2 = 0.76К1, т.е. при увеличении мощности установки вдвое капитальные затраты снижаются на 24%.
Практическая работа № 3
Составление и расчет материальных балансов химико-технологических процессов
Цель работы: освоить методику составления и расчета материального баланса сжигания углерода.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов, поступающих на переработку, а правую - масса получаемых продуктов плюс производственные потери.
Материальный баланс составляют по уравнению основной суммарной реакции с учетом побочных реакций согласно закону сохранения массы вещества. Общая масса всех поступающих в аппарат (или в цех) материалов, т. е. приход, равен общей массе выходящих материалов, т. е. расходу.
Пример. Составить материальный баланс печи для сжигания серы производительностью 60 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха =1,5. Расчет вести на производительность печи по сжигаемой сере в кг/ч.
Решение. Процесс горения серы описывается уравнением: S + О2 = SO2.
Приход:
1. Производительность печи G = 60000/24 = 2500 кг/ч
2. Масса серы:
- окисленной до SО2
G(S) = G ∙Х, кг/ч
где G(S) масса окисленной серы ,кг/ч;
G производительность печи, кг/ч;
Х - степень окисления серы.
G(S) = G ∙0,95 = 2500∙0,95 = 2375 кг
- неокисленной
G (S)неок = G - G (S) = 2500 - 2375 = 125 кг
3. Определяем теоретический (по химическому уравнению) расход кислорода, израсходованный на горение:
32кг32кг 44кг
S + О2 = SO2.
2375кг ? ?
G(O2)т = G (S) ∙M(O2)/М(S), кг
где G (S) - масса серы, окисленной до SО2, кг;
M(O2) – молярная масса кислорода, кг/кмоль;
M(S) – молярная масса серы, кг/кмоль.
G(O2)т = 2375∙32/32 = 2375кг
или по объему
V(O2)т = G (O2) ∙V/M(O2), м3
где V(O2) – объем кислорода, израсходованный на окисление серы, м3;
G (O2) –масса кислорода, израсходованного на окисление серы кг;
V - молярный объём кислорода, м3/кмоль; V = 22,4 м3/кмоль;
M(O2) – молярная масса кислорода, кг/кмоль.
V(O2)т = 2375∙22,4/32 = 1663 м3
4. . Определяем действительный (с учетом коэффициента избытка воздуха) расход кислорода, израсходованный на горение:
V(O2)д = V(O2)т∙ , м3
где V (O2) - объем кислорода, израсходованный на окисление серы, с учетом коэффициента избытка воздуха, м3;
V(O2) - объем кислорода, израсходованный на окисление серы, м3;
- коэффициента избытка воздуха
V(O2)д = 1663∙1,5 =2495 м3
или по массе
G(O2)д = V(O2)д∙ М(O2)/V, кг
где G(O2)д – масса кислорода, израсходованный на окисление серы, с учетом коэффициента избытка воздуха, кг;
G(O2)д = 2495∙32/22,4 = 3560 кг
4.Воздух состоит из 79% азота и 21% кислорода (по объему).
Определяем объем азота, поступающий в печь с воздухом:
:
V (N2) = V(O2)д∙% (N2)/ % (O2), м3
где V (N2) – объем кислорода, поступивший с воздухом в печь, м3;
V(O2)т - теоретический объем кислорода, израсходованный на окисление серы, м3;
% (N2) – содержание азота в воздухе, %;
% (O2), содержание кислорода в воздухе, %;
V (N2) = 2495∙79/21 = 9380 м3
или по массе
G(N2) = V (N2)∙М(N2)∙/V, кг
G(N2) = 9380∙28/22,4= 11700 кг
Расход.
1. Образовалось SО2 по реакции:
G(SО2) = G(S) ∙М(SО2)/М(S), кг
где G(S) - масса окисленной серы до SО2,кг;
М(SО2) – молярная масса SО2, кг/кмоль;
М(S) – молярная масса окисленной серы, кг/кмоль.
G(SО2) = 2375∙ 64/32 = 4750 кг
или по объему V(SО2) = G(SО2) ∙ V / М(SО2), м3
V(SО2) = 4750∙22,4/64= 1663 м3
2. Осталось неизрасходованного кислорода:
V(О2)изб = V(O2) ∙ ( - 1), м3
V(О2)изб = 1663∙0,5 = 832 м3
или по массе
G (О2)изб = V(О2)изб ∙М(O2)/ V, кг
G (О2)изб = 832∙32/22,4= 1185 кг
3. Составляем материальный баланс ХТП
Таблица 1. Материальный баланс печи для сжигания серы
| Материал | Приход | Материал | Расход |
| кг | мЗ | кг | м3 |
| S | 2500 |
| S | 125 |
|
| С воздухом: О2 N2 |
3560 11700 |
2495 9380 | S02 | 4750 | 1663 |
| 02 | 1185 | 831 |
|
|
|
| N2 | 11700 | 9380 |
| Итого | 17760 | 11875 | Итого | 17760 | 11875 |
|
|
|
|
|
|
|
Задание для выполнения практической работы №3. Составить материальный баланс печи для сжигания углерода производительностью 14,0 кг/с. Степень окисления углерода 0,92. Коэффициент избытка воздуха = 1,05. Расчет вести на производительность печи по сжигаемому углероду в кг/ч.
Процесс горения углерода описывается уравнением С + О2 = СO2.
Практическая работа № 4
Равновесие ХТП.
Цель работы. Научиться рассчитывать константу равновесия химической реакции.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
В соответствии с законом действующих масс для реакции аА(г) + вВ(г) = сС(г)+ dD(г)
состояние равновесной химической системы характеризуется константой равновесия:
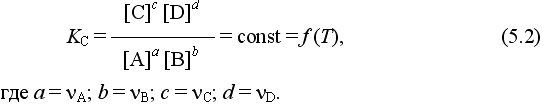
Это выражение позволяет рассчитать KС по известным равновесным концентрациям всех веществ гомогенной газофазной реакции, а также для гомогенной реакции в растворе
или концентрацию одного из веществ по известным равновесным концентрациям остальных веществ и KС.
Пример 1. При некоторой температуре в системе
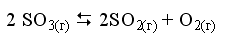
равновесные концентрации веществ равны соответственно 0,04, 0,12 и 0,06 моль/л. Рассчитать KС реакции.
Решение
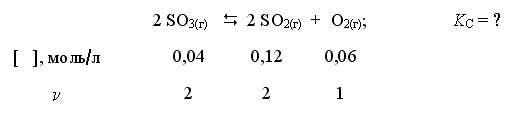
ni , моль 2 2 1
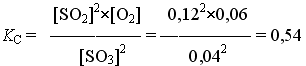
Ответ. Для данной реакции KС = 0,54.
Если по условию задачи известна равновесная концентрация только одного продукта из нескольких, то перед расчетом KС необходимо вычислить незаданные равновесные концентрации продуктов по выражению
C/ c = D/d
Пример 2. При некоторой температуре в системе
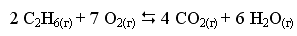
равновесные концентрации С2Н6, О2 и СО2 составили соответственно 0,22, 1,34 и 0,57 моль/л. Рассчитать KС реакции.
Решение
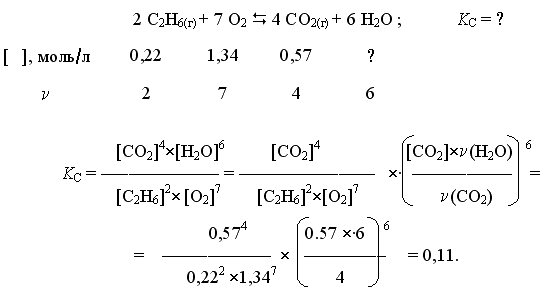
Ответ. Для данной реакции KС = 0,11.
Для гетерогенных реакций, в которых при данной температуре среди реагентов и продуктов присутствуют (помимо газов) отдельные фазы твердых и жидких веществ, равновесные концентрации твердых и жидких веществ в выражение для константы равновесия не входят ввиду их постоянства во всей области существования данных агрегатных состояний этих веществ.
Для некоторой гетерогенной обратимой реакции
аА(г) + вВ(ж) = сС(к)+ dD(г)
выражение для константы равновесия имеет вид
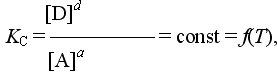
При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций газообразных реагентов и увеличение концентраций газообразных продуктов, определяемые по закону сохранения выражениями:
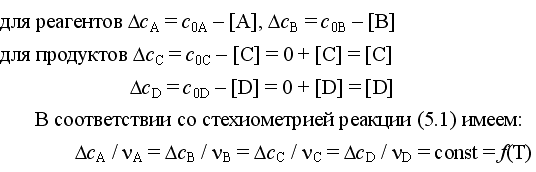
Эти выражения позволяют рассчитать равновесные концентрации веществ по начальным концентрациям реагентов при известном значении KС (и наоборот).
Вычисление константы равновесия реакции (Алгоритм).
Задача. Вычислите константу равновесия для реакции
СО2 + Н2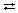 СО + Н2О,
СО + Н2О,
если равновесная концентрация углекислого газа равна 0,02 моль/л, водорода – 0,005 моль/л, а угарного газа и воды – по 0,01 моль/л.

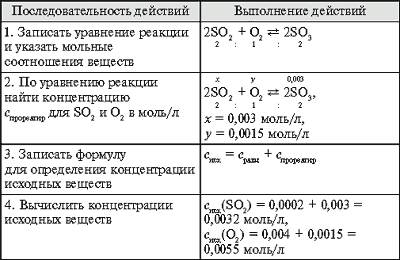
Вычисление исходных концентраций веществ (Алгоритм ).
Задача. Обратимая реакция выражается уравнением 2SO2 + O2 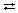 2SO3.
2SO3.
Известны равновесные концентрации: для оксида серы(IV) – 0,0002 моль/л, для кислорода – 0,004 моль/л, для оксида серы(VI) – 0,003 моль/л. Найдите исходные концентрации кислорода и сернистого газа.
Задание к практической работе № 4 (по вариантам).
Задание 1.
В гомогенных системах при р, V, T = const установилось состояние равновесия. На основании закона действующих масс составьте выражение для константы равновесия
| Вариант | Уравнение реакции |
| 1 | 4 NH3 + 5 O2D 4 NO + 6 H2O |
| 2 | 2 C2H6 + 7 O2D 4 CO2 + 6 H2O |
| 3 | 6 HF + N2D 2 NF3 + 3 H2 |
| 4 | 2 NH3 + 3 Cl2D N2 + 6 HCl |
| 5 | 2 CH4 + 3 O2 + 2 NH3D 2 HCN + 6 H2O |
| 6 | 2 H2S+ 3 O2D 2 SO2 + 2 H2O |
| 7 | СН4 + СО2 = 2СО + 2Н2 |
| 8 | TiO2(т) + 2C(т) + 2Cl2(г) D TiCl4(г) + 2CO(г) |
| 9 | Mg3N2(т) + 6H2O(г) D 3Mg(OH)2(т) + 2NH3(г) |
| 10 | Si(т) + 2H2O(г) D SiO2(т) + 2H2(г) |
| 11 | CS2(г) + 2Cl2(г) D CCl4(г) + 2S(т) |
| 12 | 2NO2(г) + 2S(т) D N2(г) + 2SO2(г) |
| 13 | 10NO(г) + P4(г) D 5N2(г) + P4O10(т) |
| 14 | C2H6DC2H4 + H2 |
| 15 | 2Sb2S3(т) + 9O2(г)D 2Sb2O3(т) + 6SO2(г) |
| 16 | 4FeS2(т) + 11O2(г)D 2Fe2O3(т) + 8SO2(г) |
| 17 | 2MoS2(т) + 7O2(г)D 2MoO3(т) + 4SO2(г) |
| 18 | 4FeS(т) + 7O2(г)D 2Fe2O3(т) + 4SO2(г) |
| 19 | 2Bi2S3(т) + 9O2(г)D 2Bi2O3(т) + 6SO2(г) |
| 20 | 4ReS2(т) + 15O2(г) D 2Re2O7(т) + 8SO2(г) |
Задание 2.
1) Рассчитайте константу равновесия реакции 3А(г) + 4В(г)D С(г) + 2D(г)если известны (при Т = const) равновесные концентрации веществ (моль/л).
| Вариант | [A] | [B] | [C] | [D] |
| 1 | 0,05 | 0,21 | 0,94 | 0.77 |
| 2 | 0,07 | 0,32 | 1,05 | 0.59 |
| 3 | 0,03 | 0,15 | 0,84 | 0,66 |
| 4 | 0,08 | 0,41 | 0,79 | 0,72 |
| 5 | 0,06 | 0,28 | 0,94 | 0,83 |
| 6 | 0,09 | 0,37 | 0,89 | 0,52 |
| 7 | 0,06 | 0,19 | 1,45 | 0,21 |
2) Рассчитайте константу равновесия реакции 2А(г) + 3В(г)D 5С(г) + 2D(г), если известны (при Т = const) равновесные концентрации веществ (моль/л).
| Вариант | [A] | [B] | [C] | [D] |
| 8 | 0,05 | 0,21 | 0,94 | 0.77 |
| 9 | 0,07 | 0,32 | 1,05 | 0.59 |
| 10 | 0,03 | 0,15 | 0,84 | 0,66 |
| 11 | 0,08 | 0,41 | 0,79 | 0,72 |
| 12 | 0,06 | 0,28 | 0,94 | 0,83 |
|
|
|
|
|
|
| 13 | 0,09 | 0,37 | 0,89 | 0,52 |
| 14 | 0,03 | 0,23 | 0,86 | 0,88 |
|
|
|
|
|
|
3) Рассчитайте константу равновесия реакции 4А(г) + В(г)D 2С(г) + 3D(г), если известны (при Т = const) равновесные концентрации веществ (моль/л).
| Вариант | [A] | [B] | [C] | [D] |
| 15 | 0,05 | 0,21 | 0,94 | 0.77 |
| 16 | 0,07 | 0,32 | 1,05 | 0.59 |
| 17 | 0,03 | 0,15 | 0,84 | 0,66 |
| 18 | 0,08 | 0,41 | 0,79 | 0,72 |
| 19 | 0,06 | 0,28 | 0,94 | 0,83 |
| 20 | 0,09 | 0,37 | 0,89 | 0,52 |
Задание 3.
1) По следующим данным при Т = const для реакции 4NH3(г) + 3O2(г)D 2N2(г) + 6H2O(г)
определите равновесную концентрацию диазота (N2) и начальные концентрации (моль/л) реагентов:
| Вариант | [NH3] | [O2] | [H2O] |
| 1 | 0,37 | 1,74 | 3,78 |
| 2 | 2,44 | 0,59 | 8,22 |
| 3 | 1,63 | 2,15 | 7,44 |
| 4 | 0,86 | 0,43 | 4,02 |
| 5 | 1,22 | 2,79 | 7,56 |
| 6 | 0,48 | 1,25 | 6,33 |
| 7 | 2,18 | 1,65 | 5,64 |
2) По следующим данным при Т = const для реакции 4NО (г) + 6 Н2O(г)D 4NН3(г) + 5O2 (г)
определите равновесную концентрацию аммиака и начальные концентрации (моль/л) реагентов:
| Вариант | [NО] | [H2O] | [O2] |
| 8 | 2,44 | 1,58 | 0,65 |
| 9 | 3.86 | 2,47 | 1,35 |
| 10 | 4,25 | 2,18 | 3,55 |
| 11 | 0,98 | 0,34 | 0,85 |
| 12 | 2,87 | 0,54 | 0,76 |
| 13 | 1,52 | 0,84 | 2,95 |
| 14 | 2,07 | 1,46 | 1,15 |
3) По следующим данным при Т = const для реакции 2NF3(г) + 3H2(г)D 6HF(г) + N2(г)
определите равновесную концентрацию фтороводорода и начальные концентрации (моль/л) реагентов:
| Вариант | [NF3] | [H2] | [N2] |
| 15 | 0,86 | 0,43 | 1,24 |
| 16 | 1,15 | 0,72 | 0,97 |
| 17 | 0,73 | 1,06 | 1,36 |
| 18 | 1,25 | 0,94 | 0,82 |
| 19 | 0,69 | 0,88 | 1,23 |
| 20 | 1,38 | 1,02 | 0,78 |
Практическая работа № 5
Расчёт поверхности теплообменных аппаратов
Цель работы: расcчитать поверхности нагрева теплообменника для заданных расчетных условий.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль параметров технологического процесса и их регулирование.
Методика расчёта
1. Тепловая нагрузка Q теплообменника находится из уравнения теплового баланса:
Q = G1с1( t′1 − t′′1), кВт (1)
или Q = G2с2( t′′2− t′2), кВт (2)
где Q - тепловая нагрузка теплообменника, кВт;
G1 и G2 − расходы теплоносителей, кг/с;
с1 и с2 − удельные теплоемкости теплоносителей при постоянном давлении в интервале рабочих температур, Дж/ (кгК);
t′1 , t′2 — температура греющей жидкости на входе и выходе, °С;
t′′1, t′′2— температура нагреваемой жидкости на входе и выходе, °С.
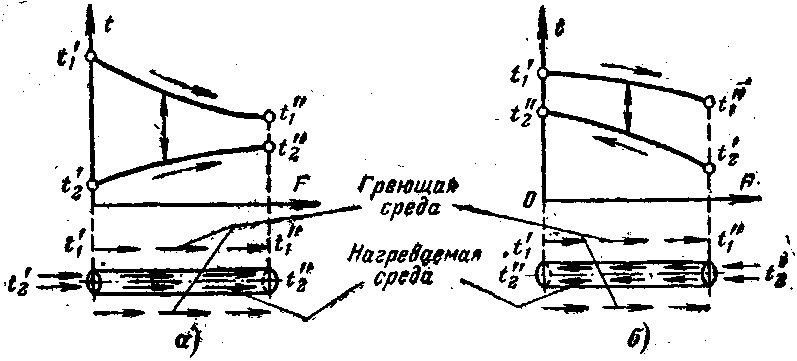
а – прямоток; б - противоток
Рисунок 1 – Схемы теплообменников
2. Средний температурный напор рассчитывается по формуле:
tcp =(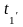 -
-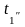 )/2 - (
)/2 - (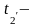
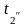 )/2, оС (3)
)/2, оС (3)
3. Поверхность нагрёва теплообменника находится из уравнения теплопередачи
F = Q / (k Δtср),м2 (4)
где F - поверхность нагрёва теплообменника,м2;
Q − тепловая нагрузка, Вт;
k − коэффициент теплопередачи, Вт / (м2К);
Δtср − средний температурный напор между теплоносителями,(°C).
Задание к практической работе № 5.
Определить площадь поверхности нагрева противоточного водоводяного теплообменника, если расход нагреваемой воды G2 = 5кг/с, температура нагревающей воды на входе в теплообменник 90°C, температура нагревающей воды на выходе из теплообменника 60°C, температура нагреваемой воды на входе в теплообменник 20°C, температура нагреваемой воды на выходе из теплообменника 50°C, коэффициент теплопередачи k = 1,1 кВ(м2/К).
Порядок расчёта.
1. Выполнить схему противоточного теплообменника с расстановкой температур (Рисунок 1 б):
2. Рассчитать тепловую нагрузку Q теплообменника по формуле(2), теплоёмкость воды с2принять 4,19 кДж/(кгС);
3. Рассчитать средний температурный напор противоточного водоводяного теплообменникаtcp по формуле (3);
4. Определить площадь поверхности нагрева противоточного водоводяного теплообменника по формуле (4).
Практическая работа №6
Составление технологических схем производства серной кислоты
Цель работы. Научиться составлять технологические схема производства серной кислоты из серы и железного колчедана FeS2.
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики, хотя кларк ее равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный (серный FeS2) колчедан.
Задания для выполнения практической работы № 6.
1. Составить технологическую схему производства SO2 из:
- серы;
- железного (серного FeS2) колчедана.
2. Составить технологическую схему производства серной кислоты.
3, Указать достоинства и недостатки каждого из способов.
Практическая работа №7
Составление технологических схем производства азотной кислоты
Цель работы. Научиться составлять технологические схема производства азотной кислоты из синтетического аммиака.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
Задания для выполнения практической работы № 7.
1. Составить технологическую схему синтеза аммиака;
2. Составить технологическую схему получение азотной кислоты из синтетического аммиака;
3, Указать достоинства и недостатки этого способа.
Практическая работа № 8
Составление технологических схем производства соляной кислоты
Цель работы. Научиться составлять технологические схема производства соляной кислоты сульфатным способом.
Соляную кислоту получают следующими методами:
Задания для выполнения практической работы №8.
1. Составить технологическую схему получения хлористого водорода синтетическим методом;
2. Составить технологическую схему получение соляной кислоты из синтетического хлорводорода;
3, Указать достоинства и недостатки этого способа.
Практическая работа № 9
Составление технологических схем производства изделий стеновой керамики
Цель работы: познакомиться с видами стеновых материалов, научиться работать с ГОСТами, научиться составлять технологические схемы производства керамического кирпича (камня).
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Подготовка к практической работе: повторить виды стеновых керамических изделий их назначение, требования к ним согласно ГОСТ, сырьевые материалы , способы производства.
Задания для выполнения практической работы №9(по вариантам).
1. Выбрать ассортимент выпускаемой продукции (таблица 1);
2.Выполнить рисунок предлагаемой продукции (Приложение 1);
3. Указать назначение предлагаемой продукции;
4. Дать характеристику продукции согласно ГОСТ 530 – 95;
3. Составить технологическую схему производства.
Рекомендуемая литература:
1. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
Таблица1.
| Вариант | Виды выпускаемой продукции |
| 1 | Кирпич с 19 пустотами |
| 2 | Кирпич с 32 пустотами |
| 3 | Кирпич с 21 пустотами |
| 4 | Кирпич с 18 пустотами |
| 5 | Кирпич с 28 пустотами |
| 6 | Камень с 7 пустотами |
| 7 | Камень с 18 пустотами |
| 8 | Камень с 21 пустотами |
| 9 | Камень с 28 пустотами |
| 10 | Кирпич с 8 несквозными отверстиями |
| 11 | Кирпич с 3 сквозными отверстиями |
| 12 | Кирпич с 8 сквозными отверстиями |
| 13 | Кирпич с 11 сквозными отверстиями |
| 14 | Кирпич с 17 сквозными отверстиями |
| 15 | Камень с квадратными пустотами |
| 16 | Кирпич с 6 горизонтальными пустотами |
| 17 | Кирпич с квадратными пустотами |
| 18 | Камень с квадратными пустотами |
| 19 | Камень с 18 пустотами |
| 20 | Камень с 21 пустотами |
| 21 | Камень с 28 пустотами |
| 22 | Кирпич с 8 несквозными отверстиями |
| 23 | Кирпич с 3 сквозными отверстиями |
| 24 | Кирпич с 8 сквозными отверстиями |
| 25 | Кирпич с 11 сквозными отверстиями |
Практическая работа № 10
Составление технологических схем производства керамических плиток
Цель работы: познакомиться с видами облицовочных плиток, научиться работать с ГОСТами, научиться составлять технологические схемы производства керамических плиток.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Подготовка к практической работе: повторить виды керамических плиток, их применение, требования к ним согласно ГОСТ, сырьевые материалы для производства, способы производства.
Задания для выполнения практической работы №10.
1. Выбрать ассортимент выпускаемой продукции (таблица 1);
2. Выполнить рисунок предлагаемой плитки;
3. Указать назначение выбранной плитки и дать ей характеристику согласно ГОСТ;
4. Составить технологическую схему производства керамических плиток
Таблица 1..
| Вариант | Ассортимент плитки | Вариант | Ассортимент плитки |
| 1 | Квадратная плитка для внутренней облицовки стен без завала граней 1 сорта200х200мм | 14 | Квадратная плитка для внутренней облицовки стен с завалом четырех граней1 сорта200х200мм |
| 2 | Прямоугольная плитка для внутренней облицовки стен с завалом двух смежных граней 1 сорта 150х75мм | 15 | Прямоугольная плитка для внутренней облицовки стен с завалом двух смежных граней1 сорта 150х75мм |
| 3 | Квадратная плитка для внутренней облицовки стен с завалом трех граней 1 сорта150х150мм | 16 | Прямоугольная плитка для внутренней облицовки стен с завалом одной грани 1 сорта200х1500мм |
| 4 | Прямоугольная плитка для внутренней облицовки стен с завалом трех граней 1 сорта150х75мм | 17 | Прямоугольная плитка для внутренней облицовки стен с завалом трех граней 1 сорта150х75мм |
| 5 | Квадратная плитка для внутренней облицовки стен с завалом граней 1 сорта100х100мм | 18 | Прямоугольная плитка для внутренней облицовки стен с завалом одной грани 1 сорта200х1500мм |
| 6 | Прямоугольная плитка для внутренней облицовки стен с завалом двух смежных граней 1 сорта 150х75мм | 19 | Квадратная плитка для внутренней облицовки стен с завалом трех граней 1 сорта200х200мм |
| 7 | Квадратная плитка для внутренней облицовки стен с завалом четырех граней1 сорта200х200мм | 20 | Квадратная плитка для внутренней облицовки стен без завала граней 1 сорта200х200мм
|
| 8 | Квадратная плитка для внутренней облицовки стен без завала граней 1 сорта200х100мм | 21 | Квадратная плитка для внутренней облицовки стен без завала граней 1 сорта200х100мм |
| 9 | Прямоугольная плитка для внутренней облицовки стен без завала граней 2 сорта200х100мм | 22 | Прямоугольная плитка для внутренней облицовки стен с завалом одной грани 1 сорта200х1500мм |
| 10 | Прямоугольная плитка для внутренней облицовки стен с завалом двух смежных граней 1 сорта 150х75мм | 23 | Квадратная плитка для внутренней облицовки стен с завалом четырех граней1 сорта200х200мм |
| 11 | Прямоугольная плитка для внутренней облицовки стен без завала граней 2 сорта200х100мм | 24 | Квадратная плитка для внутренней облицовки стен с завалом четырех граней1 сорта200х200мм |
| 12 | Квадратная плитка для внутренней облицовки стен без завала граней 1 сорта200х200мм | 25 | Прямоугольная плитка для внутренней облицовки стен с завалом четырех граней1 сорта200х150мм |
| 13 | Прямоугольная плитка для внутренней облицовки стен с завалом одной грани1 сорта200х1500мм |
|
|
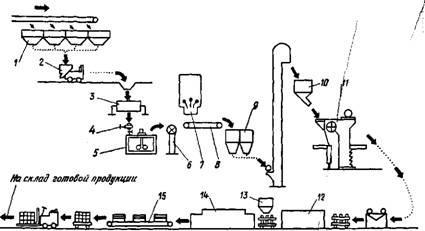
| 
|
Технологическая схема производства глазурованных плиток:
1— сырьевые материалы; 2 — вагонетка; 3 — шаровая мельница; 4 — удаление примесей на электромагните; 5 — бассейн для массы с мешалкой; 6 — насос; 7 — распылительное сушило; 8 — транспортер; 9—просев порошка; 10—расходный бункер; 11— прессование плиток; 12 — сушило; 13— глазурование;14— печь для обжига; 15 — сортировка и упаковка
Рекомендуемая литература:
1. ГОСТы
2. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
Практическая работа № 11
Составление технологических схем производства гипсовых вяжущих веществ
Цель работы. Научиться составлять технологические схемы производства гипсовых вяжущих веществ
Процесс производства гипсовых вяжущих складывается из двух основных операций: измельчения исходного сырья (природного гипса) и обжига, т.е. превращения двуводного гипса в полуводный. Различают три принципиальные технологические схемы изготовления гипсовых вяжущих с преобладающим содержанием - полугидрата: предварительная сушка и измельчение гипсового камня в порошок, и последующий обжиг в гипсоварочном котле; совмещение операций сушки, помола и обжига двуводного гипса; обжиг гипса в виде кусков с последующим измельчением полугидрата в порошок.
Задания для выполнения практической работы №11.
1. Дать характеристику сырьевым материалам для производства гипса в соответствии с ГОСТ 4013-82;
2. Дать характеристику гипсовым вяжущим в соответствии с ГОСТ125-79 и таблицей 1;
3. Составить технологическую схему производства строительного гипса;
4. Пользуясь учебной литературой указать применение гипсовыхвяжущих.
Рекомендуемая учебная литература:
1. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
Таблица 1
| Вариант | Марка вяжущего | Вариант | Марка вяжущего |
|
|
|
| 1 | Г-2 | 14 | Г-3 |
| 2 | Г-3 | 15 | Г-4 |
| 3 | Г-4 | 16 | Г-5 |
| 4 | Г-5 | 17 | Г-6 |
| 5 | Г-6 | 18 | Г-7 |
| 6 | Г-7 | 19 | Г-10 |
| 7 | Г-10 | 20 | Г-13 |
| 8 | Г-13 | 21 | Г-16 |
| 9 | Г-16 | 22 | Г-19 |
| 10 | Г-19 | 23 | Г-22 |
| 11 | Г-22 | 24 | Г-25 |
| 12 | Г-25 | 25 | Г -2 |
| 13 | Г-2 |
|
|
Практическая работа № 12
Составление технологических схем производства известковых вяжущих веществ
Цель работы: Научиться составлять технологические схемы производства строительной извести.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Подготовка к практической работе: повторить известковые вяжущие вещества, их виды, особенности производства, применение, требования к ним согласно ГОСТ, сырьевые материалы для производства.
Задания для выполнения практической работы № 12.
1. Дать характеристику сырьевым материалам для производства извести в соответствии с ОСТ 21-27–76;
2. Дать характеристику извести в соответствии с ГОСТ9179-77;
3. Составить технологическую схему производства строительной извести;
4. Пользуясь учебной литературой указать применение извести.
Рекомендуемая литература:
1. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
ОСТ 21-27–76
Для производства строительной извести, необходимой для приготовления растворов, бетонов, блоков и силикатного кирпича, применяются известняк, мел, доломит и реже мергель. Известь получают путем обжига карбонатных пород в шахтных или вращающихся печах при температуре 1000–1200С до полного удаления углекислого газа.
Требования к карбонатному сырью для выпуска извести регламентированы ОСТ 21-27–76, в котором по содержанию СаСО3, MgСО3и глинистых примесей выделены семь классов (табл. 3).
Таблица 3. Классы карбонатных пород для производства извести
| Содержание, % | Класс |
| А | Б | В | Г | Д | Е | Ж |
| СаСО3, не менее | 92 | 86 | 77 | 72 | 52 | 47 | 72 |
| MgСО3, не более | 5 | 6 | 20 | 20 | 45 | 45 | 8 |
| Глинистые примеси (SiO2+Al2O3+Fe2O3), не более | 3 | 8 | 3 | 8 | 3 | 8 | 20 |
По прочности (МПа), согласно ОСТу, карбонатные породы делятся на твердые (более 60), средней твердости (30–60), мягкие (10–30) и очень мягкие (менее 10). Оптимальным сырьем для изготовления извести являются чистые известняки и мел с незначительной примесью MgCO3и нерастворимого остатка. Предпочтительнее породы, имеющие прочность на сжатие 10–40 МПа.
Практическая работа № 13
Составление технологических схем производства цемента
Цель работы. Научиться составлять технологические схемы производства портландцемента сухим и мокрым способами.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Подготовка к практической работе: повторить гидравлические вяжущие вещества, их виды, особенности производства, применение, требования к ним согласно ГОСТ, сырьевые материалы для производства.
Задания для выполнения практической работы № 13(по вариантам).
1. Дать характеристику ПЦ согласно ГОСТ 10178-85 (Таблица 1).
1. Составить технологическую схему производства портландцемента мокрым способом.
2. Указать применение портландцемента.
Таблица 1.
| Вариант | Вид ПЦ | Вариант | Вид ПЦ |
| 1 | ПЦ-Д0 | 14 | ПЦ-Д0 |
| 2 | ПЦ-Д5 | 15 | ПЦ-Д5 |
| 3 | ПЦ-Д20 | 16 | ПЦ-Д20 |
| 4 | ШПЦ, | 17 | ШПЦ, |
| 5 | ПЦ-Д20-Б | 18 | ПЦ-Д20-Б |
| 6 | ШПЦ-Б | 19 | ШПЦ-Б |
| 7 | ПЦ-Д0 | 20 | ПЦ-Д0 |
| 8 | ПЦ-Д5 | 21 | ПЦ-Д5 |
| 9 | ПЦ-Д20 | 22 | ПЦ-Д20 |
| 10 | ШПЦ, | 23 | ШПЦ, |
| 11 | ПЦ-Д20-Б | 24 | ПЦ-Д20-Б |
| 12 | ШПЦ-Б | 25 | ШПЦ-Б |
| 13 | ПЦ-Д5 |
|
|
Рекомендуемая литература:
1. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
Практическая работа № 14
Составление технологических схем производства листового стекла
Цель работы. Научиться составлять технологические схемы производства листового стекла лодочным способом.
Выполнение практической работы направлено на формирование следующей профессиональной компетенции - осуществлять контроль качества сырья производства тугоплавких неметаллических и силикатных материалов и изделий.
Подготовка к практической работе: повторить понятие «стекло», виды стекла, особенности производства, применение, требования к ним согласно ГОСТ, сырьевые материалы для производства.
Задания для выполнения практической работы № 14 (по вариантам).
1. Дать расшифровку условному обозначению листового стекла (Таблица 1).
2. Дать характеристику листового стекла согласно ГОСТ 111-2001.
2. Составить технологическую схему производства листового стекла лодочным способом; 3. Указать достоинства и недостатки производства листового стекла лодочным способом.
4. Указать применение листового стекла.
Таблица 1.
| Вариант | Обозначение листового стекла | Вариант | Обозначение листового стекла |
| 1 | М0-ТР-1800* 1200*4 | 14 | M4-CBP-2000*1500*1,5 |
| 2 | M1-CBP-2000*1500*6 | 15 | M6-CBP-2000*1500*2,5 |
| 3 | M3-CBP-2000*1500*1,0 | 16 | M7-CBP-2000*1500*3,0 |
| 4 | М5-ТР-1800* 1200*2,0 | 17 | M7-CBP-2000*1500*3,0 |
| 5 | M0-CBP-2000*1500*3,5 | 18 | M1-CBP-2000*1500*4,0 |
| 6 | М3-ТР-1800* 1200*6,0 | 19 | M0-CBP-2000*1500*5,0 |
| 7 | M4-CBP-2000*1500*7,0 | 20 | M2-CBP-2000*1500*5,0 |
| 8 | M5-CBP-2000*1500*8,0 | 21 | М3-ТР-1800* 1200*6,0 |
| 9 | M6-CBP-2000*1500*10,0 | 22 | M4-CBP-2000*1500*7,0 |
| 10 | М7-ТР-1800* 1200*12,0 | 23 | M5-CBP-2000*1500*8,0 |
| 11 | M1-CBP-2000*1500*15,0 | 24 | M6-CBP-2000*1500*10,0 |
| 12 | M3-CBP-2000*1500*19,0 | 25 | М7-ТР-1800* 1200*12,0 |
| 13 | М4-ТР-1800* 1200*25,0 |
|
|
Рекомендуемая литература:
1. ГОСТ 111 – 2001 СТЕКЛО ЛИСТОВОЕ Технические условия
2. И.Г.Дудеров Общая технология силикатов Учебное пособие для СПО Издательство Инфра – М 2014-560 с.
27






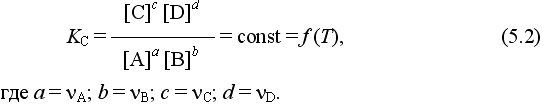
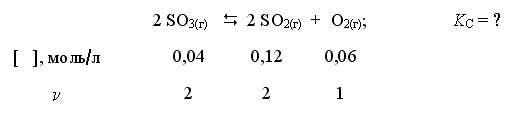
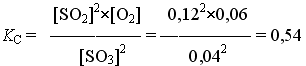
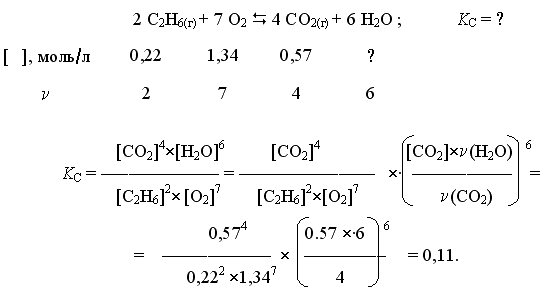
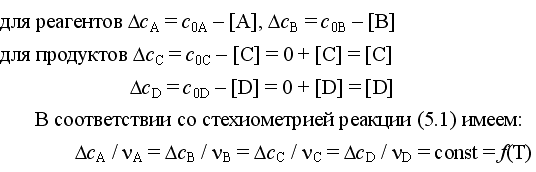



 -
- )/2 - (
)/2 - (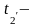
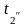 )/2, оС (3)
)/2, оС (3)

















