Конспект урока по теме:
«ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ»
Цели и задачи:
Дидактические:
дать общую характеристику металлов в свете общего, особенного и единичного по трем формам существования;
обобщить, систематизировать и углубить знания обучающихся по теме «Металлы»;
акцентировать внимание обучающихся на причинно - следственной связи: состав → строение → свойства → применение → получение
Развивающие:
Продолжить формировать ОУУН:
давать качественную и количественную характеристику изучаемого объекта;
устанавливать причинно – следственные связи;
организовывать самостоятельную учебную деятельность.
Ход урока
Актуализация познавательной деятельности.
Девиз урока: «Опыт – основа познания»
«Химическая разминка» (слайд №1)
ТЕОРЕТИЧЕСКИЙ БЛОК
Активизация мыслительной деятельности.
Характеристика металлов.
Раскрытие причинно следственной связи:
состав → строение → свойства → применение → получение
Объяснение учебного материала сопровождается слайдовой презентацией (слайды №2-15).
Демонстрация учебного фильма: «Металлы. Свойства металлов»
ПРАКТИЧЕСКИЙ БЛОК.
ИНСТРУКЦИОННАЯ КАРТА
«Металлы их строение, свойства, применение и получение».
Ваша задача отработать учебный материал по теме «Металлы». Для этого необходимо используя текст учебника и дополнительный материал, выполнить задания инструкционной карты. Проанализируйте уровень понимания учебного материала и на основании выбранного уровня приступайте к работе. Не забудьте оценить свою работу по листу самооценки.
I - Уровень
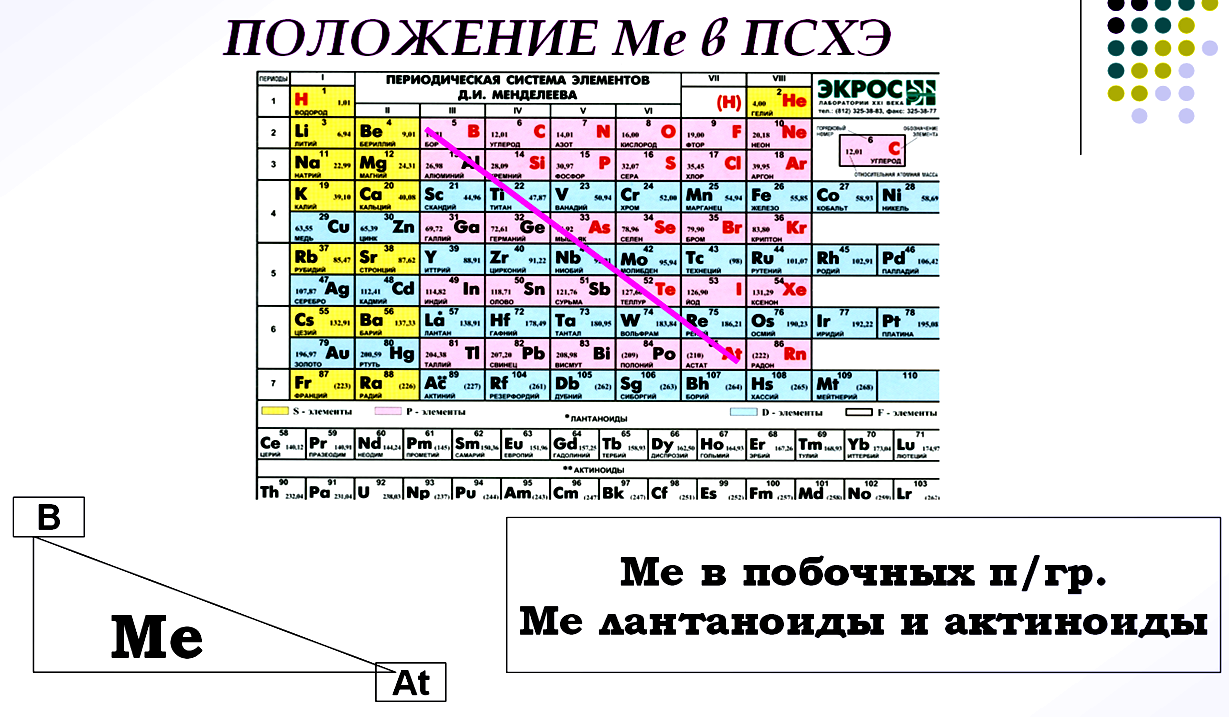
1. Опишите положение металлов в ПСХЭ Д.И. Менделеева.
2. Сравните строение атомов магния и кальция, калия и кальция по плану:
заряд ядра;
количество энергетических уровней;
количество электронов на последнем энергетическом уровне;
радиус атома.
Исходя из строения сравните восстановительную активность (способность отдавать электроны).
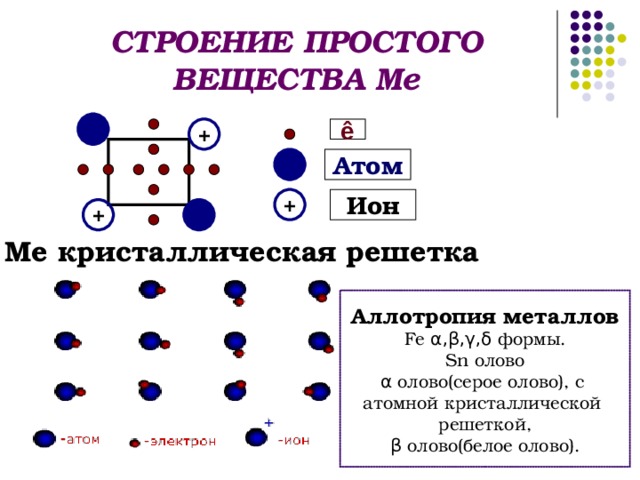
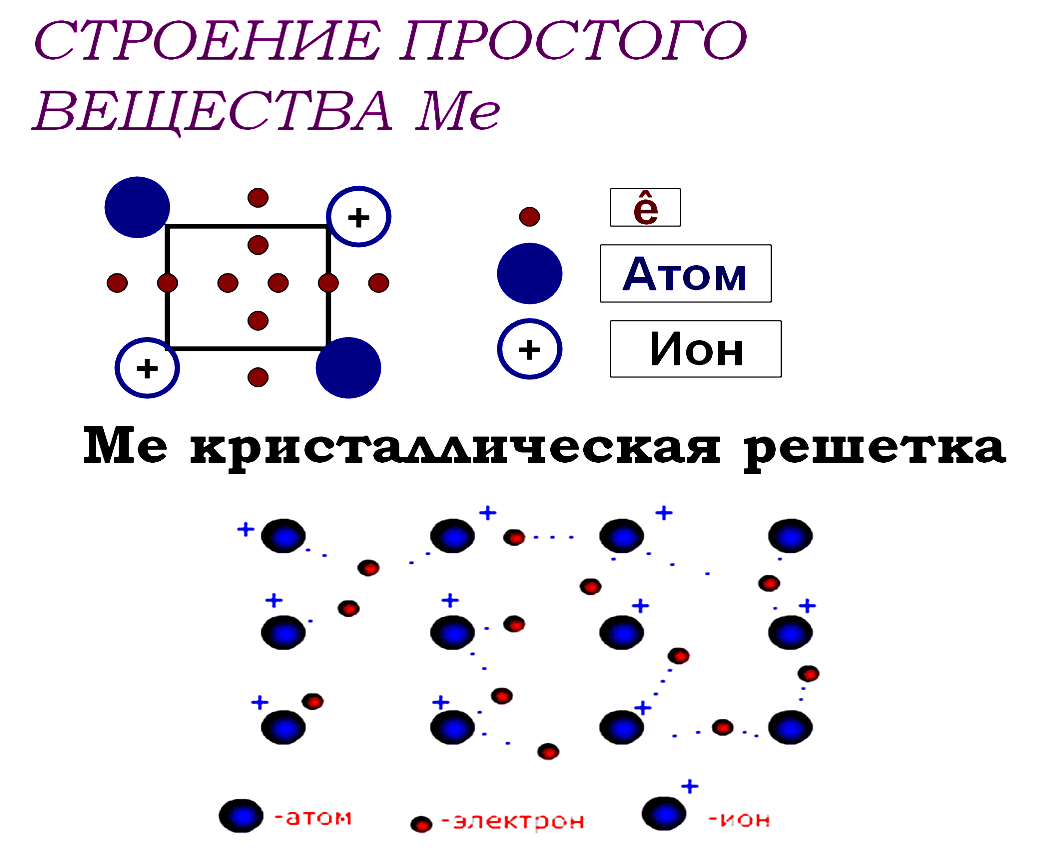
3. Охарактеризуйте строение простых веществ металлов, какие общие физические свойства обуславливает данное строение. Завершите схему:
Ф



 изические свойства металлов
изические свойства металлов
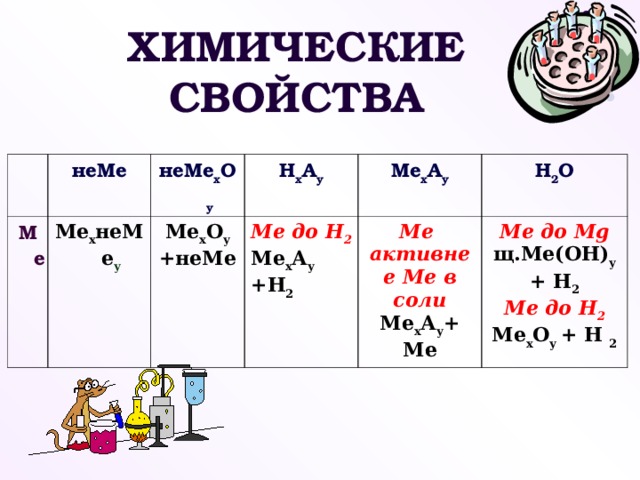
4. Завершите возможные схемы уравнений реакций:
А) Ва + О2 Ж) Cu + H2O
Б) Zn + Cl2 З) Zn + HCl
Г) Ва + Н2 И) Ag + HCl
Д) Са + S Е) К + Н2О
5. Пользуясь рядом напряжений металлов, определите, какая из реакций возможна:
железо (железный гвоздь) и раствор CuSO4;
медь (медная проволока) и раствор FeSO4,
объясните свой выбор.
6. Дайте определение науке металлургии.
Завершите схемы уравнений реакций отражающие способы получения металлов, назовите каждый из способов получения:
Cu2O + C
MgO + CO
Cu2O + H2
CuSO4 + Zn
KCl электролиз расплава.
II Уровень
1. Опишите положение металлов в ПСХЭ Д.И. Менделеева.
2. Сравните строение атомов натрия, магния и алюминия, исходя из строения объясните почему натрий является щелочным металлом и его соединения с ярко выраженными основными свойствами, магний щелочноземельный и соединения его обладают менее ярко выраженные основные свойства относительно натрия и его соединений, а алюминий переходный элемент и его соединения обладают амфотерными свойствами.
3. Сравните физические свойства алюминия и серы, α – олова и β – олова, объясните чем обусловлены отличия этих свойств.
4. Сравните взаимодействие натрия, цинка, серебра с водой, сделайте вывод об их восстановительной активности, приведите примеры уравнений реакций, назовите продукты взаимодействия.
5. Приведите примеры уравнений реакций взаимодействия магния, цинка, меди с соляной кислотой. Охарактеризуйте признаки реакций, основываясь на положении металлов в электрохимическом ряду напряжений.
6. Пользуясь рядом напряжений металлов, определите, какая из реакций возможна:
железо (железный гвоздь) и раствор сульфата меди (II);
медь (медная проволока) и раствор сульфата железа (II),
объясните свой выбор.
7. Дайте определение науке металлургии.
Составьте уравнения реакций получения Zn, К и Cu всеми возможными способами.
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ




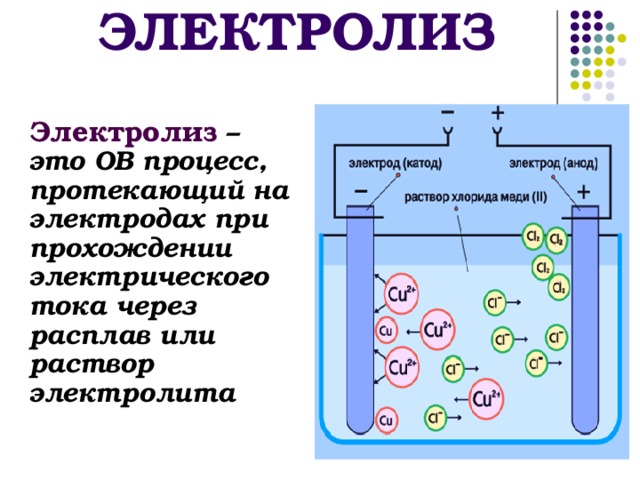
Существует электролиз расплавов и растворов электролитов.
Электролиз расплава КCl
KCl→K+ + Cl -.
На аноде 2Сl - - 2 ē → Cl20
На катоде К+ + ē → К0
2KCl→ 2K0 + Cl20
Электролиз раствора KCl
KCl→K+ + Cl -
H2O ↔ H+ + OН-
Катод (-) 2Н+ + 2 ē →Н20
Анод (+) 2Сl - -2ē→ Cl20
Cуммарное уравнение электролиза
2KCl + 2 H2O → Н20↑+ Cl20↑ + 2KOH
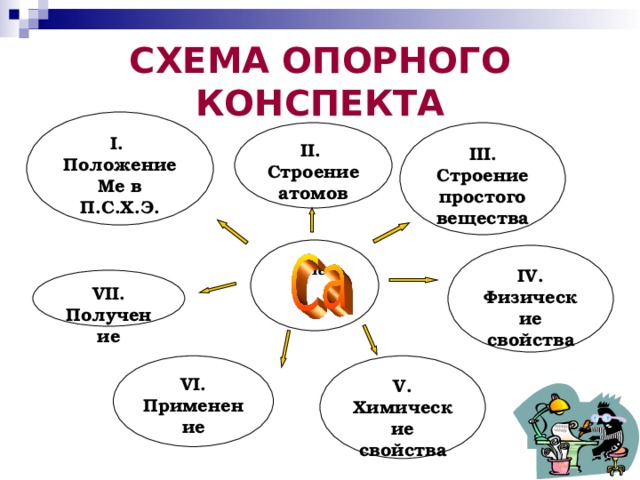
Домашнее задание: составить опорный конспект «Металлы»
(Слайд №16)
Схема опорного конспекта

Подведение итогов.
(Слайд 17-18)
УЧИМСЯ ДАВАТЬ САМООЦЕНКУ
(опросник)
1. Ф.И.
2. Уровень работы.
3. Номера заданий выполненных самостоятельно и без ошибок.
4. Номера заданий выполненных самостоятельно с допущенными ошибками.
5. Номера заданий выполненных после объяснения учителя.
6. Какие задания остались не понятыми, постарайтесь сформулировать вопросы по этим заданиям.
7. В соответствии с выбранным уровнем работы, качеством выполненных заданий и уровнем понимания выполненных заданий оцените себя по пятибалльной шкале.











 изические свойства металлов
изические свойства металлов











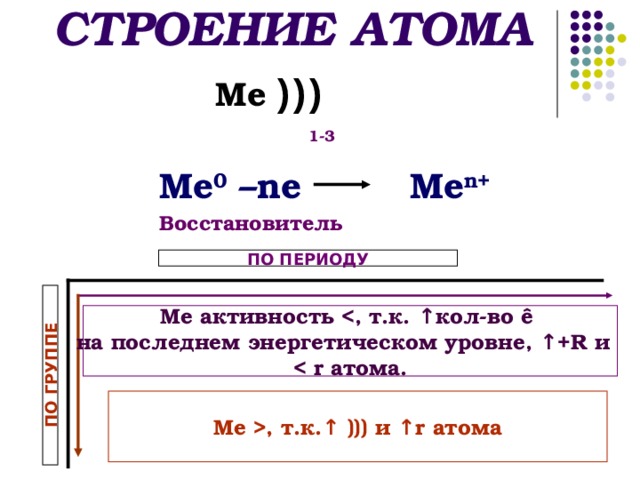 , т.к.↑ ))) и ↑ r атома" width="640"
, т.к.↑ ))) и ↑ r атома" width="640"