| МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «Югорский государственный университет» (ЮГУ)
НЕФТЯНОЙ ИНСТИТУТ (ФИЛИАЛ) ФЕДЕРАЛЬНОГО ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ ВЫСШЕГО ОБРАЗОВАНИЯ «ЮГОРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» (НефтИн (филиал) ФГБОУ ВО «ЮГУ») 
|
| РАССМОТРЕНО На заседании ПЦК МиЕНД Протокол заседания № 2 от «13» 03. 2024г. __________Белоусова Н.Н..
|
| УТВЕРЖДЕНО Зам. директора по МП и ВР НефтИН (филиал) ФГБОУ ВО «ЮГУ» _____________ Антонова А.П. « » 2024г.
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ВНЕКЛАССНОГО МЕРОПРИЯТИЯ
ОЛИМПИАДА
по дисциплине ОП.03 ОРГАНИЧЕСКАЯ ХИМИЯ
для обучающихся 2-го курса
специальности 18.02.09 Переработка нефти и газа
Преподаватель: ______________ Шакирова Р.Х.
Нижневартовск 2024
Пояснительная записка
Цель: выявление обучающихся, имеющих лучшие результаты в овладении знаниями и умениями по учебной дисциплине ОП..03 Органическая химия.
Задачи:
1. Повышение познавательного интереса обучающихся к изучению органической химии
2. Пропаганда химических знаний
3. Создание оптимальных условий для выявления наиболее способных обучающихся
Время на проведение олимпиады – 2 часа
Работа состоит из 2 частей и включает 18 заданий.
Часть 1 включает 10 заданий (А1–А10). К каждому заданию даётся 4 вариантов ответа, из которых только один правильный.
Часть 2 состоит из 6 заданий (В1–В6) – решение задач
Критерии оценивания олимпиадной работы
Часть А
За правильный ответ на каждое задание части А(А1 – А10) ставится 2 балла.
Если указаны два и более ответов (в том числе правильный), неверный ответ или ответ отсутствует – 0 баллов. Максимальное количество баллов за задания части А – 20 баллов.
Часть B
Решения заданий части В (В1 – В8) с развёрнутым ответом оцениваются на основе критериев, представленных в эталоне ответа, за выполнение каждого задания в зависимости от полноты и правильности данного ответа выставляется от 0 до 5 баллов. Максимальное количество баллов за задания части В – 27 баллов.
Максимальное количество баллов за задания олимпиады – 47 баллов.
Победителями олимпиады считаются студенты, получившие три максимальных результата:
47-44 балла – 1 место
43- 39 баллов – 2 место
38-35 баллов – 3 место
Часть А: Выбери правильный ответ (каждый правильный ответ – 2 балла)
А1. Термин «Органические вещества» ввел?
а) Ф. Велер б) Н.Н. Зинин в) А.М.Бутлеров г) Й.Я.Берцелиус
А2. Не токсичным является каждый из двух газов:
а) Н2; Cl2 б) О2; СН4 в) Cl2; Н2S г) Не; SО2
А3. Взрывчатую смесь с воздухом образует:
а) Н2 б) СО2 в) СН4 г) SО2
А4. Тип гибридизации 1-2-3-4 атомов углерода в молекуле 2- бутена
а) sp3-sp2-sp2-sp3 б) sp3-sp-sp-sp3 в) sp2-sp-sp-sp2 г) sp3-sp3-sp3-sp3
А5. Типичная последовательность восстановления органических веществ:
а) альдегид →кислота → двухатомный спирт
б) кислота →альдегид → спирт
в) спирт → кислота → кетон
г) кислота → спирт →альдегид
А6. Какую степень окисления в соединении НСООН проявляет атом углерода
а) – 4 б) 0 в) + 2 г) + 4
А7. Какое вещество является изомером фруктозы?
а) сахароза б) глюкоза в) крахмал г) целлюлоза.
А8. Укажите формулу нефти
а) СН4 б) С5Н12 в) С6Н6 г) формулы нет
А9. Углеводород, который обесцвечивает бромную воду, легко полимеризуется, присоединяет водород и взаимодействует с гидроксидом диамин серебра
а) этилен б) ацетилен в) этан г) пропилен
А10. Перегонка нефти основана на
а) различной плотности углеводородов б) различных химических свойствах
в) различных температурах кипения углеводородов г) расщеплении молекул на части
Часть В: Написание уравнений реакций и решение задач
В1. В реакцию «серебряного зеркала» вступают все вещества ряда
а) ацетилен, этилен, ацетальдегид
б) формальдегид, уксусная кислота, этанол
в) глюкоза, фруктоза, крахмал
г) формальдегид, ацетальдегид, глюкоза
Почему реакция получила такое название, Напишите уравнения реакций для соединений возможного ряда. Дайте названия продуктам реакций (5 баллов)
В2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций:
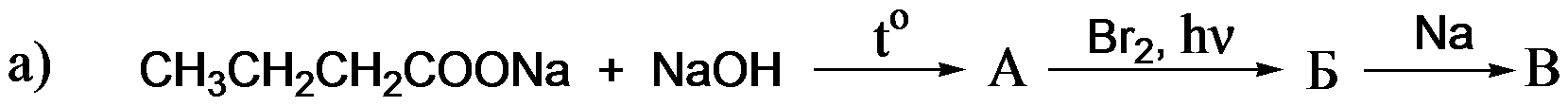
Ответ подтвердите уравнениями реакций, дайте названия полученным веществам (4 балла)
В3. Напишите структурную формулу вещества, оказывающего антисептическое и слабое
местноанестезирующее действие. Оно входит в состав валидола, сосудорасширяющего средства, применяется в парфюмерии и пищевой промышленности. Как лекарственное средство, его называют ментолом, как химическое вещество – 2-изопропил-5-метилциклогексанол-1. К какому классу веществ относится данное вещество? (2 балла)
В4. Химический элемент Б – неметалл, открытый в 1811 г. промышленником
Б. Куртуа. Существует версия, что Куртуа должен за это открытие быть благодарен кошке, которая, убегая, опрокинула сосуд с серной кислотой на золу морских водорослей. Из образовавшейся смеси неожиданно пошли густые фиолетовые пары. Это вещество с резким запахом состояло из атомов элемента Б, который и получил свое название за цвет этих паров. Назови Б. В каком органе у человека содержится основное количество Б? Что происходит с организмом при его нехватке? (4 балла)
В5. В склянках без надписей находятся растворы органических веществ: этанол, глицерин, фенол, ацетальдегид, муравьиная кислота. Предложите радикальный способ определения этих веществ. Напишите уравнения реакций, укажите их признаки. (5 баллов)
В6. При сгорании 4,4 г углеводорода образовалось 7,2 г воды. Выведите формулу этого вещества. (3 балла)
В7. При хлорировании этана было выделено вещество, содержащее 84,5% хлора. Что это за вещество? Напишите уравнение данной реакции, укажите условие реакции и дайте название продукту реакции (2 балла)
В8. Самки бабочки медведицы сигнализируют самцам с помощью пахучего вещества – аттрактанта. Это 2-метил-замещенный алкан. Его относительная молекулярная масса равна 254. Определите молекулярную формулу данного алкана, дайте ему название по систематической номенклатуре . (2 балла)
Эталоны ответов олимпиадных заданий по химии
Часть А.
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| г | б | в | б | б | в | б | г | б | в |
Максимальное количество баллов – 20 б.
Часть В.
В1. 1 балл за правильный выбор - 1г.
Реакция получила такое название, т.к. в результате реакции выделяется чистое серебро – 1б
И по 1 баллу за каждое уравнение реакции
НСОН + 2Ag2О (ам. р.) = СО2 + Н2О + 4Ag - 1 балл
СН3СОН + Ag2О = СН3СООН + 2Ag - 1 балл (уксусная кислота)
С6Н12О6 + Ag2O = С6Н12О7 +2AgCl - 1 балл (глюконовая кислота)
Всего за задачу – 5 баллов
В2. 1) СН3-СН2-СН2- СООNa + NaОН → СН3-СН2-СН3 + Na2СО3
2) СН3-СН2-СН3 + Br2→ СН3-СН-СН3 +Н Br
│
Br
3) СН3-СН-СН3 + 2Na → СН3-СН-СН – СН3
│ │ │
Br СН3 СН3
Пропан, 2- бромпропан, 2,3-диметилбутан
Всего за задание 4 балла
В3. 2-изопропил-5-метилциклогексанол-1.
Класс – циклические спирты, одноатомный спирт
Всего за задание 2 балла
В4. I2. (1 балл) В организме человека йод сосредоточен главным образом в щитовидной железе и участвует в образовании ее гормонов (2 балла).
Вследствие недостатка йода, поступающего с пищей, у людей развивается заболевание – эндемический зоб (1 балл).
Всего за задачу 4 балла.
В5. Из склянок часть растворов перелить в пробирки. Склянки и пробирки пронумеровать.
В каждую пробирку добавить несколько капель индикатора (лакмус), цвет индикатора поменяется только в двух пробирках, содержащих растворы фенола и муравьиной кислоты:
НСООН ↔ Н++ НСОО- С6Н5ОН ↔ Н++ С6Н5О-
В эти пробирки налить свежеосажденный гидроксид меди (II):
CuSO4+ 2NaOH → Cu(OH)2+ Na2SO4
2HCOOH + Cu(OH)2→ (HCOO)2Cu + H2O (осадок растворился)
С6Н5ОН + Сu(OH)2 ≠
В оставшиеся три пробирки налить свежеосажденный гидроксид меди (II):
растворение осадка произойдет пробирке, где находился глицерин:
СН2(ОН) – СН(ОН) – СН2(ОН) + Cu(OH)2 + глицерат меди (2) – раствор синего цвета
Две другие пробирки нагреть.
В пробирке, в которой находился раствор ацетальдегида цвет осадка изменится на кирпично-красный:
СН3СНО + 2Cu(OH)2→ Сu2O↓ + CH3COOH + 2H2O
Следовательно, в оставшейся пробирке находится раствор этанола.
Всего за задание 5 баллов.
В6. 1) Найдем массу водорода по формуле воды: 18г (Н2О) содержит 2г Н2, в 7,2г (Н2О) содержит х г Н2, отсюда m(Н2) равна 0,8г
m(С) = 4,4 – 0,8 =3,6
2) Найдем количество атомов углерода и водорода: массу элементов разделим на их атомную массу: n(Н2) = 0,8 : 1 = 0,8 n(С) = 3,6: 12 = 0,3,Количество атомов увеличим в 10 раз и получим С3Н8 - пропан
Всего за задачу 3 балла
В7. n(Cl) = 84,5:35,5= 2 атома
С2Н6 + Cl2 → С2Н4 Cl2 дихлорэтан, реакция идет на свету.
Всего за задачу 2 балла
В8. 2-метилзамещенный алкан
Mr(СnНn+1-СН3) = 254
12n +2n +1 +12+3=254
14n = 238, n = 17, следовательно, молекулярная формула С18Н38 октадекан
Всего за задание 2 балла
Всего за задание В 27 баллов

























