Конспект урока по теме:
«УГЛЕВОДЫ. ГЛЮКОЗА»
Цели и задачи:
Дидактические:
опираясь на знания обучающихся по кислородсодержащим соединениям, дать представление о глюкозе, как наиболее ярком представителе класса углеводов;
акцентировать внимание обучающихся на причинно - следственной связи: состав → строение → свойства → применение → получение
Развивающие:
Продолжить формировать ОУУН:
давать качественную и количественную характеристику изучаемого объекта;
устанавливать причинно – следственные связи;
организовывать самостоятельную учебную деятельность.
Ход урока
Актуализация познавательной деятельности.
«Химическая разминка», сопровождается слайдовой презентацией (слайды №2-5).
ТЕОРЕТИЧЕСКИЙ БЛОК
Активизация мыслительной деятельности.
Характеристика глюкозы.
Раскрытие причинно следственной связи:
состав → строение → свойства → применение → получение
Объяснение учебного материала сопровождается слайдовой презентацией (слайды №6-27).
ПРАКТИЧЕСКИЙ БЛОК. (слайды №28-30).
ИНСТРУКЦИОННАЯ КАРТА
УГЛЕВОДЫ. ГЛЮКОЗА
(учебный текст)
Изучите учебный текст
I. Классификация углеводов
По способности к гидролизу углеводы классифицируют на группы:
Простые – моносахариды:
глюкоза – С6Н12О6, фруктоза - С6Н12О6.
Сложные
1. Дисахариды (сахароза- С12Н22О11, .
2. Полисахариды (крахмал – (С6Н10О5)n, целлюлоза -(С6Н10О5)n,
Дисахарид (С12Н22О11,)+ вода → глюкоза (С6Н12О6).
Полисахариды (С6Н10О5)n + вода →глюкоза (nС6Н12О6).
II. ГЛЮКОЗА
Нахождение в природе: плоды и ягоды

Физические свойства: Ц (белый), З (нет), растворима в Н2О, В (сладкий)
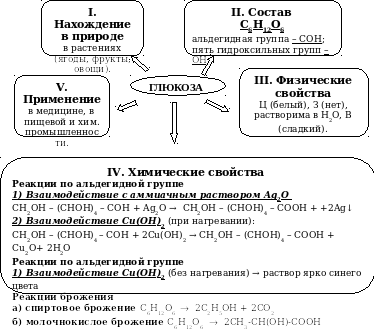
Молекулярный состав глюкозы С6Н12О6.
Особенностью строения является наличие:
альдегидной группы – СОН (сходство с альдегидами);
пяти гидроксильных групп -ОН (сходство с многоатомными спиртами).
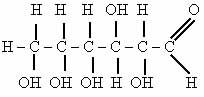
ГЛЮКОЗА – АЛЬДЕГИДОСПИРТ.
Качественные реакции
+ Cu(ОН)2, ярко синий цвет (на гидроксильные группы).
+ Сu(ОН)2 при нагревании, изменение цвета с синего на желтый и красный (на альдегидную группу).
+ Ag2О (серебряное зеркало, на альдегидную группу)
Реакции по альдегидной группе
1) Взаимодействие с аммиачным раствором Ag2O (реакция серебренного зеркала):
СН2ОН – (СНОН)4 – СОН + Ag2O → СН2ОН – (СНОН)4 – СООН + +2Ag↓
2) Взаимодействие Cu(OH)2 (при нагревании):
СН2ОН – (СНОН)4 – СОН + 2Сu(ОН)2 → СН2ОН – (СНОН)4 – СООН + Сu2О + 2Н2О
Реакции по гидроксильным группам (сходство с многоатомными спиртами).
Образование комплексных соединений синего цвета с Сu(ОН)2 гидроксидом меди (II) – качественная реакция на гидроксильные группы.
РЕАКЦИИ БРОЖЕНИЯ ГЛЮКОЗЫ
а) спиртовое брожение C6H12O6 ® 2C2H5OH + 2CO2
б) молочнокислое брожение C6H12O6 ® 2CH3-CH(OH)-COOH
Применяется глюкоза медицине, в пищевой и химической промышленности.
ГЛЮКОЗА.
Изучив характеристику углеводов, используя учебный текст и материал учебника, преобразуйте изученный материал в блочный конспект






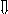

(слайд №31).
ГЛЮКОЗА.
Проверьте качество составленного вами блочного конспект, исправьте ошибки.
Подведение итогов(слайд №32).
О ЦЕНИТЕ УСПЕШНОСТЬ СВОЕЙ РАБОТЫ
ЦЕНИТЕ УСПЕШНОСТЬ СВОЕЙ РАБОТЫ
Я успел выполнить работу! Я молодчина! Я хорошо подготовился к уроку!

 Я с работой не справился в следствии плохой подготовки к уроку.
Я с работой не справился в следствии плохой подготовки к уроку.
На следующем уроке я буду чувствовать себя так!







 Осуществите цепочку превращений:
Осуществите цепочку превращений: Результаты опыта занесите в технологическую карту.
Результаты опыта занесите в технологическую карту.  Получите оксид железа (III) (Fe2O3), исходя из хлорида железа (III) (FeCl3)
Получите оксид железа (III) (Fe2O3), исходя из хлорида железа (III) (FeCl3) 









 ЦЕНИТЕ УСПЕШНОСТЬ СВОЕЙ РАБОТЫ
ЦЕНИТЕ УСПЕШНОСТЬ СВОЕЙ РАБОТЫ
 Я с работой не справился в следствии плохой подготовки к уроку.
Я с работой не справился в следствии плохой подготовки к уроку. 

















