
Практическая работа №7
« Решение экспериментальных задач по теме «Основные классы неорганических соединений »
8 класс

Техника безопасности

Цель: научиться решать экспериментальные задачи с участием основных классов неорганических соединений.
ЗАДАЧИ:
- закрепить теоретические знания об основных классах неорганических соединений;
- провести четыре реакции нейтрализации;
- получить четыре соли, щелочь и нерастворимое основание, одну кислоту и один металл;
- провести идентификацию кислоты, основания и соли;
- оформить отчет по практической работе;
- сделать вывод по результатам практической работы.

Оборудование: лабораторный штатив, лабораторные пробирки.
Реактивы: растворы гидроксида натрия (NaOH), серной кислоты, азотной кислоты, сульфата меди (II), фенолфталеина, хлорида бария, соляной кислоты, нитрата серебра, сульфата аммония, известковая вода, твердые вещества: железо, карбонат натрия .
Ход работы
Что делали
Что наблюдали (рисунки)
Уравнение реакции, вывод
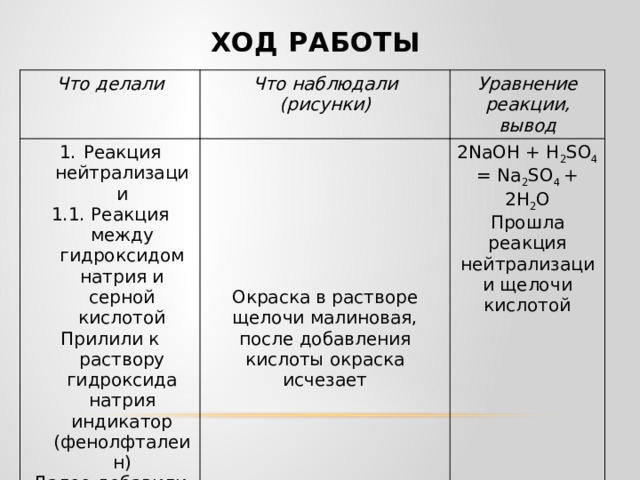
1.1. Реакция между гидроксидом натрия и серной кислотой
Прилили к раствору гидроксида натрия индикатор (фенолфталеин)
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2Н 2 O
Прошла реакция нейтрализации щелочи кислотой
Далее добавили серную кислоту до исчезновения окраски
Окраска в растворе щелочи малиновая, после добавления кислоты окраска исчезает
Что делали
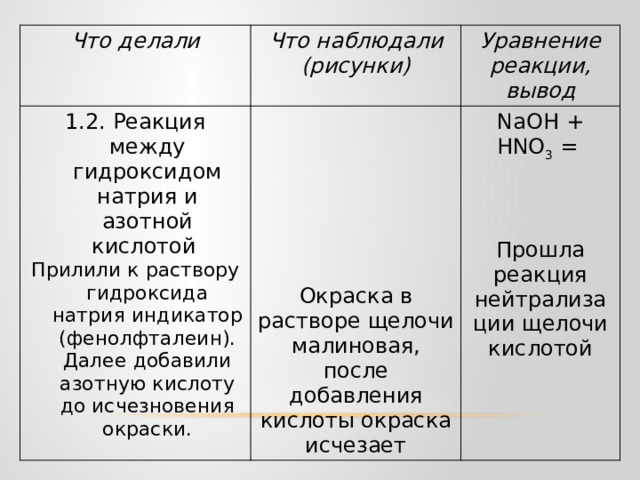
1.2. Реакция между гидроксидом натрия и азотной кислотой
Что наблюдали (рисунки)
Прилили к раствору гидроксида натрия индикатор (фенолфталеин). Далее добавили азотную кислоту до исчезновения окраски.
Уравнение реакции, вывод
NaOH + HNO 3 =
Прошла реакция нейтрализации щелочи кислотой
Окраска в растворе щелочи малиновая, после добавления кислоты окраска исчезает
Что делали
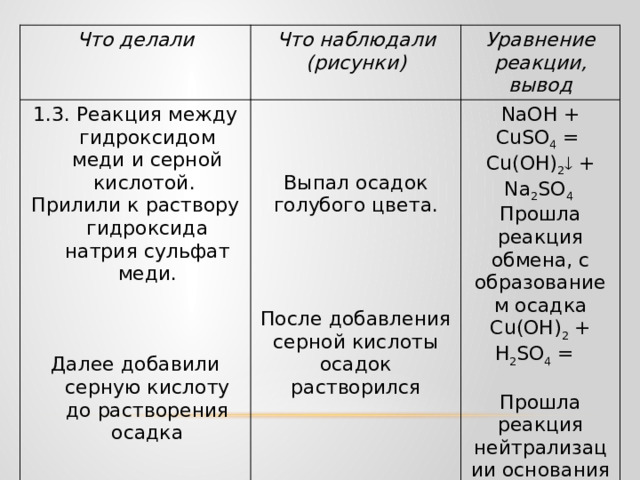
1.3. Реакция между гидроксидом меди и серной кислотой.
Что наблюдали (рисунки)
Прилили к раствору гидроксида натрия сульфат меди.
Уравнение реакции, вывод
NaOH + CuSO 4 = Cu(OH) 2 + Na 2 SO 4
Прошла реакция обмена, с образованием осадка
Выпал осадок голубого цвета.
Cu(OH) 2 + H 2 SO 4 =
Далее добавили серную кислоту до растворения осадка
Прошла реакция нейтрализации основания кислотой
После добавления серной кислоты осадок растворился
Что делали
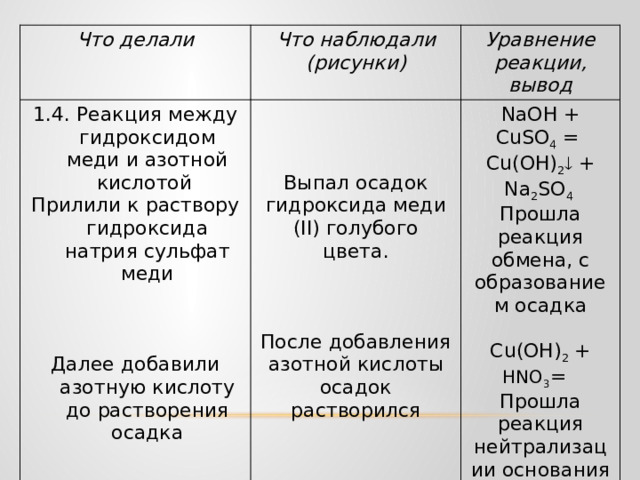
1.4. Реакция между гидроксидом меди и азотной кислотой
Что наблюдали (рисунки)
Прилили к раствору гидроксида натрия сульфат меди
Уравнение реакции, вывод
NaOH + CuSO 4 = Cu(OH) 2 + Na 2 SO 4
Прошла реакция обмена, с образованием осадка
Выпал осадок гидроксида меди (II) голубого цвета.
Далее добавили азотную кислоту до растворения осадка
Cu(OH) 2 + HNO 3 =
Прошла реакция нейтрализации основания кислотой
После добавления азотной кислоты осадок растворился
Что делали
2. Получение соединений
Что наблюдали (рисунки)
2.1. Получение четырех солей
Уравнение реакции, вывод
Прилили к раствору гидроксида натрия индикатор. Далее добавили соляную кислоту до исчезновения окраски
Окраска в растворе щелочи малиновая, после добавления кислоты окраска исчезает
NaOH + НСl =
Прошла реакция обмена, с образованием соли и воды
Что делали
Что наблюдали (рисунки)
2.2. Получение четырех солей
Прилили к раствору хлорида бария раствор сульфата меди (II).
Уравнение реакции, вывод
Выпал осадок белого цвета
ВаСl 2 + CuSO 4 =
Прошла реакция обмена, с образованием осадка (двух новых солей)
Что делали
Что наблюдали (рисунки)
2.3. Получение четырех солей
Прилили к раствору гидроксида меди раствор сульфата меди (II).
Уравнение реакции, вывод
Выпал осадок голубого цвета .
CuSO 4 + NaOH =
Прошла реакция обмена, с образованием осадка и новой соли (сульфата натрия)
Что делали
2.4. Получение щелочи
Что наблюдали (рисунки)
Прилили к раствору хлорида бария раствор гидроксида натрия.
Уравнение реакции, вывод
ВаСl 2 + NaOH=
2.5. Получение нерастворимого основания
Прошла реакция обмена, с образованием новой щелочи
Прилили к раствору сульфата меди раствор гидроксида натрия.
CuSO 4 + NaOH =
Выпал осадок гидроксида меди (II) голубого цвета.
Выпал осадок голубого цвета.
Что делали
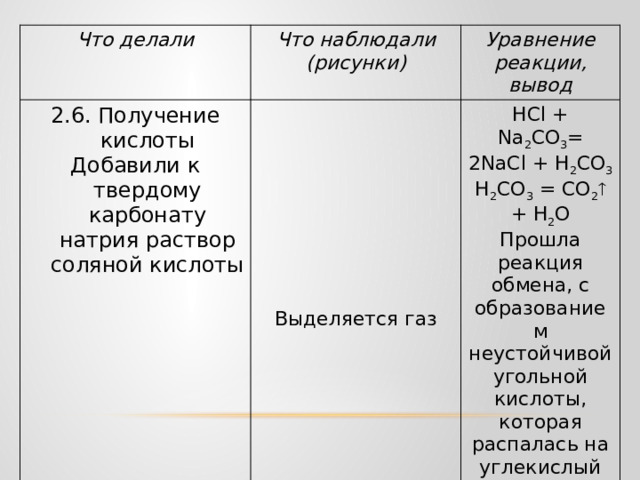
2.6. Получение кислоты
Что наблюдали (рисунки)
Добавили к твердому карбонату натрия раствор соляной кислоты
Уравнение реакции, вывод
НСl + Na 2 СО 3 = 2NaCl + H 2 CO 3
H 2 CO 3 = CO 2 + H 2 O
Прошла реакция обмена, с образованием неустойчивой угольной кислоты, которая распалась на углекислый газ и воду.
Выделяется газ

Что делали
Что наблюдали (рисунки)
2.6. Получение металла
Добавили к раствору сульфата меди металл – железо
Уравнение реакции, вывод
Fe + CuSO 4 =
На железе выделился металл красного цвета
Прошла реакция замещения, активное железо заместило менее активную медь из её соли
Что делали
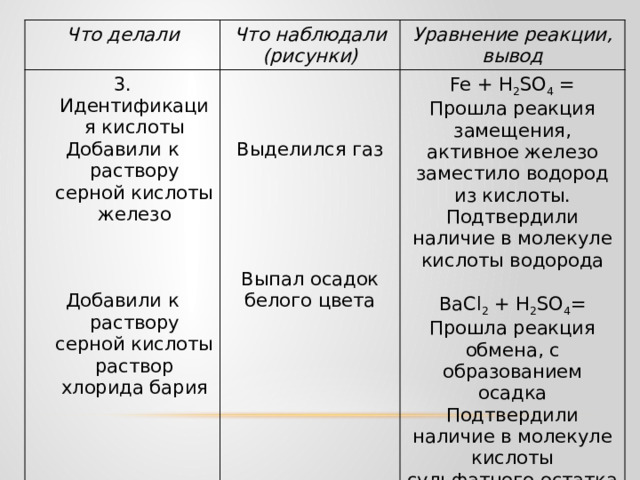
3. Идентификация кислоты
Что наблюдали (рисунки)
Добавили к раствору серной кислоты железо
Уравнение реакции, вывод
Fe + Н 2 SO 4 =
Прошла реакция замещения, активное железо заместило водород из кислоты. Подтвердили наличие в молекуле кислоты водорода
Выделился газ
Добавили к раствору серной кислоты раствор хлорида бария
ВаСl 2 + H 2 SO 4 =
Прошла реакция обмена, с образованием осадка
Подтвердили наличие в молекуле кислоты сульфатного остатка
Выпал осадок белого цвета
Что делали
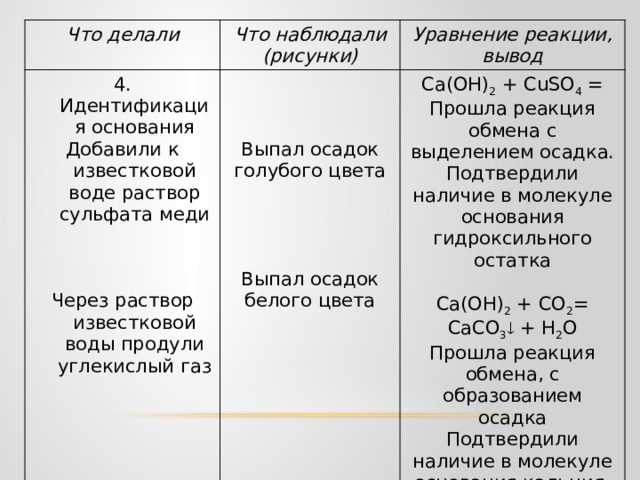
4. Идентификация основания
Что наблюдали (рисунки)
Добавили к известковой воде раствор сульфата меди
Уравнение реакции, вывод
Са(ОН) 2 + СuSO 4 =
Прошла реакция обмена с выделением осадка. Подтвердили наличие в молекуле основания гидроксильного остатка
Выпал осадок голубого цвета
Через раствор известковой воды продули углекислый газ
Са(ОН) 2 + СО 2 = СаСО 3 + Н 2 О
Прошла реакция обмена, с образованием осадка
Подтвердили наличие в молекуле основания кальция.
Выпал осадок белого цвета
Что делали
Что наблюдали (рисунки)
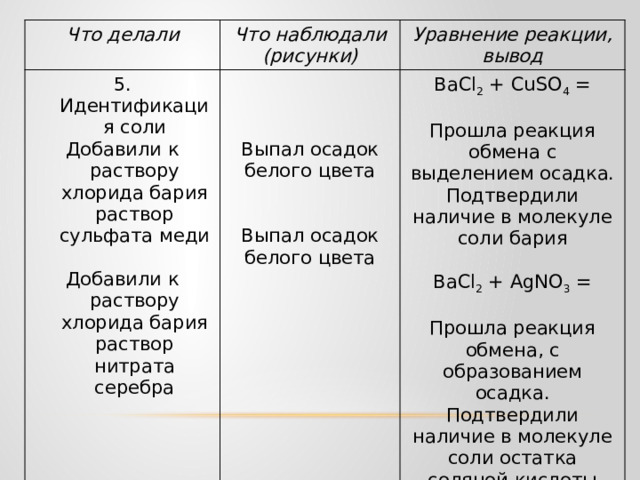
5. Идентификация соли
Добавили к раствору хлорида бария раствор сульфата меди
Уравнение реакции, вывод
ВаСl 2 + СuSO 4 =
Добавили к раствору хлорида бария раствор нитрата серебра
Выпал осадок белого цвета
Прошла реакция обмена с выделением осадка. Подтвердили наличие в молекуле соли бария
ВаСl 2 + АgNO 3 =
Выпал осадок белого цвета
Прошла реакция обмена, с образованием осадка.
Подтвердили наличие в молекуле соли остатка соляной кислоты (хлорид).
Что делали
Что наблюдали (рисунки)
5. Идентификация соли
Добавили к раствору сульфата аммония раствор хлорида бария
Уравнение реакции, вывод
ВаСl 2 + (NH 4 ) 2 SO 4 =
Добавили к раствору сульфата аммония раствор щелочи
Выпал осадок белого цвета
Прошла реакция обмена с выделением осадка. Подтвердили наличие в молекуле соли сульфатного остатка
(NH 4 ) 2 SO 4 + 2NaOH = NH 3 *H 2 O + Na 2 SO 4
Прошла реакция обмена, с образованием неустойчивого основания, дающего газ (аммиак).
Почувствовали запах аммиака

Вывод
самостоятельная формулировка (по цели)












































