
Водород
Физические и химические свойства. Способы получения и собирания.
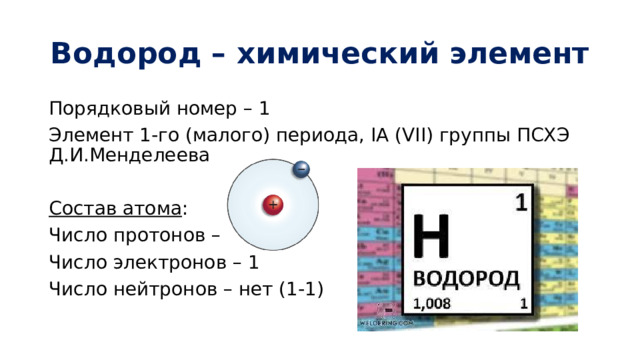
Водород – химический элемент
Порядковый номер – 1
Элемент 1-го (малого) периода, IА (VII) группы ПСХЭ Д.И.Менделеева
Состав атома :
Число протонов – 1
Число электронов – 1
Число нейтронов – нет (1-1)
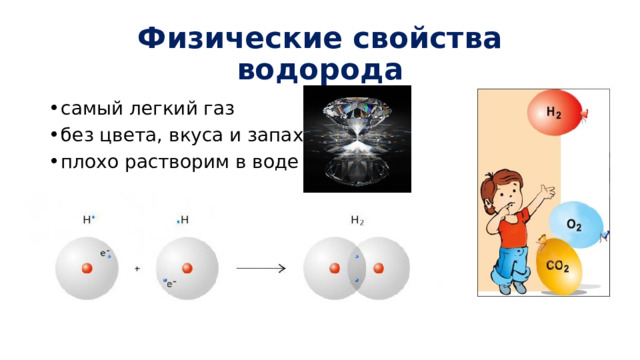
Физические свойства водорода
- самый легкий газ
- без цвета, вкуса и запаха
- плохо растворим в воде

Распространенность водорода
- самый распространенный элемент во Вселенной (большинство звезд, в том числе и Солнце, состоит в основном из водорода)
- в атмосферах планет присутствует в форме Н 2 , CH 4 , NH 3 , Н 2 О, углеводородов.
- на поверхности Земли водород входит в состав соединений:
Н 2 O – вода
- один из компонентов всех природных органических соединений
(белки, жиры, углеводы)

История открытия водорода
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород
Роберт Бойль – англо-ирландский натурфилософ, физик, химик
(25 января 1627— 31 декабря 1691)

История открытия водорода
Генри Кавендиш – брит. физик и химик
(10 октября 1731 — 24 февраля 1810)
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой, «горючим воздухом».
Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода

История открытия водорода
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Жан Батист Мари Шарль Мёнье́ –
фр. математик
(19 июня 1754 — 13 июня 1793)
Антуан Лоран Лавуазье –
фр. естествоиспытатель
(26 августа 1743 — 8 мая 1794)

Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч.) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество»:
«Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.»
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Севергин Василий Михайлович
(1765—1826)
Соловьёв Михаил Фёдорович
(1785—1856)
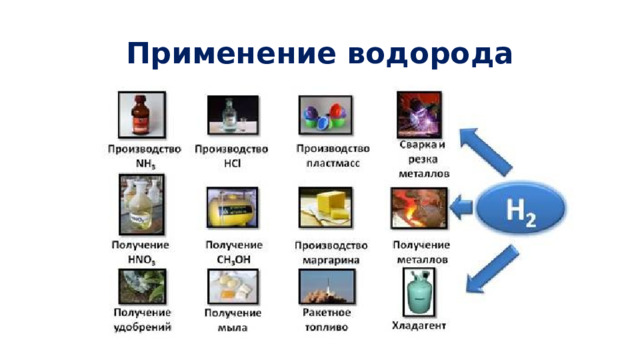
Применение водорода

Способы получения водорода
В промышленности:
(разложение под действием эл. тока)
2H 2 O → 2H 2 ↑ + O 2 ↑
http:// files.school-collection.edu.ru/dlrstore/17806d58-ddfb-3b84-450b-54137a483de4/index.htm
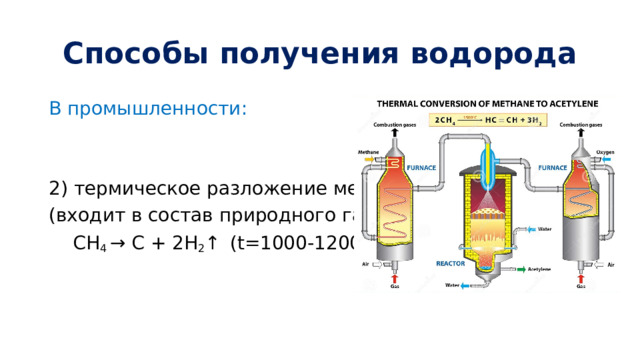
Способы получения водорода
В промышленности:
2) термическое разложение метана
(входит в состав природного газа)
CH 4 → C + 2H 2 ↑ (t=1000-1200°С)

Способы получения водорода
В лаборатории:
1) взаимодействие металлов (до H 2 в ряду активности металлов) с растворами кислот
Zn + H 2 SO 4 → ZnSO 4 + H 2 ↑
Fe + 2HCl → FeCl 2 + H 2 ↑
http:// files.school-collection.edu.ru/dlrstore/8dc8f4f8-0389-45f5-2fb6-08dcac38a308/index.htm

Способы получения водорода
В лаборатории:
2) электролиз воды
(разложение под действием эл. тока)
2H 2 O → 2H 2 ↑ + O 2 ↑
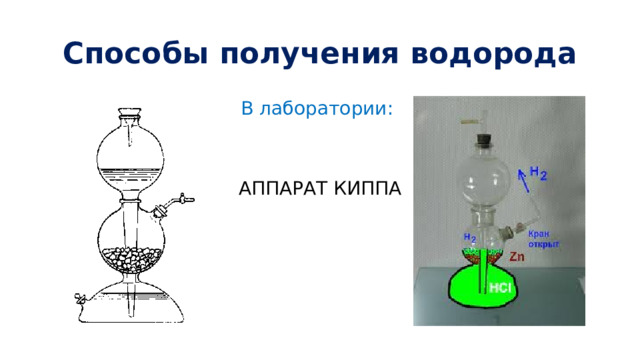
Способы получения водорода
В лаборатории:
АППАРАТ КИППА

Способы собирания водорода
вытеснением воды
метод основан на малой растворимости в воде

Способы собирания водорода
вытеснением воздуха
метод основан на том, что водород легче воздуха

Химические свойства водорода
- Взаимодействие с простыми веществами - неметаллами :
2H 2 + O 2 → 2H 2 O
водород + кислород = вода
Водород образует взрывоопасные смеси с кислородом и воздухом («гремучий газ»)

Химические свойства водорода
- Взаимодействие с простыми веществами - неметаллами :
2H 2 + C→ CH 4
водород + углерод = метан
H 2 + Cl 2 → 2HCl
водород + хлор = хлороводород
3H 2 + N 2 → 2NH 3
водород + азот = аммиак

Химические свойства водорода
2. Взаимодействие со сложными веществами :
Водород применяется в промышленности для получения металлов из их оксидов:
CuO + H 2 → Сu + H 2 O
https:// www.youtube.com/watch?v=elrodLWhyVo

Химические свойства водорода
При взаимодействии с простыми веществами-неметаллами и оксидами металлов водород проявляет свойства восстановителя .
Взаимодействие веществ с водородом называется восстановлением .

Домашнее задание
Домашний эксперимент по получению водорода
Реактивы и оборудование:
- железные гвоздики или скрепки, шурупы. (Важно! Они НЕ должны быть из нержавеющей стали, иначе опыт не получится. Это проверяется магнитом – если железки притягиваются к нему, они нам подойдут)
- столовый уксус (раствор уксусной кислоты)
- резиновые перчатки
- стакан

Домашнее задание
Домашний эксперимент по получению водорода
Ход работы:
В прозрачный стакан налить небольшое количество столового уксуса (2-3 см по высоте), поместить в него железные гвоздики или скрепки, шурупы. Работать в перчатках!
Через некоторое время вы увидите, что на поверхности появляются пузырьки газа.
Оформите отчет в виде рисунков с подписями и пояснениями. Ответьте на вопросы.
Что это за газ?
Возможно ли в домашних условиях собрать водород?
Можно ли доказать его? Насколько это безопасно?

Вода. Растворы.

Вода – самое распространенное вещество на Земле
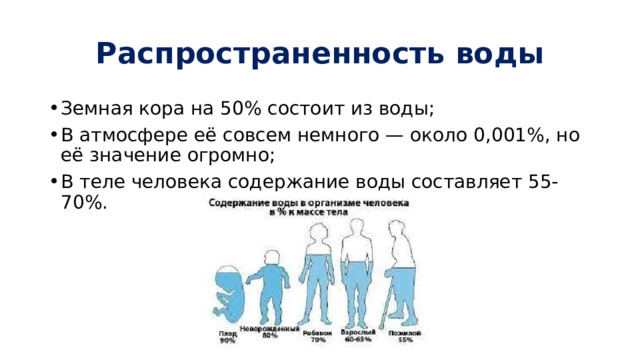
Распространенность воды
- Земная кора на 50% состоит из воды;
- В атмосфере её совсем немного — около 0,001%, но её значение огромно;
- В теле человека содержание воды составляет 55-70%.
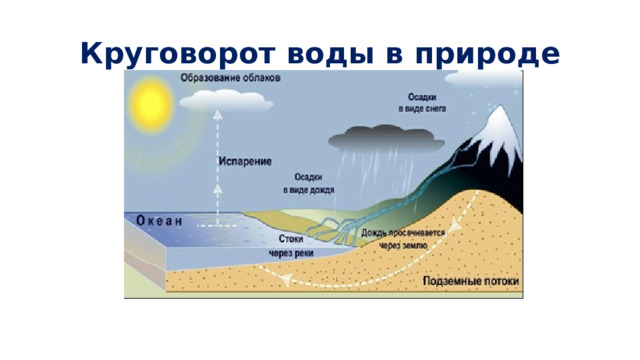
Круговорот воды в природе
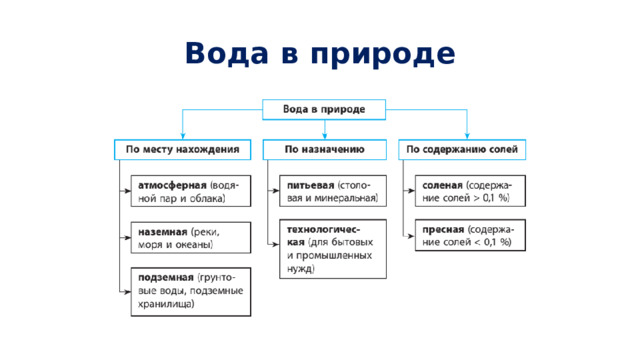
Вода в природе

Вода
- Химическая формула - H 2 O.
- Вода – сложное вещество молекулярного строения.
- M r (H 2 O) = 18
- M(H 2 O) = 18 г/моль

Физические свойства воды
- ρ(H 2 O) = 1 г/см 3 или 1 г/мл (при 4 ° С).
- При комнатной температуре вода находится в жидком состоянии — бесцветная жидкость, в толстом слое бледно-голубая. Чистая вода, не содержащая примесей, имеет слегка горьковатый вкус.
- При атмосферном давлении и температуре 0 ° С она превращается в лед, а при 100 ° С кипит.
- Чистая вода плохо проводит электрический ток и теплоту.
- При замерзании вода расширяется, так как плотность льда меньше плотности жидкой воды.
- Вода имеет высокую теплоемкость, т. е. медленно нагревается и медленно остывает. Поэтому вблизи морей и океанов климат значительно мягче, чем в центре континента: днем вода поглощает солнечное тепло, а ночью медленно его отдает, нагревая сушу.

Физические свойства воды
Некоторые совсем сухие на вид вещества в микротрещинах и на поверхности содержат небольшое количество воды. Например, высушенная на воздухе древесина содержит до 15 % воды. Для ее удаления древесину выдерживают в течение нескольких часов при температуре около 100 °С. Высушенные веществ рекомендуется хранить в плотно закрытых банках, пакетах из полиэтилена или плотной бумаги.
Вещества, поглощающие влагу из воздуха, называют гигроскопичными , а способность поглощать влагу называется гигроскопичностью .
Гигроскопичность характерна для поваренной соли и сахара.
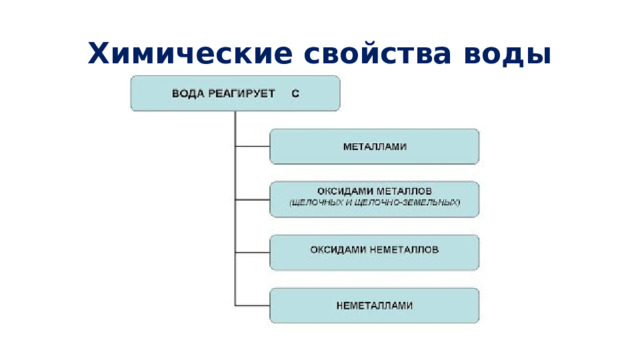
Химические свойства воды

Химические свойства воды
I. Взаимодействие с простыми веществами:

Химические свойства воды
I. Взаимодействие с простыми веществами:
1) металлами:
Химические свойства воды
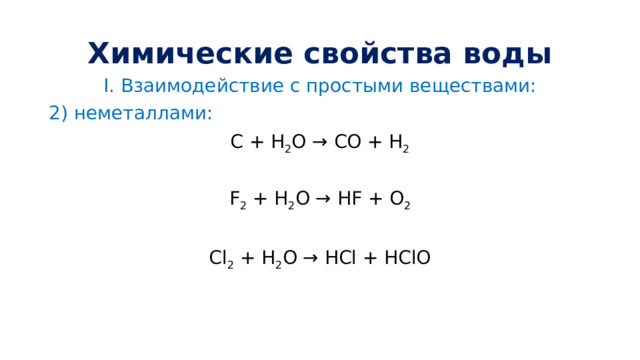
I. Взаимодействие с простыми веществами:
2) неметаллами:
С + Н 2 O → CO + Н 2
F 2 + Н 2 O → HF + O 2
Cl 2 + Н 2 O → HCl + HClO

Химические свойства воды
II. Взаимодействие со сложными веществами:
- оксидами металлов (IA и IIA групп ПС):
При этом образуются растворимые основания (щелочи).
Na 2 O + H 2 O → NaOH
CaO + H 2 O → Ca(OH) 2
CuO + H 2 O →

Химические свойства воды
Оксиды, которые растворяются в воде с образованием оснований, называются основными оксидами.
оксид кальция
(негашеная известь)
оксид натрия

Химические свойства воды
II. Взаимодействие со сложными веществами:
2) оксидами неметаллов :
При этом образуются кислоты.
SO 3 + H 2 O → H 2 SO 4
CO 2 + H 2 O → H 2 CO 3
P 2 O 5 + H 2 O → H 3 PO 4
SiO 2 + H 2 O →

Химические свойства воды
Оксиды, которые растворяются в воде с образованием кислот, называются кислотными оксидами.
оксид углерода (IV)
оксид серы (VI)
оксид фосфора (V)
оксид кремния (IV)

Химические свойства воды
II. Взаимодействие со сложными веществами:
3) кислотами:
При этом образуются гидраты.
H 2 SO 4 + nH 2 O → H 2 SO 4 ∙ nH 2 O + Q
4) солями:
При этом образуются кристаллогидраты.
CuSO 4 + 5H 2 O → CuSO 4 ∙ 5H 2 O
CaSO 4 + 2H 2 O → CaSO 4 ∙ 2H 2 O
Na 2 CO 3 + 10H 2 O → Na 2 CO 3 ∙ 10H 2 O

Выводы

Благодарю за внимание!



































































