
Он всюду и везде: В камне, в воздухе, в воде Он и в утренней росе И в небес голубизне…

Кислород
ВВЕНП. 5 класс

Кислород – химический элемент
Химический знак – О
Положение в ПСХЭ:
период II, группа VIА, порядковый номер 8
Кислород – неметалл
- входит в состав простых веществ:
- Кислорода – O 2
- Озона – O 3

Образование кислорода и озона в природе
Кислород образуется в результате фотосинтеза:
6СO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
Озон образуется из кислорода при грозе (при разряде молнии):
3O 2 → 2O 3

Кислород и озон
Явление существования простых веществ, образованных атомами одного и того же химического элемента, называется аллотропией
Вещества, образованные атомами одного химического элемента называются аллотропными модификациями или видоизменениями

Историческая справка
- Процессы горения и дыхания издавна привлекали внимание учёных. Первые указания на то, что не весь воздух, а лишь "активная" его часть поддерживает горение, обнаружены в китайских рукописях VIII в.
- Много позже Леонардо да Винчи (1452-1519) рассматривал воздух как смесь двух газов, лишь один из которых расходуется при горении и дыхании. Окончательное открытие двух главных составных частей воздуха - азота и кислорода , сделавшее эпоху в науке, произошло только в конце XVIII в.
- Поскольку кислород входит в состав кислот, Лавуазье назвал его oxygene, т. е. "образующий кислоты" (от греческого oxýs - кислый и gennáo - рождаю; отсюда и русское название "кислород").

Распространенность химического элемента кислорода в природе
- в земной коре (литосфере) – кислород составляет почти половину массы (первое место);
- в гидросфере – содержание кислорода составляет 89% массы;
- в атмосфере – на долю кислорода приходится 1/5 часть по объему;
- в биосфере – содержание кислорода составляет 65% от массы живых организмов.

Распространенность химического элемента кислорода в природе
Химический элемент кислород входит в состав сложных веществ:
- Воды – H 2 O
- Углекислого газа – CO 2
- Песка (кремнезема) – SiO 2
- Перекиси водорода – H 2 O 2
- Глюкозы – С 6 H 12 O 6
- Уксусной кислоты – CH 3 COOH
- Соды – Na 2 CO 3, NaHCO 3 (пищевая, питьевая или чайная сода)

Открытие кислорода

Физические свойства кислорода
Кислород:
- бесцветный газ;
- не имеет запаха;
- малорастворим в воде;
- жидкий кислород – голубого цвета, кристаллический (твердый) – синего;
- при t=-183°C превращается в жидкость, при t=-218°C затвердевает

Получение кислорода
В промышленности кислород получают из воздуха (ректификация).
Воздух представляет собой смесь различных газов, основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают.
Азот испаряется раньше кислорода. Жидкий кислород отделяют от испарившегося азота и хранят в стальных баллонах под высоким давлением.

Получение кислорода
В лаборатории кислород получают по реакциям разложения кислородсодержащих веществ:
1) Разложение воды под действием электрического тока
(электролиз воды)
2H 2 O → 2H 2 ↑ + O 2 ↑
https :// www.youtube.com/watch?v=kjS1BO3T6Ic

Получение кислорода
В лаборатории кислород получают по реакциям разложения кислородсодержащих веществ:
2) Разложение перманганата калия (марганцовки) при нагревании
2KMnO 4 → K 2 MnO 4 + MnO 2 + O 2 ↑
https:// www.youtube.com/watch?v=2H2Vo6pLrfY

Получение кислорода
В лаборатории кислород получают по реакциям разложения кислородсодержащих веществ:
3) Разложение пероксида (перекиси) водорода в присутствии катализатора
2H 2 O 2 → 2H 2 O↑ + O 2 ↑
https:// www.youtube.com/watch?v=7pfjmy3XAKo

Катализатор
Катализатор – это вещество, которое ускоряет химическую реакцию, но само в ходе нее не расходуется.
Биологические катализаторы называются ферментами .
Они необходимы для переваривания пищи, стимуляции деятельности головного мозга, протекания процессов энергообеспечения клеток, восстановления органов и тканей.
Функция каждого фермента уникальна, т. е. каждый активизирует только один биохимический процесс.

Способы собирания кислорода
Метод вытеснения воздуха
основан на том, что кислород немного тяжелее воздуха

Способы собирания кислорода
Метод вытеснения воды
основан на том, что кислород мало растворим в воде

Распознавание кислорода
Кислород – газ, который поддерживает горение .
Распознать или доказать кислород можно с помощью тлеющей лучинки.
В присутствии кислорода тлеющая лучинка ярко вспыхивает .

Химические свойства кислорода
Многие вещества горят в кислороде.
При этом образуются оксиды .
Оксиды – это сложные вещества, которые состоят из двух элементов, один из которых обязательно кислород.
2H 2 + O 2 → 2H 2 O
водород + кислород = оксид водорода (вода)

Химические свойства кислорода
Горение простых веществ неметаллов в кислороде:
C + O 2 → CO 2
уголь + кислород = оксид углерода (углекислый газ)
https:// www.youtube.com/watch?v=urSRLHsZRrM
S + O 2 → SO 2
сера + кислород = оксид серы (сернистый газ)
https:// www.youtube.com/watch?v=2JAGpzXN370

Химические свойства кислорода
Горение простых веществ металлов в кислороде:
3Fe + 2O 2 → Fe 3 O 4
железо + кислород = оксид железа (железная окалина)
https:// www.youtube.com/watch?v=o9Rvc3Vae_c
2Cu + O 2 → 2СuO
медь + кислород = оксид меди

Химические свойства кислорода
Горение сложных веществ в кислороде:
СH 4 + 2O 2 → CO 2 + 2H 2 O
Метан + кислород = углекислый газ и вода
(компонент природного газа)
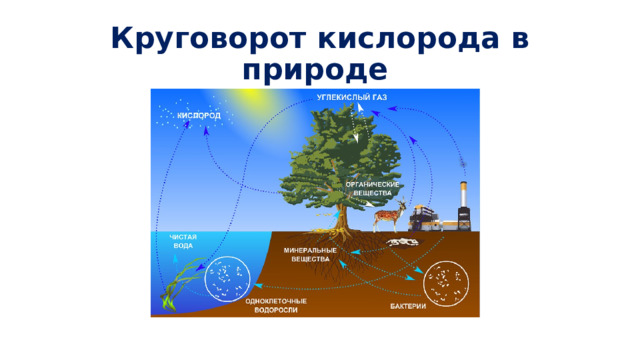
Круговорот кислорода в природе

Домашнее задание

Благодарю за внимание! Новых открытий и успехов в познании мира веществ!

















































