
8 класс

соль

Как по химической номенклатуре назвать соль?
Какие атомы входят в состав вещества?

Натрий и Хлор
Какой состав имеет молекула соли?
Предложите свою формулу вещества

Проблема :
Как правильно записать формулу вещества?
Цель :
Чему мы должны научиться на уроке?
Тема урока :

Как достигнем цели :
- 4. выполнить упражнения;
- 3. узнать правила составления формул;
- 2. вспомнить о валентности; узнать об ее числовых характеристиках;
- 1. вспомнить знаки химических элементов.
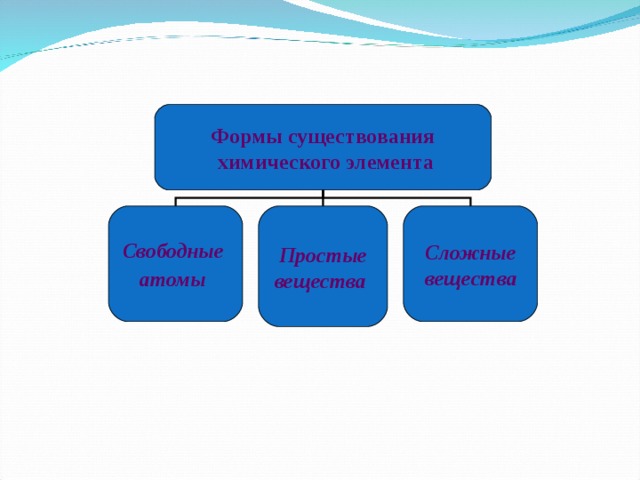
Формы существования
химического элемента
Свободные
атомы
Простые
вещества
Сложные
вещества
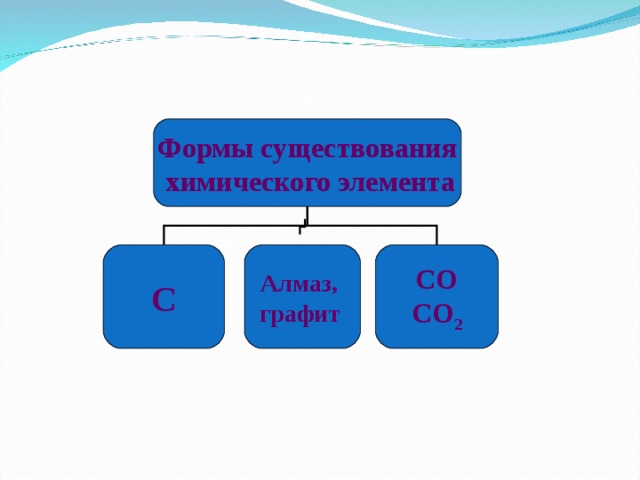
Формы существования
химического элемента
С
Алмаз,
графит
СО
СО 2

1.Что называется валентностью?

Важно знать!
- Число связей, в которых атом может принимать участие в молекуле называется валентностью.
- Валентные электроны расположены на внешнем энергетическом уровне.
- В образовании связей участвуют электроны внешнего слоя и неспаренные электроны.

Важно знать!
- Способность атомов связываться друг с другом- это валентность.
- Эта способность имеет числовые характеристики: число связей, степень окисления, заряды ионов.


Степень окисления
- Степень окисления (с.о.)- это условный заряд, который мог бы возникнуть на атоме при условии, что все общие электронные пары смещены к более электроотрицательному элементу.
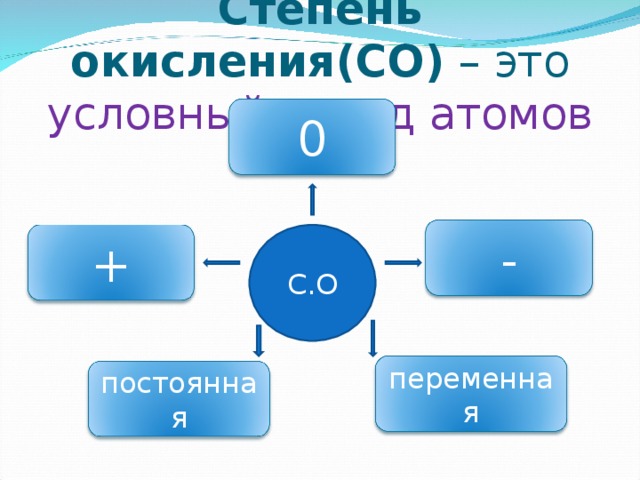
Степень окисления(СО) – это условный заряд атомов
0
-
С.О
+
Определение С.О., запись в тетрадях.
переменная
постоянная
14
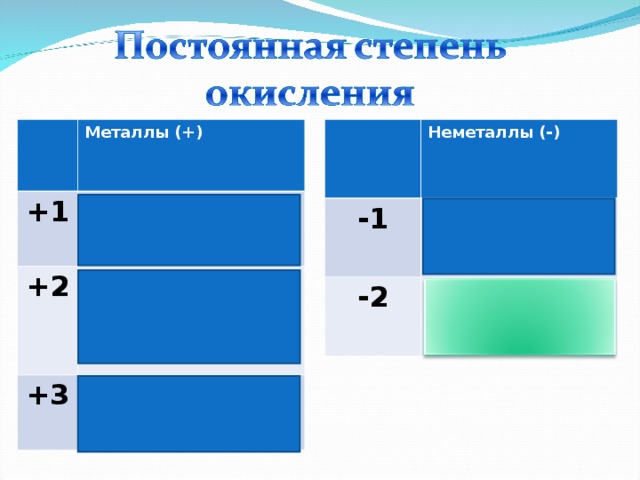
Неметаллы (-)
+1
Металлы (+)
-1
F
Li, Na, K, Rb, Cs, Ag
+2
-2
+3
Be, Mg, Ca, Sr, Ba, Zn
O
Al
Постоянная С.О., запись в тетрадях.
15

Металлы (+)
+1, +2
Cu, Hg
+2, +3
Fe, Co, Ni
+2, +3, +6
Cr, Mo
Неметаллы (-)
-1, +1
H
-4, +2, +4
C, Si
-3, +3, +5
N, P, As
-1, +1, +3, +5, +7
Cl, Br, I
-2, +4, +6
S, Se, Te
Переменная С.О., запись в тетрадях.

Высшую « + »
положительную СО = N ° группы
Низшую « - » отрицательную СО находят по формуле ( N ° группы элемента - 8)
Промежуточную СО
Выводы , обобщения о С.О. Неметаллов. Запись в тетрадях.

Например: элемент азот может иметь следующие степени окисления
Низшая отрица-тельная СО
Промежуточная СО
-3
N Н 3
-2
-1
N 2 Н 4
0
N Н 2 ОН
+1
N 2
+2
N 2 О
+3
N О
Высшая положи-тельная СО
+4
N 2 О 3
+5
N О 2
HN О 3
Ознакомление со С.О. азота(исключение из общего правила)

Сравнение понятий валентность и степень окисления
Валентность
Н I
О II
Са II
А l III
С II, I V
Степень окисления
Н +1 , -1
О -2
Са +2
А l +3
С +2, +4 , -4
CI ? ? ? ? ?

Правила определения степеней окисления
- У свободных атомов и у простых веществ СТЕПЕНЬ ОКИСЛЕНИЯ равна 0
- Металлы во всех соединениях имеют ПОЛОЖИТЕЛЬНУЮ С.О.
- В соединениях кислород имеет С.О.-2
(кроме Н 2 О 2 , К 2 О 2 , О F 2 )
- В соединениях с неметаллами у водорода С.О.+1, а с металлами -1
- В соединениях сумма всех С.О. равна 0

Любая молекула (формула ) - электронейтральна, поэтому алгебраическая сумма С.О. всех атомов в молекуле = 0
степени окисления записывают над символами элементов со знаком «+» или «-» перед их величинами .
Э с отрицательной С.О. обычно находится на последнем месте в формуле.
Запись в тетрадях.
Условные обозначения : Э - элемент
С.О. – степень окисления

Определение С.О. в бинарных соединениях
- Определить постоянную С.О. у второго элемента (более ЭО, знак С.О. «минус»
- Перемножить С.О. на индекс у второго элемента
- Полученное число делим на индекс первого элемента
- Найденное значение С.О. записать над первым элементом, со знаком «плюс»
Алгоритм определения С.О. в сложных веществах.
22
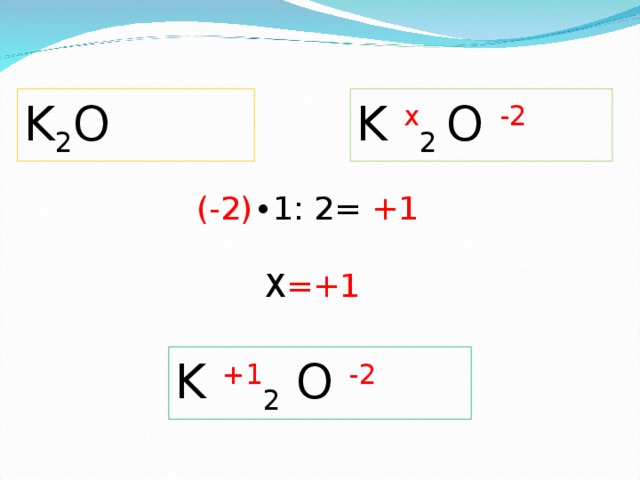
K 2 O
K x 2 O -2
(-2) ∙1: 2= +1
Х = +1
Пример определения С.О., запись в тетрадях.
K + 1 2 O -2
22

Определение степени окисления элементов в соединениях
+3 х А l С l 3
(+3)*1 + х *3 = 0;
+3 = - 3 х
Х = -1
+3 -1
А l С l 3

Определение С.О. в сложных веществах
- Определить постоянную С.О.
- Перемножить С.О. и индекс у каждого элемента
- Составить уравнение с одним неизвестным и приравнять к нулю
- Найденное значение С.О. записать над соответствующем элементом.
Алгоритм определения С.О. в сложных веществах.
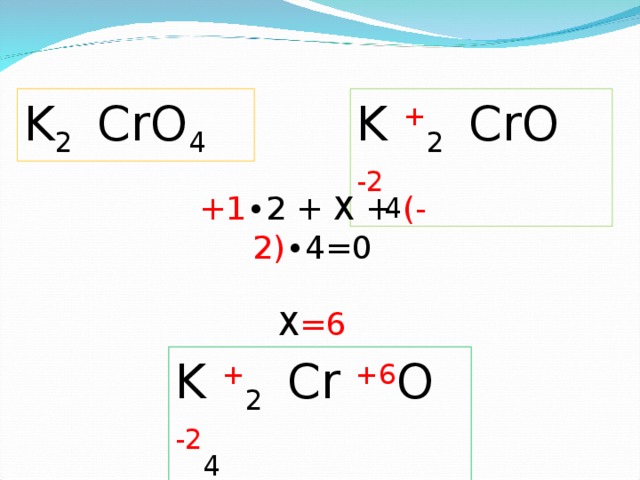
K 2 CrO 4
K + 2 CrO -2 4
+1 ∙2 + Х + (-2) ∙4=0
Х =6
Пример определения С.О., запись в тетрадях.
K + 2 Cr +6 O -2 4
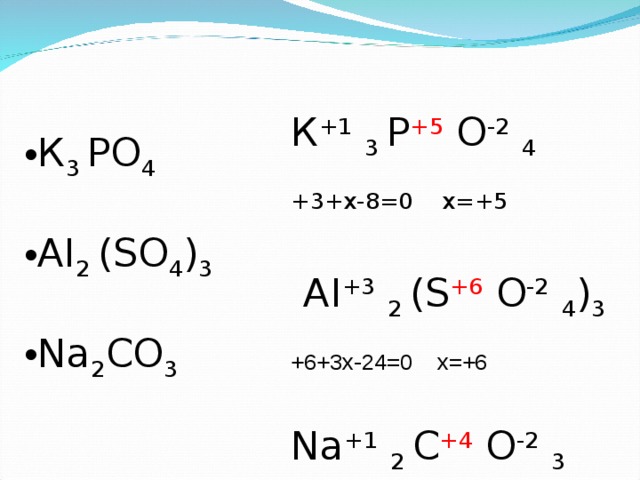
К +1 3 Р +5 О -2 4
+3+х-8=0 х=+5
А I +3 2 ( S +6 O -2 4 ) 3 +6+3х-24=0 х=+6
Na +1 2 C +4 O -2 3
+2+х-6=0 х=+4
Самостоятельная работа по колонкам в парах. Проверка: желающие проговаривают решение, затем запись появляется на экране.

Определить степени окисления:
1. Элементов в простых веществах: Н 2 , Ва, N 2 , S , AI , Cu , F
2. Металлов в веществах: К 2 О, CaCO 3 , AlCl 3 , Li 3 N , BaSO 4 , MgSO 4
3 . Кислорода в веществах: Н 2 CO 3 , К 2 О, CuSO 4 , NaOH , SO 3
4. Водорода в веществах: HCl , КН, КОН, Ba Н 2 , Н 2 SO 4 , N Н 3

Самостоятельная работа
1. Н 2 0 , Ва 0 , N 2 0 , S 0 , AI 0 , Cu 0 , F 0
2. К 2 +1 О, Ca +2 CO 3 , Al +3 Cl 3 ,
Li 3 +1 N , Ba +2 SO 4 , Mg +2 SO 4
3 . Н 2 CO -2 3 , К 2 О -2 , CuSO 4 -2 ,
NaO -2 H , SO -2 3
4. H +1 Cl , КН -1 , КОН +1 , Ba Н 2 -1 ,
Н 2 +1 SO 4 , N Н 3 +1

Самостоятельная работа
Критерии оценки:
«5»- 21-24 формулы
«4»-17-20 формул
«3»-12-16 формул
«2»-менее 12 формул

Рефлексия:
- 1. Достигнута ли цель урока?
- 2. Запишите формулу вещества, состоящего из атомов Na и CI , почему формула записывается именно так?

- «Соль земли» в поте пахаря, крови воинов и слезах вдов.
- «Соль жизни» выступает на сединах стариков.
- Дайте ответ на вопрос:
- В чем « Соль урока ?»

Домашнее задание
- 1. § 43 по учебнику Рудзитиса Г.Е., Фельдмана Ф.Г. «Химия 8»
- 2. Определить степень окисления марганца в соединениях: MnO 2 , K 2 MnO 4 , KMnO 4 , Mn(OH) 2
























































