Тема: Реакции ионного обмена
Тип урока: урок закрепления изученного материала.
Цель урока:
закрепить и расширить знания об особенностях и условиях протекания реакций ионного обмена, закрепить умения составлять ионные уравнения, формировать умение предвидеть вероятность протекания реакций в растворах, развивать и мыслить творчески и нестандартно. Формировать учебно-познавательные, информационные, коммуникативные компетентности.
Задачи:
- совершенствовать навыки составления полных и сокращенных ионных уравнений реакций.
- продолжать формировать умение анализировать полученную информацию, применять при высказывании суждений ранее полученные знания,
- совершенствовать навыки решения практических задач;
- воспитывать у учащихся организованность, самостоятельность, способствовать развитию безопасного и аккуратного выполнения химических опытов и бережного отношения к окружающей среде.
Реактивы и оборудование:
растворы CuSO 4; NaOH; HCl; Na2CO3, пробирки.
Ход урока.
І. Организационный момент.
Эмоциональный настрой класса.
Упражнение «Улыбка».
Выберите смайлик, характеризующий ваше настроение перед уроком.




Американский психолог Дейл Карнеги в своей книге «Как приобретать друзей и оказывать влияние на людей» описывает множество разных эмоций. Вот описание одной из них:
«Она ничего не стоит, но много дает.
Она обогащает тех, кто ее получает, не обедняя при этом тех, кто ею одаривает.
Она длится мгновение, а в памяти остается порой навсегда.
Она - отдохновение для уставших, дневной свет для тех, кто пал духом, солнечный луч для опечаленных, а также лучшее противоядие, созданное природой от неприятностей.
И, тем не менее, ее нельзя купить, нельзя выпросить, нельзя ни одолжить, ни украсть, поскольку она сама по себе ни на что не годится, пока ее не отдали".
Вы догадались о чем речь? Тогда подарите ее мне. Да, это улыбка. Именно она может сгладить любой конфликт, поднимает настроение тем, кто ее получил, и тем, кто ее подарил.
Подарите друг другу улыбку и пронесите ее через весь урок.
Такие счастливые, мы сейчас напишем химический диктант и заработаем хорошие оценки.
II. Актуализация опорных знаний.
Химический диктант («Да», «Нет»). Самоконтроль, взаимоконтроль. Вопросы выводятся на экран через проектор.
| № | Утверждение | Ответ |
| Электролиты - вещества, растворы или расплавы которых проводят электрический ток | Да |
| Неэлектролиты - вещества, которые в кристаллическом виде не проводят электрический ток | Нет |
| К электролитам относятся вещества с неполярными или слабополярными связями | Нет |
| К электролитам относятся растворимые соединения соли, кислоты, основания | Да |
| Свойства водных растворов электролитов определяются свойствами ионов | Да |
| Электролитической диссоциацией называется процесс распада вещества на молекулы при растворении в воде | Нет |
| С точки зрения теории электролитической диссоциации основания-электролиты, которые диссоциируют на катионы металла и гидроксид анионы | Да |
| Общие свойства кислот обуславливают катионы кислотных остатков | Нет |
| Соль – электролит, который диссоциирует на катионы кислотного остатка и анионы металла | Нет |
| Слабые электролиты – это электролиты, которые практически полностью распадаются в водном растворе на ионы | Нет |
| Сильные электролиты имеют степень диссоциации больше 30% | Да |
| К сильным электролитам относятся все хорошо растворимые соли, некоторые кислоты и все растворимые в воде основания | Да |
Критерии оценивания:
«5» - 12-11 правильных ответов
«4» - 9-10 правильных ответов
«3» - 7-8 правильных ответов
Фронтальный опрос:
Задание № 1. «Закончите предложение одним словом». (По цепочке на местах заканчивают предложение).
1. Положительно заряженный электрод - …(анод).
2. Отрицательно заряженный электрод - …(катод).
3. Направленное движение заряженных частиц - …(электрический ток).
4. Положительно заряженные частицы -…(катионы).
5. Отрицательно заряженные частицы -…(анионы).
6. Вещества, водные растворы или расплавы которых проводят электрический ток -…(электролиты).
7. Вещества, водные растворы или расплавы которых не проводят электрический ток -…(неэлектролиты).
8. Процесс распада электролита на ионы при растворении или расплавлении вещества -…(диссоциация).
9. Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями – ….(ионные)
10. Заряженные частицы, которые отличаются от атомов числом электронов ...(ионы)
11. На какие ионы распадаются при электролитической диссоциации кислоты… (ионы водорода и ионы кислотного остатка)
12. На какие ионы распадаются при электролитической диссоциации растворимые основания?... (ионы металла и ионы ОН-1 групп)
13. На какие ионы распадаются при электролитической диссоциации соли? …(ионы металла и ионы кислотного остатка)
Задание № 2 «Куча мала». На доске беспорядочно записаны формулы ионов.
Ca2+; K+; CI-; Mg2+; SO42-; CO32-; Fe3+; OH-
Разложите их по двум папкам с названием «КАТИОНЫ» и «АНИОНЫ». Дайте названия всем ионам. К доске приглашается один учащийся. Проверяем правильность выполнения.
III. Мотивация учебной деятельности учащихся.
О чем же мы сегодня будем говорить? Ответы детей. Давайте сформулируем тему нашего урока. Тема нашего урока «Реакции ионного обмена». (запишите тему урока в тетрадях).
Реакции ионного обмена определяют здоровье каждого из нас. Они протекают ежеминутно, ежесекундно в наших организмах, осуществляя процессы метаболизма и обмена веществ.
Каждый из вас пройдет путь ученого экспериментатора, но в миниатюре. Формулируя научную гипотезу (при каких условиях реакции ионного обмена идут до конца), вы ее потом подтвердите опытным путем. Мы с вами вспомним алгоритм составления полных и сокращенных уравнений ионного обмена.
IV. Практическая часть
Ребята, а теперь давайте с вами проведем небольшой химический эксперимент.
Повторим технику безопасности.
Правила по технике безопасности при проведении химических опытов:
1. Наливать вещества можно только над специальным лотком.
2. Для опыта следует брать небольшое количество вещества.
3. При попадании на кожу растворов кислот или щелочей необходимо смыть их под сильной струей холодной воды.
4. При проведении эксперимента отложить на край стола тетради и учебники.
Учащиеся выполняют химический эксперимент по группам, пользуясь инструктивными карточками. В группах отвечают на вопросы, оформляют работу. После выступают с отчетом перед остальными учащимися.
Лабораторный эксперимент№1: Реакции, идущие с образованием нерастворимого вещества.
Сливаем раствор сульфата меди (голубого цвета) и прозрачный гидроксид натрия.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH- → Cu(OH)2 + 2Na+ + SO42-
Cu2+ +2OH- → Cu(OH)2
Беседа по вопросам:
Какое вещество выпало в осадок? (Ответ: гидрооксид меди)
Какого цвета осадок?
Составьте уравнение реакции в молекулярном виде.
Составьте уравнение реакции в полном ионном виде.
Составьте уравнение реакции в сокращенном ионном виде.
Оформление отчета о проделанном опыте.
Лабораторный эксперимент№2: Реакции, идущие с образованием газа.
Задание: Проведем реакцию ионного обмена карбоната натрия Na2CO3 с соляной кислотой HCl.
Напишите уравнение реакции в молекулярном, ионном и сокращенном ионном виде.
Na 2CO 3+2HCL = 2NACL+H 2O + CO2
2Na+ + CO3 2- + 2H+ + 2CL - = 2Na+ + CL- + H2O + CO2
CO 3 2- + 2H+ = H2O + CO 2
Беседа по вопросам:
1. Какой газ образовался? (Ответ: оксид углерода (IV)
2. Составьте уравнение реакции в молекулярном виде.
3. Составьте уравнение реакции в полном ионном виде.
4. Составьте уравнение реакции в сокращенном ионном виде.
Оформление отчета о проделанном опыте.
Лабораторный эксперимент№3: Реакции, идущие с образованием малодиссоциирующего вещества.
Взаимодействие гидроксида натрия с соляной кислотой.
NaOH + HCl = NaCl + H2O;
Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O,
OH– + H+ = H2O;
Беседа по вопросам:
1. Какое малодиссоциирующее вещество образовалось? (Ответ: вода)
2. Составьте уравнение реакции в молекулярном виде.
3. Составьте уравнение реакции в полном ионном виде.
4. Составьте уравнение реакции в сокращенном ионном виде.
Оформление отчета о проделанном опыте.
Выступления учащихся.
Итоги пройденной темы:
1. Реакции ионного обмена необратимы, если выпадает осадок, выделяется газ и образуется малодиссоциирующее вщество – например, вода.
2. Во всех остальных случаях реакции ионного обратимы и значит в них устанавливается химическое равновесие.
3. Все реакции протекающие с образованием химического равновесия подвержены влиянию внешних факторов: температуре, концентрации, давлению и другим факторам.
Физкультминутка
Давайте немного с вами отдохнем. На мои предложения вы хлопаете в ладоши, если ответ положительный, и топаете ногами, если ответ отрицательный.
1. Реакции ионного обмена необратимы, если меняется окраска раствора. (-)
2. Реакции ионного обмена необратимы, если выпадает осадок.(+)
3. Раствор сахара является сильным электролитом. (-)
4. Реакции ионного обмена необратимы, если выделяется газ. (+)
5. Раствор хлорида натрия проводит электрический ток (+)
Молодцы. А сейчас глазами нарисуйте 3 круга по часовой стрелке и 3 круга против часовой стрелке. Ну что немного отдохнули, продолжаем дальше работать.
V. Закрепление и углубление знаний
Для отработки навыков составления уравнений в молекулярном, полном ионном и сокращённом ионном виде - самостоятельная работа. На «3» - первое задание, на «4» - первое и второе задание, на «5» - все задания.
Самостоятельная работа по теме: «Реакции ионного обмена»
Вариант 1.
1.Напишите уравнения диссоциации следующих веществ:
Na2CO3=
AlCl3=
Ba(OH)2=
H2SO3=
2.Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде. Укажите реакцию, которая не идет в растворе, объясните почему?
а) NaOH + H3PO4=
б) Na2CO3 + H2SO4=
в) NaOH + Ba(NO3)2=
г) AgNO3 + HCl=
3. Напишите возможные полные ионные и молекулярные уравнения реакций, для которых имеются следующие сокращенные ионные уравнения.
Ba 2+ + SO42-= BaSO4
2+ + SO42-= BaSO4
___________________________________________________________________
Самостоятельная работа по теме: «Реакции ионного обмена»
Вариант 2.
1.Напишите уравнения диссоциации следующих веществ:
Ba(NO3)2=
HNO3=
NaOH=
K2CO3=
2.Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде. Укажите реакцию, которая не идет в растворе, объясните почему?
а) KOH + BaSO4=
б) NaOH + H2S=
в) AlCl3 + KOH=
г) MgCl2+NaOH=
3. Напишите возможные полные ионные и молекулярные уравнения реакций, для которых имеются следующие сокращенные ионные уравнения.
Ag + + Cl- = AgCl
+ + Cl- = AgCl
__________________________________________________________________
Самостоятельная работа по теме: «Реакции ионного обмена»
Вариант 3.
1.Напишите уравнения диссоциации следующих веществ:
Al(NO3)3=
Li2SO4=
KOH=
Na3PO4=
2.Напишите у равнения следующих реакций в молекулярном, полном ионном и сокращенном ионном виде. Укажите реакцию, которая не идет в растворе, объясните почему?
а) Na2SO4+ BaCl2=
б) NaOH + FeCl3=
в) CuCl2 + H2SO4=
г) CuSO4+NaOH=
3. Напишите возможные полные ионные и молекулярные уравнения реакций, для которых имеются следующие сокращенные ионные уравнения.
H+ + OH- = H2O
Дополнительное задание кроссворд.
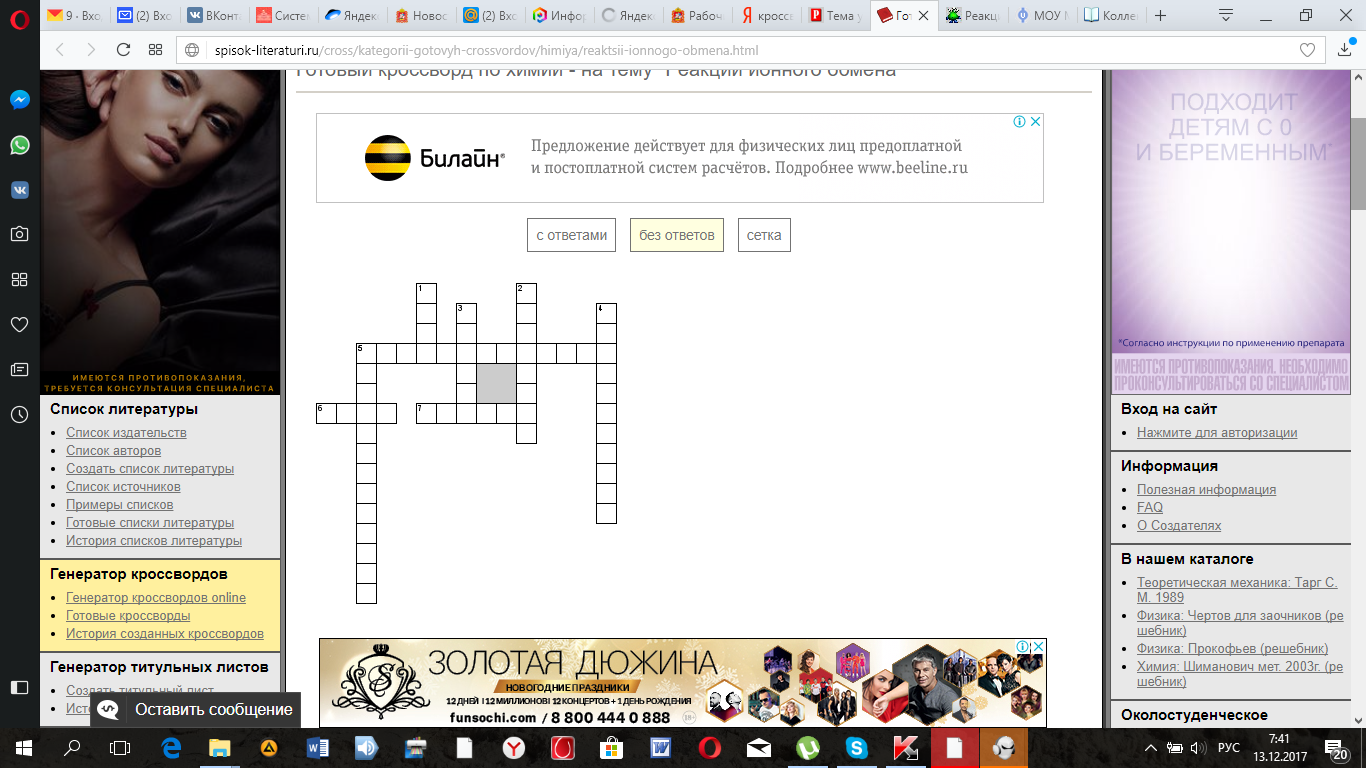
По горизонтали
5. Какие вещества не раскладывают на ионы
6. Сложное вещество, по химическому строению сходное с кислотой, в которой атом (или несколько атомов) водорода заменены на атом (или атомы) металла
7. Между чем происходят реакции в результате которых выделяется газ, образуется осадок или слабо дисоциирующее вещество, образуется вода.
По вертикали
1. Малодиссоциирующее вещество
2. Процесс разложения водой веществ, составные части которых после разложения соединяются с частями воды.
3. Положительно заряженный ион
4. Жидкие или твёрдые вещества и системы, в которых присутствуют в сколько-нибудь заметной концентрации ионы, обусловливающие прохождение электрического тока.
5. Вещества, растворы которых не проводят электрический ток.
VI. Домашнее задание стр. 92 упр. 3
VII. Рефлексия.
Продолжите фразы:
1.На уроке я работал….
2.Своей работой на уроке я….
3.Урок для меня показался….
4.За урок я….
5.Мое настроение…..
6.Материал урока мне был…..
7.Домашнее задание мне кажется …..
7






























