
Государственное общеобразовательное казенное учреждение Иркутской области «Специальная (коррекционная) школа-интернат для обучающихся с нарушениями опорно - двигательного аппарата № 20 г. Иркутска»
ТЕМА УРОКА: «СТЕПЕНЬ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ» Учитель: Семенова Надежда Владимировна

Я рада нашей новой встрече, Мне с вами интересно, друзья! Интересные ваши ответы С удовольствием слушаю я. Мы сегодня будем наблюдать, Выводы делать и рассуждать. А чтобы урок пошел каждому впрок, Активно в работу включайся, дружок!

Степень окисления

Химический словарь: Атом протон электрон Ионы катионы анионы Вале́нтность

Атом — электронейтральная частица. Положительный заряд ядра ( протоны - р+) компенсируется отрицательным зарядом электронов ( ē ) п ( р+) протонов = п ( ē )электронов п( р+) + п (ē) = 0 п – количество частиц

Ионы – это частицы, образовавшиеся из атомов химических элементов в результате отдачи - ē или присоединения + ē Положительно(+) заряженные ионы называются катионами Li + , Mg 2+ , Ca 2+ , Mn 3+ , Pb 4+ , NH 4 + отрицательно(-) заряженные ионы анионами F - , Cl - , Br - , I - , O 2- , S 2- , N 3- , P 3- SO 4 2- , SO 3 2- , NO 3 - , NO 2 - , PO 4 3 -
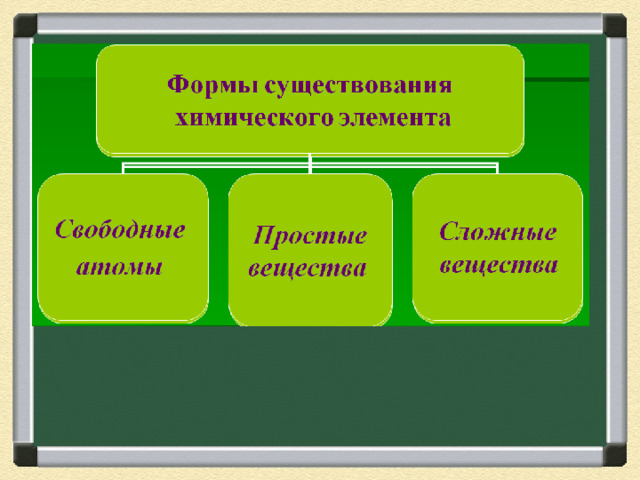

Почему такой состав имеют молекулы азота, воды, соли?
NaCl
Н 2 О
N 2

Задачи урока:
1. Выяснить, от чего зависит состав сложных веществ;
2.Что необходимо знать, чтобы составить формулы веществ .

Самостоятельная работа в группах

Задание 1 группе: Почему такой состав имеет молекула азота – N 2 ? Составьте: А) схемы строения атомов азота Б) схему образования химической связи в азота; В) структурную формулу азота.

Задание 2 группе: Почему такой состав имеет молекула воды - Н 2 О ? Составьте: А) схемы строения атомов водорода и кислорода; Б) схему образования химической связи в молекуле воды; В) структурную формулу молекулы воды.

Задание 3 группе: Почему такой состав имеет молекула соли - NaCl ? Составьте: А) схемы строения атомов натрия и хлора; Б) схему образования химической связи в молекуле соли; В) структурную формулу молекулы соли.

Ответить на вопросы:
1.Как называется способность атомов образовывать связи с другими атомами?
2.Какие электроны называются валентными?
3. От чего зависит образование связей в молекулах веществ?


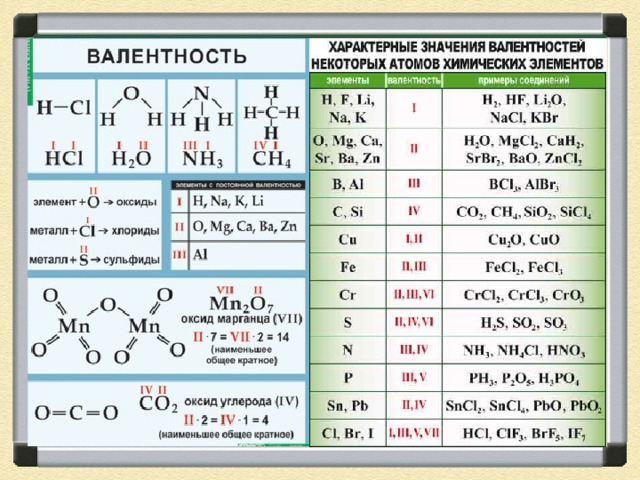
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов одного элемента присоединять или замещать определённое число атомов других элементов .
В ковалентных соединениях (а их большинство) Вале́нтность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.

Валентность обозначается римскими цифрами сверху символа химического элемента входящего в молекулу вещества:
II
I
Fe
IV
Cu
S
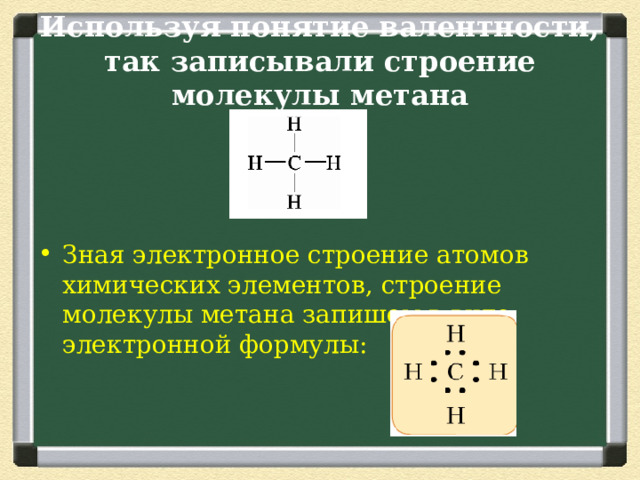
Используя понятие валентности, так записывали строение молекулы метана
- Зная электронное строение атомов химических элементов, строение молекулы метана запишем в виде электронной формулы:
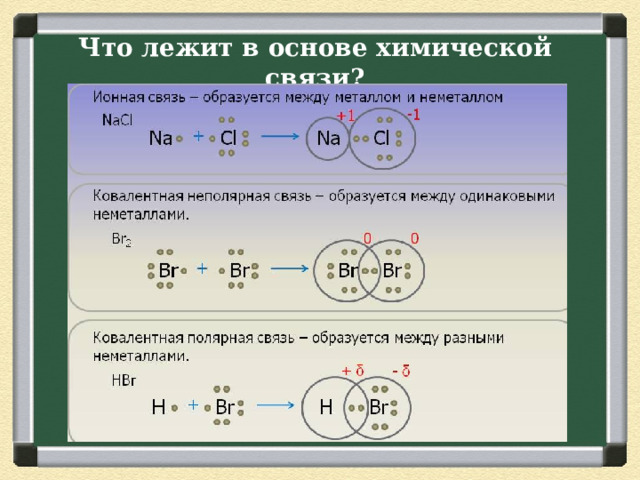
Что лежит в основе химической связи?

3
Выводы:
1.Число связей, в которых атом может принимать участие в молекуле называется валентностью.
2. Валентные электроны расположены на внешнем энергетическом уровне.
3. В образовании связей участвуют электроны внешнего слоя и неспаренные электроны.

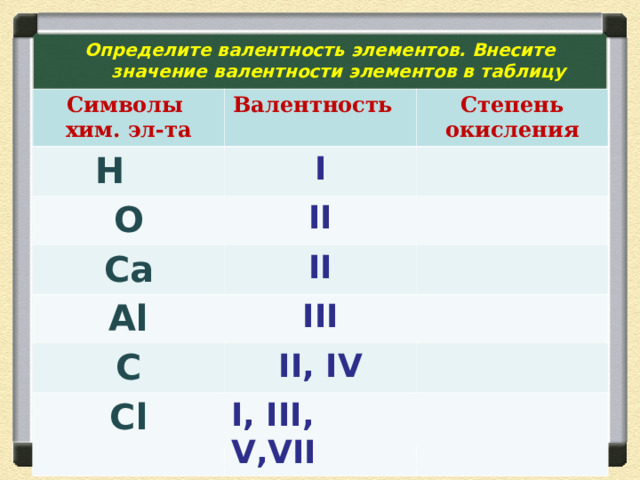
Определите валентность элементов. Внесите значение валентности элементов в таблицу
Символы хим. эл-та
Валентность
Н
Степень окисления
O
Ca
Al
C
Cl
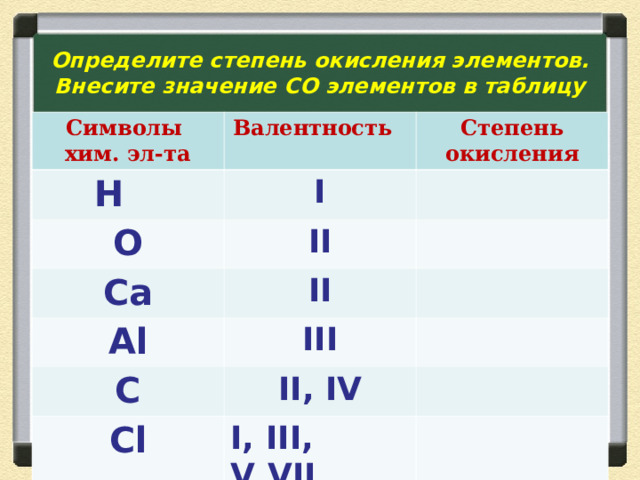
Определите валентность элементов. Внесите значение валентности элементов в таблицу
Символы хим. эл-та
Валентность
Н
Степень окисления
I
O
II
Ca
II
Al
III
C
II, IV
Cl
I, III, V , V II
Определите степень окисления элементов. Внесите значение СО элементов в таблицу
Символы хим. эл-та
Валентность
Н
Степень окисления
I
O
II
Ca
II
Al
III
C
II, IV
Cl
I, III, V , V II
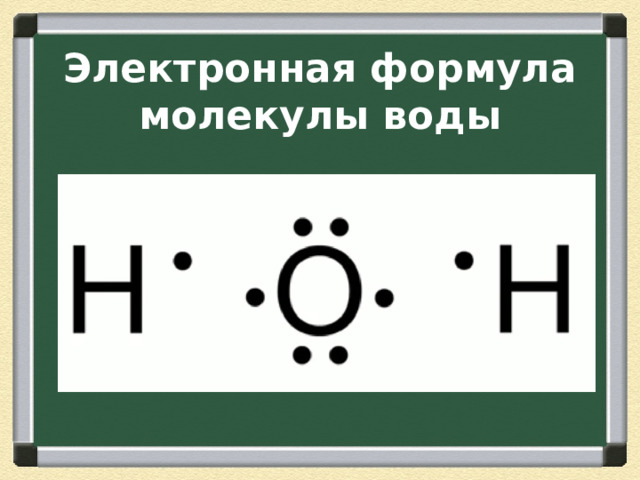
Электронная формула молекулы воды
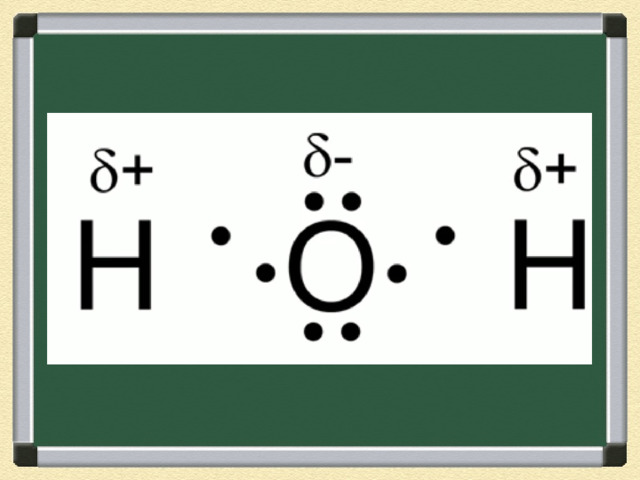


Степени окисления атомов в молекуле воды

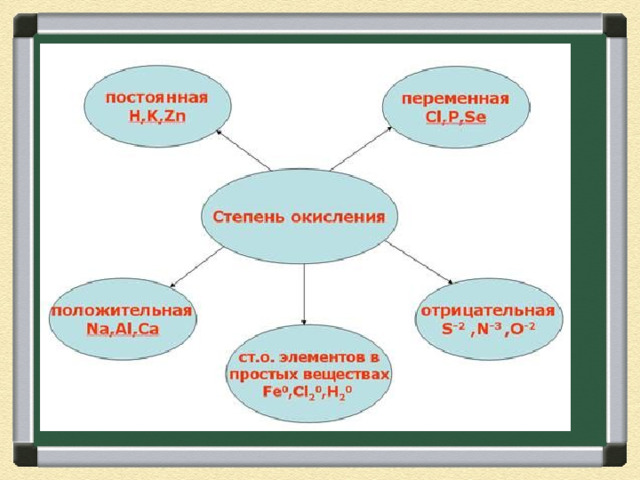
Степень окисления – это условный заряд атомов элементов в молекуле , если считать, что молекула состоит из ионов.
- Степень окисления атома в отличие от валентности имеет знак. Она может быть положительной, отрицательной и нулевой.
Fe 0 , N а +1 , М g +2 , Са +2 , CIˉ¹, O - 2 ,

Степень окисления является важной характеристикой состояния атома в молекуле
- В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равна 0 .
- Н 2 0 , СI 2 0 , F 2 0 , S 0 , AI 0

Внимание: Степень окисления обозначают, как правило, арабской цифрой со знаком, причем знак заряда ставится перед цифрой
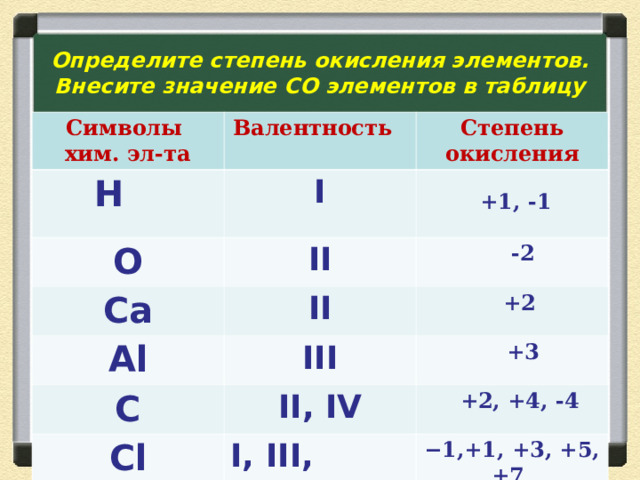
Определите степень окисления элементов. Внесите значение СО элементов в таблицу
Символы хим. эл-та
Валентность
Н
Степень окисления
I
O
II
+1, -1
Ca
Al
II
-2
III
+2
C
+3
II, IV
Cl
I, III, V , V II
+2, +4, -4
− 1,+1, +3, +5, +7


Рассмотрим строение атомов хлора и натрия: - Что можно сказать о завершённости внешнего уровня атомов хлора и натрия? - Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Cl +17 )2 ē )8 ē )7 ē Na +11 )2ē)8ē)1ē

Cl 0 + 1ē → Cl -1 атом анион (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион ) Na 0 – 1ē → Na +1 атом катион (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион )

- Процесс отдачи электронов атомом,
называется
окислением .
2. Процесс принятия электронов атомом,
называется
восстановлением .
- Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется
восстановителем .
- Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется
окислителем .

Правила определения степени окисления атома в ПСХЭ Д.И. Менделеева: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me +n H n -1 ) 2. Кислород обычно проявляет СО -2 (исключения: О +2 F 2 , H 2 O 2 -1 – перекись водорода) 3. Металлы проявляют только +n положительную СО 4. Фтор проявляет всегда СО равную -1 (F -1 ) 5. Для элементов главных подгрупп : Высшая СО (+) = номеру группы N группы Низшая СО (-) = N группы –8

Элемент
Период, группа
М g
S
Электронное строение атома
3 период,
II группа
Движение электронов
3 период,
VI группа
М g 12
+12 ) 2 ) 8 ) 2 ) 2 ) 8 ) 2
3 S²
S 16
+16 ) 2 ) 8 ) 6
) 2 ) 8 ) 6
3 S² 3 Р 4
Отдает
- 2 ē
Степень окисления атома элемента
Принимает
М g +2
S -2
+ 2 ē

Правила определения степени окисления атома в соединении:
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю = 0 Na 0 , P 4 0 , O 2 0
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду.
H +1 N +5 O 3 -2 : (+1)×1+(+5)×1+(-2)×3 = 0 (S +6 O 4 -2 ) -2 : (+6)×1+(-2)×4 = ‒2

Задание 1 . Определите степени окисления всех атомов в формуле серной кислоты H 2 SO 4 ?
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
H +1 S x O 4 -2
2. Составим и решим уравнение, согласно правилу (II):
(+1)×1+(х)×1+(-2)×4=0
Х=6 или (+6), следовательно, у S CО = +6, S +6 H2 +1 S +6 O 4 -2

Задание 2 . Определите степени окисления всех атомов в формуле фосфорной кислоты H 3 PO 4 ?
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
H 3 +1 P x O 4 -2
2. Составим и решим уравнение, согласно правилу (II):
(+1)×3+(х)×1+(-2)×4=0
Х=5 или (+5), следовательно,
у фосфора CО = (+5) , P +5 , H 3 +1 P +5 O 4 -2

Задание 3 . Определите степени окисления всех атомов в формуле иона аммония (NH 4 ) + ?
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
(N х H 4 +1 ) +
2. Составим и решим уравнение, согласно правилу (II):
(х)×1+(+1)×4=+1
Х= -3 , следовательно, у азота CО = (-3) , т.е. N -3
(N -3 H 4 +1 ) +

Работа в группах: Определите степени окисления атомов в формулах веществ: 1. Br 2 , CaO , SiO 2 , H 2 CO 3 , CuO , 2. Cu 2 O , H 2 , KNO 3 , FeO , Fe , 3. Fe 2 O 3, Fe(OH) 2, Fe 2 (SO 4 ) 3, N 2 , HClO 4




ПРОБЛЕМА
- «Зачем нам нужно знать степень окисления?»

ОТВЕТ
Чтобы установить или составить формулу вещества надо знать валентность или степень окисления элементов .

СОСТАВ ВЕЩЕСТВА атомы элементов степень окисления элементов формула вещества вещество
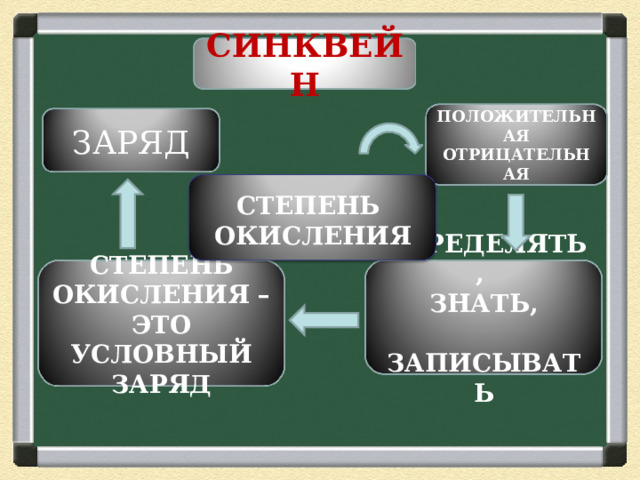
СИНКВЕЙН
ПОЛОЖИТЕЛЬНАЯ ОТРИЦАТЕЛЬНАЯ
ЗАРЯД
СТЕПЕНЬ
ОКИСЛЕНИЯ
ОПРЕДЕЛЯТЬ,
ЗНАТЬ,
ЗАПИСЫВАТЬ
СТЕПЕНЬ ОКИСЛЕНИЯ – ЭТО УСЛОВНЫЙ ЗАРЯД

Задание на дом: §43, знать определения, алгоритм нахождения степеней окисления , упр. 6, 7, 8 (на выбор).

Какой смайлик соответствует вашему настроению на уроке:













































































