Вывод формул веществ по массовым долям элементов и данным для нахождения истинной молярной массы (плотности, массе и объёму газа или относительной плотности).
Вычисление относительной молекулярной массы Mr(CхHy) по относительной плотности
газа. Mr (CхHy) = D(Г) · Mr(Г) , где D(Г) - относительная плотность газа (безразмерная величина)
1. Mr (CхHy) = Dв·29, где Dв - относительная плотность по воздуху, а Mrвозд.=29 (постоянная величина для воздуха), для остальных газов рассчитываем Mr
2. Mr (CхHy) = р · Vm, где р абсолютная плотность (г/л), Vm= 22,4л/моль - постоянная величина для всех газов при н.у.
Алгоритм решения задачи
Задача. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Записать условие задачи. Решение:
Дано: 1. Вычислить относительную молекулярную массу
w(C)=81,8% M(CхHy) по относительной плотности
w(H)=18,2%: M(СхНу)= DN2 · Mr(N2)
DN2 (CхНу) =1,57 M(СхНу)=1,57 · 28 =43,99=44
Найти:
MФ (CхHy)-? 2. Найти индексы х и y по отношению
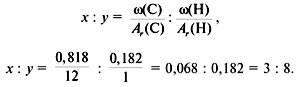
3. Записать простейшую формулу: С3Н8.
4. Проверка: М(C3H8) = 44, следовательно,
C3H8 – истинная формула.
Примечание: если бы М(CхHу) была равна 88, то нужно найти численный показатель
р= М(CхHу)/М(C3H8) = 88/ 44=2, следовательно истинная формула 2(C3H8)= C6H16
Задания для самостоятельной работы
Первый уровень
1. Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества. (C8H16)
2. Органическое вещество содержит 82,75% углерода и 17,25% водорода. Плотность паров вещества по воздуху 2. Определить формулу вещества. (C4H10)
3.Органическое вещество содержит 81,8% углерода и 18,2% водорода. Плотность паров вещества по водороду 22. Определить формулу вещества. (С3Н8)
4.Органическое вещество содержит 85,71% углерода и 14,29% водорода. Плотность паров вещества по водороду 21. Определить формулу вещества. (С3Н6)
5.Органическое вещество содержит 82,8% углерода, а плотность этого вещества составляет 2,59г/л. Определить формулу вещества. (C4H10)
6.Органическое вещество содержит 85,7% углерода и 14,3% водорода. Плотность паров вещества по азоту 2. (C2H4)
Второй уровень
1.Найти формулу углеводорода, в котором содержится 14,29 % водорода, а его относительная плотность по азоту равна 2. ( С4Н8)
2.Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить формулу вещества. (C7H12)
3.Определите формулу углеводорода, массовая доля водорода в котором составляет
14,3 %. Относительная плотность этого вещества по водороду равна 21. (С3Н6)
4. Относительная плотность паров углеводорода по воздуху равна 3,31, а массовая доля водорода в нём равна 12,5 %. Определите молекулярную формулу углеводорода. (С7Н12)
5.Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. (C7H12.)
6. Определите формулу углеводорода, массовая доля водорода в котором составляет 14,3 %. Относительная плотность этого вещества по водороду равна 21.(С3Н6.)
Третий уровень
1.Определить молекулярную формулу органического вещества, массовые доли углерода, азота и водорода в котором составляют 38,7; 45,15 и 16,15 % соответственно. Относительная плотность его паров по воздуху равна 1,069. (CH5N)
2. Органическое вещество содержит 54,84% углерода, 9% водорода, 36,36% кислорода. Плотность паров вещества по водороду 44. Определить формулу вещества. (C4H8О2)
3. Определить молекулярную формулу органического вещества, массовые доли углерода, водорода и азота в котором составляют 65,75; 15,06 и 19,18 % соответственно. Относительная плотность его паров по воздуху равна 2,52. (C4H10О)
4.Известно, что органическое вещество содержит атомы углерода, водорода и кислорода. Определить молекулярную формулу органического вещества, массовые доли углерода, водорода в котором составляют 40% и 6,7% соответственно. Относительная плотность его паров по водороду равна 15. (CH2О)
5. Известно, что органическое вещество содержит атомы углерода, водорода и кислорода. Определить молекулярную формулу органического вещества, массовые доли углерода и водорода в котором составляют 64,9% и 13,5% соответственно. Относительная плотность его паров по воздуху равна 2,55. (C4H10О)
6.Выведите молекулярную формулу органического соединения, содержащего 38,7% углерода, 16,2% водорода и азот. Относительная плотность его паров по водороду равна 15,5. (CH5N)
III. Вывод формул веществ по продуктам сгорания.
Проанализировать состав продуктов сгорания и сделать вывод о качественном составе сгоревшего вещества:
Н2О Н, СО2 С, SO2 S, P2O5 P, Na2CO3 Na, C; HCl H, Cl
Наличие кислорода в веществе требует проверки. Обозначить индексы в формуле через x, y, z. Например: Сх Ну Оz (?).
2. Найти количества веществ продуктов сгорания по формулам:
= m / M и = V / Vm
3. Найти количества элементов, содержавшихся в сгоревшем веществе.
Например:
(С) = (СО2), (Н) = 2 ∙ (Н2О), (Na) = 2 ∙ (Na2CO3), (C) = (Na2CO3) и т.д.
4. Если сгорело вещество неизвестного состава, то обязательно нужно проверить, содержался ли в нём кислород. Например: Cx, Hy, Oz (?),
m(O) = m в – ва – (m(C) + m(H)
Предварительно нужно найти: m(C) = (C) ∙ 12 г / моль, m(H) = (H) ∙ 1 г / моль
Если кислород содержался, найти его количество: (О) = m(O) / 16 г / моль
5. Найти соотношения индексов по соотношению количеств элементов. Например:
x : y : z = (С) : (Н) : (О)
Числа привести к целым, разделив их наименьшее.
6. Если известны данные для нахождения истинной молярной массы вещества, найти её по формулам: M = ∙ Vm, M1 = D2 ∙ M2
7. Написать простейшую формулу и найти её молярную массу. Сравнить истинную молярную массу с простейшей и увеличить индексы в нужное число раз.
Задача № 1.
При сгорании 7,2 г вещества образовалось 9,9 г углекислого газа и 8,1 г воды. Плотность паров этого вещества по водороду равна 16. Определите молекулярную формулу вещества.
Дано: Решение:
m![]() в – ва = 7,2 г 1. Напишем формулу Cx Hy Oz (?).
в – ва = 7,2 г 1. Напишем формулу Cx Hy Oz (?).
m (CO2) = 9,9 г 2. Найдём количества веществ:
m (H2O) = 8,1 г (СО2) = m / М = 9,9 г / 44г/моль = 0,225моль
D![]() H2 = 16 (Н2О) = m / M = 8,1 г / 18г/моль = 0.45моль
H2 = 16 (Н2О) = m / M = 8,1 г / 18г/моль = 0.45моль
М.Ф. = ? 3. Найдём количества элементов:
(С) = (СО2) = 0,225моль
(Н) = 2 ∙ (Н2О) = 2 ∙ 0,45 = 0,9моль
4. Найдём массы:
m(C) = 12г/моль ∙ 0,225моль = 2,7 г
m(H) = 1г/моль ∙ 0,9моль = 0,9 г
m(O) = 7,2 г – (2,7 + 0,9) = 3,6 г
Найдём количество элемента кислорода:
(О) = 3,6 г / 16г/моль = 0,225моль
5. Найдём соотношение индексов:
x : y : z = 0,225 : 0,9 : 0,225 = 1 : 4 : 1
Простейшая формула - СН3ОН:
М(СН3ОН) = 32г/моль
6. Найдём истинную молярную массу:
Мист. = DH2 ∙ 2 = 16 ∙ 2 = 32г/моль
7. Сравним: Мист. / Мпрост. = 32г/моль / 32г/моль = 1
Молекулярная формула – СН3ОН.
Ответ: СН3ОН.
Задача № 2.
При сгорании газа, не содержащего кислород, выделилось 2,24 л углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Определить формулу сгоревшего вещества.
Д![]() ано:
ано:
V(CO2) = 2,24 л Решение:
m(H2O) = 1,8 г 1. Написать формулу сгоревшего вещества: CxHyClz.
m(HCl) = 3,65 2. Найти количества веществ:
![]() (CO2) = V / Vm = 2,24л / 22,4л/моль = 0,1моль
(CO2) = V / Vm = 2,24л / 22,4л/моль = 0,1моль
М.Ф. = ? (Н2О) = m / M = 1,8г / 18г/моль = 0,1моль
(HCl) = m / M = 3,65г / 36,5г/моль = 0.1моль
3. Найти количества элементов:
(С) = (СО2) = 0,1моль
(Н) = 2 ∙ (Н2О) + (НСl) = 2 ∙ 0,1 + 0,1 = 0,3 моль
(Сl) = (HCl) = 0,1моль
4. Найти соотношение индексов:
х : y : z = 0,1 : 0,3 : 0,1 = 1 : 3 : 1
5. Простейшая формула: CH3Cl.
Ответ: CH3Cl.
Задача № 3.
При сгорании вторичного амина симметричного строения выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота. Установите молекулярную формулу этого амина.
Ответ: (C2H5)2NH.
Задача № 4.
При полном сгорании органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1.8 г воды и 4 г фтороводорода. Установите молекулярную формулу сгоревшего соединения.
Ответ: C2H4F2.
Задача № 5.
При сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0.224 л азота (объёмы газов измерены при н. у.). Плотность вещества по водороду 15,50. Установите его молекулярную формулу.
Ответ: СН3NH2.
IV. Вывод формул органических веществ по общим формулам.
Органические вещества образуют гомологические ряды, которые имеют общие формулы.
Это позволяет:
M(CnH2n + 2) = 12 ∙ n + 1 ∙ (2n +2) = 14n + 2;
приравнивать молярную массу, выраженную через n, к истинной молярной массе и находить n.
составлять уравнения реакций в общем виде и производить по ним вычисления.
При решении таких задач нужно знать и использовать общие формулы гомологических рядов:
алканы – СnH2n + 2
алкены и циклоалканы – CnH2n
алкины и алкадиены – CnH2n – 2
арены – CnH2n – 6
моногалогеналканы – CnH2n + 1Г
дигалогеналканы – CnH2nГ2
фенолы – CnH2n – 7OH
предельные одноатомные спирты – CnH2n + 1OH, R – COH
альдегиды – CnH2n + 1 COH, R – COH
предельные карбоновые кислоты – CnH2n + 1COOH, R – COOH
сложные эфиры – R1 – COOR2
первичные амины – CnH2n + 1NH2, R – NH2
вторичные амины – R1 – NH – R2
третичные амины – R1 – N – R2
![]()
R3
14. аминокислоты – CnH2n(NH2)COOH
Рассмотрим возможные варианты задач на вывод формул органических веществ по общим формулам.
Вывод формул по известной массовой доле элемента в веществе.
Порядок решения:
Написать общую формулу и выразить молекулярную массу вещества через число n;
Подставить данные в формулу ω(Эл) = Аr (Эл) ∙ индекс / Мr;
Решить уравнение с одним неизвестным, найти число n.
Задача № 1.
Определить формулу аминокислоты, если известно, что она содержит 15,73 % азота.
Дано: Решение:
ω![]()
![]() (N) = 15,73 % 1. Oбщая формула аминокислот:
(N) = 15,73 % 1. Oбщая формула аминокислот:
CnH2n(NH2)COOH
М.Ф. = ?
2. Выразим через n молекулярную массу:
Мr(CnH2n(NH2)COOH) = 12n + 2n + 16 + 45 = 14n + 61.
3. Подставим данные в формулу: 0,1573 = 14 ∙ 1 / 14n + 61.
2,2022n + 9,5953 = 14.
2,2022n = 4,4047
n = 2 Ответ: C2H4(NH2)COOH.
Задача № 2.
Массовая доля водорода в алкане составляет 0,1579. Найти формулу алкана.
Ответ: С8Н18.
Задача № 3.
Массовая доля углерода в алкине 87,8 %. Определить формулу алкина.
Ответ: С6Н10.
Задача № 4.
Массовая доля кислорода в аминокислоте равна 35,95 %. Найти молекулярную формулу аминокислот.
Ответ: C2H4(NH2)COOH.
Задача № 5.
Массовая доля хлора в монохлоралкане равна 55,04 %. Найти формулу моно -
хлоралкана.
Ответ: C2H5Cl.
2. Вывод формул по известным данным для нахождения истинной молярной массы
(плотности, относительной плотности, массе и объёму).
Найти истинную молярную массу по формулам: = m / V
М = ∙ Vm М = D2 ∙ M2
2. Выразить молярную массу через n и приравнять её к истинной.
3. Решить уравнение с одним неизвестным, найти число n.
Задача № 1.
Пары одного из монобромалканов в 68,5 раз тяжелее водорода. Найти формулу монобромалкана.
Дано:
D![]() H2 = 68,5 Решение:
H2 = 68,5 Решение:
![]() 1. Общая формула монобромалканов – CnH2n+1Br;
1. Общая формула монобромалканов – CnH2n+1Br;
М.Ф. = ? 2. Найдём истинную молярную массу:
M = DH2 ∙ 2 = 68,5 ∙ 2 = 137 (г/моль);
3. Выразим М через n:
M(CnH2n + 1Br) = 12n + 2n + 1 + 80 = 14n + 81
Приравняем: 14n + 81 = 137
14n = 56
n = 4
Ответ: С4H9Br.
Задача № 2.
Плотность газообразного алкина равна 2,41 г/л. Найти его молекулярную формулу.
Ответ: С7Н12.
Задача № 3.
Относительная плотность паров альдегида по воздуху равна 1,517. Найти его молекулярную формулу.
Ответ: СН3СОН.
Задача № 4.
Относительная плотность паров первичного амина по кислороду – 2,719.
Определить его молекулярную формулу.
Ответ: C5H11NH2.
Задача № 5.
Найти молекулярную формулу алкина, если 5,6 л его имеют массу 10 г.
Ответ: С3Н4.
3. Вывод формул по уравнениям реакций в общем виде, если известны данные для двух веществ.
Порядок решения:
Составить уравнение реакции в общем виде.
Выразить молярные массы неизвестных веществ через число n.
Найти количества двух веществ по формулам:
= m /M = V / Vm
4. Составить уравнение, приравняв найденные количества веществ с учётом соотношения числа моль этих веществ по уравнению (определяют по коэффициентам).
5. Решить уравнение с одним неизвестным, найти число n и записать формулу.
Задача № 1.
При взаимодействии предельного одноатомного спирта массой 3 г с избытком натрия было получено 0,56 л водорода. Определить формулу спирта.
Дано:
m![]() спирта = 3г Решение:
спирта = 3г Решение:
V(H2) = 0,56л 1. Напишем уравнение реакции в общем виде:
2![]() CnH2n + 1 OH + 2Na H2 + 2CnH2nONa
CnH2n + 1 OH + 2Na H2 + 2CnH2nONa
М.Ф. = ? 2 моль 1 моль
2. Выразим молярную массу спирта через число n:
M(CnH2n + 1OH) = 12n + 2n + 1 + 16 + 1 = 14n + 18(г/моль).
3. Найдём количества веществ:
(СnH2n + 1OH) = m / M = 3г / 14n + 18г/моль =
= 3 / 14n + 18 моль
(Н2) = V / Vm = 0,56л / 22,4г/моль = 0,025 моль.
4. Из уравнения реакции видно, что
(СnH2n + 1OH) = 2 ∙ (H2)
5. Cоставим уравнение: 3 / 14n + 18 = 2 ∙ 0,025
n = 3
Ответ: С3Н7ОН.
Задача № 2.
При сгорании 13,2г алкана образовалось 20,16л углекислого газа. Найти формулу алкана.
Дано:
m![]() алкана = 13,2г Решение:
алкана = 13,2г Решение:
V(CO2) = 20,16л 1. Напишем уравнение реакции горения в общем виде:
 CnH2n + 2 + (3n + 1 / 2)O2 nCO2 + (n + 1)H2O
CnH2n + 2 + (3n + 1 / 2)O2 nCO2 + (n + 1)H2O
М.Ф. = ? 1 моль n моль
2. Выразим молярную массу алкана через n:
M(CnH2n + 2) = 12n + 2n + 2 = 14n + 2г/моль
3. Найдём количества веществ:
(CnH2n + 2) = m /M = 13,2г / (14n + 2)г/моль =
= 13,2 / 14n + 2 моль
(CO2) = V / Vm = 20,16 / 22,4г/моль = 0,9 моль
4. Из уравнения реакции видно, что:
n ∙ (CnH2n + 2) = (CO2)
5. Составим уравнение: n ∙ 13,2 / 14n + 2 = 0,9
n = 3
Ответ: С3Н8.
Задача № 3.
При взаимодействии 2,9г неизвестного альдегида с аммиачным раствором оксида серебра получается 10,8г металла. Определить формулу альдегида.
Ответ: С3Н6О.
Задача № 4.
В результате реакции предельного одноатомного спирта с 18,25г хлороводорода получили органический продукт массой 46,25г и воду. Определить молекулярную формулу спирта.
Ответ: С4Н9ОН.
Задача № 5.
Для сжигания 5,8г алкана потребовалось 14,56л (н.у.) кислорода. Определить формулу алкана.
Ответ: С4Н10.
Задача № 6.
К 10,5г алкена присоединяют 5,6л бромоводорода (н.у.).
Найти формулу алкена.
Ответ: С3Н6.
4. Вывод формул по уравнениям реакций в общем виде с примене нием закона сохранения массы веществ.
Если известны массы всех реагентов и продуктов реакции, кроме одного вещества, то можно найти его массу на основании закона сохранения массы веществ.
Рассмотрим этот случай на конкретном примере.
Задача № 1.
Некоторый сложный эфир массой 7,4г подвергнут щелочному гидролизу. При этом получено 9,8г калиевой соли предельной одноосновной кислоты и 3.2г спирта. Установите формулу этого эфира.
Дано:
m![]() (эфира) = 7,4г Решение:
(эфира) = 7,4г Решение:
m(соли) = 9,8г 1. Составим уравнение гидролиза эфира в общем виде:
m![]() (спирта) = 3,2г R1COOR2 + KOH R1COOK + R2OH
(спирта) = 3,2г R1COOR2 + KOH R1COOK + R2OH
1 моль 1 моль 1 моль 1 моль
М.Ф.(эфира) = ? 2. По закону сохранения массы веществ:
m(R1COOR2) + m(KOH) = m(R1COOK) + m(R2OH)
Найдём массу и количество гидроксида калия:
m(KOH) = m(R1COOK) + m(R2OH) – m(R1COOR2) =
= 9,8 + 3,2 – 7,4 = 5,6г
(КОН) = 5,6г / 56г/моль = 0,1 моль
3. Найдём молярную массу соли и её формулу:
(R1COOK) = (KOH) = 0,1 моль
M = m / = 9,8г / 0,1моль = 98 г/моль
M(R1) = 98 – M(COOK) = 98 – 83 =
= 15г/моль СH3СOOK
4. Найдём молярную массу спирта и его формулу:
(R2OH) = (KOH) = 0,1 моль
M(R2OH) = m / = 3,2г / 0,1г/моль = 32 г/моль
M(R2) = 32 – M(OH) = 32 – 17 = 15г/моль СH3OH
Следовательно, формула эфира – СН3СООСН3.
Ответ: СН3СООСН3.
Задача № 2.
При щелочном гидролизе 37г некоторого сложного эфира получено 49г калиевой соли предельной одноосновной кислоты и 16г спирта. Установить формулу сложного эфира.
Ответ: СН3СООСН3.






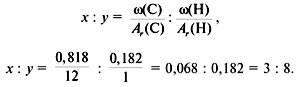
 CnH2n + 2 + (3n + 1 / 2)O2 nCO2 + (n + 1)H2O
CnH2n + 2 + (3n + 1 / 2)O2 nCO2 + (n + 1)H2O
















