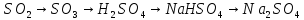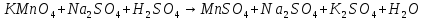Министерство образования Саратовской области
Государственное автономное профессиональное образовательное учреждение Саратовской области
«Поволжский колледж технологии и менеджмента»
|
|
| УТВЕРЖДАЮ Зам. директора по УМиНД ____________Е.Ю. Шепелева «___» 2017 г |
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
по общеобразовательной учебной дисциплине
ТЕХНОЛОГИЧЕСКАЯ КАРТА
учебного занятия по теме «Классификация химических реакций»
по общеобразовательной учебной дисциплине
ОУД. 09 Химия
Базовая подготовка по специальности
15.02.08 Технология машиностроения
Очная форма обучения
| Автор-разработчик: | Бабич Оксана Дмитриевна |
|
| Высшая квалификационная категория |
| РАССМОТРЕНО Цикловой комиссией Отделения химических технологий Протокол № __ от ______________ г. ПЦК _________ Спирина О.С. |
|
|
Балаково
2017 г
Технологическая карта учебного занятия по теме «Классификация химических реакций» общеобразовательной учебной дисциплины ОУД. 09 «Химия» разработана с целью обеспечения качественного конструирования/проектирования учебных занятий по общеобразовательной учебной дисциплине в соответствии с требованиями ФГОС СОО при реализации ППССЗ.
В основу технологической карты положен общепринятый в современной дидактике подход к понятию и структуре технологической карты. Чтобы технологическая карта общеобразовательной учебной дисциплины в полной мере соответствовала специфике обучения в образовательных организациях СПО необходимо иметь в виду, что:
во-первых, в соответствии с требованиями ФГОС СПО, результатом освоения ОПОП ППССЗ обучающимися являются освоенные компетенции (общие и профессиональные) и умения, усвоенные знания и приобретенный практический опыт;
во-вторых, в соответствии с требованиями ФГОС СОО ОПОП ППССЗ также должна быть ориентирована на достижение личностных, предметных и метапредметных результатов;
в третьих в соответствии с требованиями ФГОС СОО ОПОП ППССЗ должна включать в себя «Содержательный раздел», составной частью которого является программа развития универсальных учебных действий (УУД - регулятивных, познавательных, коммуникативных) и формирование компетенций обучающихся в области учебно-исследовательской и проектной деятельности на ступени СОО.
Эти аспекты нашли отражение в структуре технологической карты учебного занятия по общеобразовательной дисциплине, основная цель которой учесть специфику обучения в образовательных организациях СПО и сложившегося подхода при реализации ФГОС СОО - «школьного образования».
Основой для разработки технологических карт конкретных учебных занятий является технологическая карта изучения общеобразовательной учебной дисциплины ОУД. 09 «Химия», т.е. параметры, зафиксированные в виде требований к:
формированию конкретных общих компетенций;
к результатам освоения общеобразовательной учебной дисциплины - освоенных умений и усвоенных знаний;
контролю и оценке результатов освоения общеобразовательной учебной дисциплины;
оценке качества освоения общеобразовательной учебной дисциплины при организации текущего контроля успеваемости и промежуточной аттестации;
которые должны быть конкретизированы в технологической карте при проведении конкретного учебного занятия по общеобразовательной учебной дисциплине.
Структура технологической карты учебного занятия может быть разной, но в любом случае она должна включает в себя:
формулировку темы учебного занятия;
планируемые результаты/цели (личностные, метапредметные, предметные знания и умения);
особенности организации образовательного пространства (межпредметные связи, формы работы, ресурсы);
основное содержание темы занятия, термины и понятия;
этапы учебного занятия;
технологию изучения указанной темы;
контрольно-проверочные действия и организацию рефлексии;
дидактические материалы.
| МЕТОДИКА ПРОВЕДЕНИЯ УЧЕБНОГО ЗАНЯТИЯ |
Учебное занятие проводится в соответствии с основными положениями педагогической (образовательной) технологии «Игровые технологии».
Для успешного выполнения обязательного минимума содержания образования и требований к уровню подготовки выпускников необходимо использовать современные образовательные технологии. Наиболее эффективный результат в достижении поставленных целей дает использование личностно-ориентированных технологий.
Урок – игра – это активная форма учебного занятия, в ходе проведения которой моделируется определенная ситуация, игра – творчество, игра – труд. Как правило, в процессе игры у студентов вырабатывается привычка сосредоточиваться, мыслить самостоятельно, развивать внимание, стремление к знаниям. Студенты как бы применяют на себе роль взрослых людей, через понимания мыслей, чувств и поступков моделируют реальность. Увлекшись, студенты не замечают, что учатся: познают, запоминают новое, ориентируются в необычных ситуациях, пополняют запас представлений, понятий, развивают фантазию. Знания, полученные на занятии, становятся для них личностно-значимыми, эмоционально-окрашенными, что помогает лучше узнать, “прочувствовать” изучаемое. Тем самым студенты осваивают и углубляют новые знания, а также овладевают целым комплексом важных “взрослых” умений, в первую очередь, коммуникативных, развивают способности к восприятию, сопереживанию.
В своей практике стараюсь применять игровые приемы и ситуации, которые выступают как средство побуждения, стимулирования студентов к учебной деятельности. Игры могут использоваться как элемент занятия, или вся деятельность на занятии будет проходить в форме игры
| ТЕХНОЛОГИЧЕСКАЯ КАРТА УЧЕБНОГО ЗАНЯТИЯ |
| Общие положения: |
|
| Учебная дисциплина | ОУД.09 Химия |
|
| Раздел | 1 Общая и неорганическая химия Всего: 66 часов В том числе: 22 часа самостоятельная учебная нагрузка обучающегося (ВСР); 44 часа аудиторная учебная нагрузка, из них 34 часа теоретические занятия; 4 часа практические занятия, 6 часов лабораторные занятия. |
|
| Тема | 1.6. Химические реакции. Всего: 10 часов В том числе: 4 часа самостоятельная учебная нагрузка обучающегося (ВСР); 8 часов аудиторная учебная нагрузка, из них 6 часов теоретические занятия; 2 часа лабораторные занятия. |
|
| Тема учебного занятия | Классификация химических реакций. 2 часа |
|
| Тип учебного занятия | Учебное занятие по обобщению и систематизации знаний, умений и способов деятельности. |
|
| Форма/вид учебного занятия | Дидактическая игра |
|
| Педагогическая/образовательная технология | Игровая |
|
| Методы обучения | По способу организации учебно-познавательной деятельности: методы проверки и оценивания; По характеру учебно-познавательной деятельности: репродуктивные, объяснительно-иллюстрированные, поисковые. По степени активности преподавателя и студента (осознанности восприятия учебного материала): активные, интерактивные; По логике изложения и восприятия учебного материала: дедуктивные; По источнику учебного материала: словесные, наглядные, практические. |
|
| Планируемый уровень освоения (основной уровень активности) | Р/2 – репродуктивный (выполнение деятельности по образцу, инструкции или под руководством) |
| Формируемые на учебном занятии общие компетенции в соответствии с ФГОС СПО: |
|
| Результаты (освоенные общие компетенции) | Основные показатели оценки результата | Формы и методы контроля и оценки |
|
| ОК 2. Организовывать собственную деятельность, определять методы и способы выполнения профессиональных задач, оценивать их эффективность и качество. | Правильность определения цели и порядка работы. Грамотность обобщения результата. Эффективность использования в работе полученных ранее знаний и умений. Рациональность распределения времени при выполнении работ. Адекватность и аргументированность оценки эффективности и качества выполненных работ. | Оценка эффективности и качества выполнения учебных задач. |
|
| ОК 3. Решать проблемы, оценивать риски и принимать решения в нестандартных ситуациях. | Грамотность самоанализа и коррекции результатов собственной деятельности. Высокая ответственность за свой труд. Правильность решения стандартных и нестандартных учебных задач в процессе освоения учебной дисциплины. | Оценка выполнения практических работ. |
|
| ОК 4. Осуществлять поиск, анализ и оценку информации, необходимой для постановки и решения профессиональных задач, профессионального и личностного развития | Точность и скорость обработки и структурирования информации. Результативность нахождения и использования источников информации. Эффективность поиска и использования необходимой информации. Обоснованность выбора и оптимальность состава источников, необходимых для решения поставленной задачи.
| Оценка выполнения творческих заданий. |
|
| ОК 6. Работать в коллективе и команде, обеспечивать ее сплочение, эффективно общаться с коллегами, руководством, потребителями. | Адекватность выражения своих эмоций и терпимость к другим мнениям и позициям. Добровольность и осознанность необходимости оказания помощи участникам команды. Эффективность нахождения продуктивных способов реагирования в конфликтных ситуациях. Результативность выполнения обязанностей в соответствии с распределением групповой деятельности. Добровольность обмена своими знаниями и опытом с целью помощи другим. Внимательность и заинтересованность мнением сокурсников и преподавателей и признание их знаний и навыков. Активность участия в работе других. Эффективность соблюдения норм деловой культуры. Эффективность соблюдения этических норм. | Наблюдение за ролью студентов в группе.
|
|
| ОК 7. Ставить цели, мотивировать деятельность подчиненных, организовывать и контролировать их работу с принятием на себя ответственности за результат выполнения заданий. | Адекватность самоанализа и эффективность коррекции результатов собственной работы. Осознанность проявления ответственности за работу в команде и результат выполнения заданий. Эффективность взаимодействия со студентами и преподавателями в ходе обучения.
| Наблюдение за ролью студентов в группе.
|
|
| ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации. | Регулярность и эффективность организации самостоятельной работы при изучении учебной дисциплины. Эффективность планирования обучающимся повышения личностного и квалификационного уровня. Самостоятельный, профессионально-ориентированный выбор тематики творческих и проектных работ (рефератов, докладов и т.п.). Видение собственной образовательной и профессиональной траектории | Защита творческих и проектных работ. Оценка работы студента на дополнительных занятиях. Оценка содержания портфолио студента. |
| Планируемые результаты /цель учебного занятия в соответствии ФГОС СОО: |
|
| личностные результаты | основные показатели оценки результата | формы и методы контроля и оценки |
|
| ЛР1 чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами | - соблюдение правил безопасного обращения с химическими веществами, материалами и процессами;
| Наблюдение Экспертная оценка |
|
| ЛР2 готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом; | - демонстрация готовности к самостоятельной, творческой деятельности; - сознательное отношение к продолжению образования | Наблюдение Экспертная оценка |
|
| метапредметные результаты | основные показатели оценки результата | формы и методы контроля и оценки |
|
| МР1 использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере; | - демонстрация способностей к учебно-исследовательской и проектной деятельности; - использование различных методов решения практических задач; - использование различных ресурсов для достижения поставленных целей | Наблюдение Экспертная оценка |
|
| МР2 использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере | - проведение самостоятельного поиска химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); - использование компьютерных технологий для обработки и передачи химической информации и ее представления в различных формах; - критическая оценка достоверности химической информации, поступающей из разных источников; - демонстрация способности самостоятельно использовать необходимую информацию для выполнения поставленных учебных задач; - соблюдение техники безопасности, гигиены, ресурсосбережения, правовых и этических норм, норм информационной безопасности | Наблюдение Экспертная оценка |
|
| предметные результаты | основные показатели оценки результата | формы и методы контроля и оценки |
|
| ПР1 сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; | -иметь представление о месте химии в научной картине мира; - понимать роль химии для решения практических задач. | Оперативный контроль: - в устной или письменной форме; - тестирование |
|
| ПР2 владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой | - знать и использовать химические понятия, законы и закономерности химии, химическую терминологию и символику. | Оперативный контроль: - в устной или письменной форме; - тестирование |
|
| ПР4 сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям; | - уметь количественно оценить и произвести расчеты по химическим формулам и уравнениям. | Оперативный контроль: - в устной или письменной форме; - тестирование; - просмотр и оценка отчётов по практическим занятиям и лабораторным работам |
|
| ПР6 сформированность собственной позиции по отношению к химической информации, получаемой из разных источников | - иметь собственную позицию по отношению к химической информации, получаемой из разных источников. | Оперативный контроль: - в устной или письменной форме; - тестирование; - просмотр и оценка отчётов по практическим занятиям и лабораторным работам |
|
| содержание учебного материала (дидактические единицы) | студент должен знать | студент должен уметь |
|
| Классификация химических реакций по количеству вступивших и получившихся веществ и по их составу. Простые и сложные вещества, химические реакции, химические формулы. Рассматриваются реакции соединения, замещения, разложения, обмена с использованием лабораторных и демонстрационных опытов. | основные законы химии: сохранения массы веществ, постоянства состава веществ; важнейшие химические понятия: химическая связь, валентность, степень окисления, окислитель и восстановитель, окисление и восстановление, основные теории химии: химической связи, электролитической диссоциации. | выполнять химический эксперимент: по распознаванию важнейших неорганических, решать: расчетные задачи по химическим формулам и уравнениям. |
| Оценка качества освоения темы учебного занятия: |
|
| текущий контроль успеваемости | промежуточная аттестация |
|
| Содержание оценочных материалов по теме занятия: 1. Напишите уравнение реакции следующих превращений: 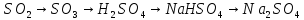
2. Используя метод электронно-ионного баланса подберите коэффициенты. Определите окислитель и восстановитель 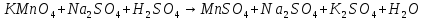
3. С веществами каких классов взаимодействуют: а) основные оксиды; б) кислотные оксиды? Напишите соответствующие уравнения реакций. | Подготовка к дифференцированному зачету |
| Организация образовательного пространства: |
|
| Формы организации деятельности студентов | Виды деятельности студентов |
|
| Групповая | Работа с опорами, выполнение упражнений, выполнение практических заданий, ответы на вопросы, представление результатов работы. |
|
| Ресурсное обеспечение учебного занятия: |
|
| Материально-техническое и дидактическое обеспечение | Основная литература | Дополнительная литература | Электронные информационные и образовательные ресурсы |
|
| Материально-техническое: Доска, мел, компьютер, экран, наглядные пособия, лабораторное оборудование. Дидактическое: Карточки-задания, раздаточный материал, бланки, материал для исследования, мультимедийная презентация. | Химия для профессий и специальностей технического профиля: учебник/ О.С.Габриелян, И.Г.Остроумов. – 5-е изд., - М.: Издательский центр «Академия», 2012. Раздел 1, глава 6, параграф 6.1. | Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред.проф. образования. — М., 2014. Раздел 1, глава 5. | www. chem. msu. su (Электронная библиотека по химии); www. hemi. wallst. ru (Образовательный сайт для школьников «Химия») |
| ДИДАКТИЧЕСКАЯ СТРУКТУРА (технология проведения) УЧЕБНОГО ЗАНЯТИЯ |
| Основные этапы организации учебной деятельности | Цель этапа | Деятельность преподавателя | Задания для студентов, выполнение которых приведёт к достижению запланированных результатов | Деятельность студентов |
| Организационный этап (5 мин.) |
| Организационный момент | Определение готовности обучающихся к занятию и включение их в деловой ритм | Принимает рапорт менеджера, приветствует студентов, фиксирует отсутствующих проверяет подготовленность к занятию, организует внимание студентов | - | Менеджер докладывает о готовности группы к занятию, сдает рапорт. Студенты приветствуют преподавателя, готовятся к работе на занятии |
| 1. Мотивационно-ориентировочный этап (23 мин.) |
| 1.1. Актуализация знаний и умений
| Актуализация субъектного опыта, опорных действий и фиксирование затруднений в пробном действии, выравнивание стартовых позиций. | Организует повторение ранее изученного материала, необходимого для изучения нового в форме фронтального опроса. Устанавливает правильность, полноту и осознанность ранее изученного учебного материала (освоенных умений и усвоенных знаний). Выявляет и устраняет в ходе актуализации обнаруженные проблемы. | Вопросы/задания Приложение 1 | Отвечают на вопросы.
|
| 1.2. Мотивация учебной деятельности
| Обеспечение мотивации учебной деятельности.
| Стимулирует желание и интерес к выполнению заданий в форме игры. Сообщает правила игры. | Вопросы/задания Приложение 2 | Участвуют в беседе и знакомятся с условиями игры. Делятся на команды. |
| 1.3. Целеполагание
| Формулировка темы и цели занятия.
| Обеспечивает самостоятельную формулировку темы и цели занятия, как собственной учебной задачи. | Тема занятия «Классификация химических реакций. Окислительно-восстановительные реакции» Цель занятия «систематизировать знания учащихся о классификации веществ, типах химических реакций, продолжить формирование умений наблюдать, записывать уравнения и предвидеть продукты химических реакций, продолжить формирование умения при написании реакций обмена, применения условий течения реакций между растворами до конца, подготовить учащихся к пониманию обратимых и необратимых реакций, теории электролитической диссоциации» | Самостоятельно формулируют тему и цель занятия, как собственной учебной задачи. |
| 2. Операционально-исполнительский (организационно - деятельностный) этап (40 мин.) |
| 2.1. Организация познавательной деятельности | Обеспечение восприятия и осмысления изучаемого материала. | Представляет учебный материал одновременно в словесной и знаково-символической формах. Организует работу в группах. | Содержания учебного материала. Приложение 3 | Участвуют в обсуждении содержания учебного материала. Участвуют в игре.
|
| 2.2. Закрепление новых знаний, умений и способов деятельности | Первичный контроль понимания учебного материала. Обеспечение глубины понимания и на уровне применения знаний и умений в разнообразных ситуациях | Организовывает устный коллективный анализ учебной задачи. Выясняет пробелы и проводит их коррекцию. Организует вопросно-ответное общение и выполнение практических заданий. Организует самостоятельную работу в группах в виде игры по этапам. Корректирует ход игры, оказывает индивидуальную помощь при решении тех заданий, в которых студенты затрудняются. | Вопросы/задания Приложение 4 | Участвуют в игре. Выполняют задания в группах. |
| 3. Рефлексивно – оценочный этап (22 мин.) |
| 3.1. Обобщение и систематизация | Обеспечение формирования целостной системы ведущих знаний и умений студентов по теме занятия | Фиксирует новое содержание. Устанавливает правильность и осознанность изученного материала. Организует рефлексию действий студентов | Вопросы/задания Приложение 5
| Участвуют в обсуждении результатов игры.
|
| 3.2. Контроль, самоконтроль и коррекция | Выявление качества и уровня усвоения знаний, умений и способов деятельности. Проведение коррекции выявленных пробелов в знаниях, умениях и способах действия | Выявляет пробелы первичного осмысления изученного материала, коррекция выявленных пробелов, обеспечение закрепления в памяти студентов знаний, умений и способов действий | Вопросы/задания Приложение 6 | Проводят самооценку полноты и правильности усвоенной информации.
|
| 3.3. Домашнее задание | Обеспечение понимания студентами цели, содержания и способов выполнения домашнего задания | Выдает три уровня домашнего задания: | Приложение 7 | Записывают домашнее задание. Задают вопросы |
| 3.4. Итоговая рефлексия | Подвести итог проделанной работе на занятии | Инициирует рефлексию студентов по поводу своего психоэмоционального состояния, мотивации своей деятельности и взаимодействия с преподавателем и одноклассниками (познавательную, социальную, психологическую). Подводит итоги занятия | Вопросы для рефлексии Приложение 8
| Отвечают на вопросы |
| ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ К УЧЕБНОМУ ЗАНЯТИЮ |
Приложение № 1
| Пассажирский поезд. Запишите формулы веществ в соответствующие столбцы таблицы: H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH)2, O3, FeBr3 | Простые вещества | Сложные вещества | | 1. | 1. | | 2. | 2. | | 3. | 3. | | 4. | 4. | | 5. | 5. |
Скорый поезд. Запишите формулы веществ в соответствующие столбцы таблицы: P2O5, I2, HNO3, Ca(OH)2, Na2O, K2SO4, Fe, H3PO4, N2, Na2SiO3, LiOH, Cu | Простые вещества | Сложные вещества | | металлы | неметаллы | оксиды | основания | кислоты | соли | | 1. 2. | 1. 2. | 1. 2. | 1. 2. | 1. 2. | 1. 2. |
|
|
| (проверка выполненных заданий, используя сигнальные карточки, за выполнение задания «Пассажирского поезда» - 2 балла, «Скорого» - 3 балла)
|
Приложение № 2
1. Этап – Разминка
А) Каждой команде будет задано по 6 вопросов. За каждый правильный ответ – 1 балл. Если команда не ответила на свой вопрос, то у команды есть шанс заработать 2 балла, ответив на тот же вопрос
1. Этот газ имеет запах послегрозовой свежести (озон)
2. Природная газовая смесь (воздух)
3. То, из чего состоят тела (вещества)
4. Положительно заряженная частица (протон)
5. Самое твердое природное вещество (алмаз)
6. Газ, который выделяют растения на свету (кислород)
7. Родина фарфора (Китай)
8.Жидкий металл (ртуть)
9. Жидкий неметалл (бром)
10. Очень быстрая химическая реакция (взрыв)
11.Процесс окисления железа (ржавление)
12. Незаменимый ион гемоглобина крови (ион железа)
13. Компонент (ион), входящий в состав хлорофилла (ион магния)
14. Какие продукты питания являются источником йода (морепродукты, морская капуста – ламинария)
15. Этот металл может исцелять. Если хранить воду в сосуде, изготовленном из этого металла, то мельчайшие частички переходят в раствор и убивают микробы и бактерии (серебро)
16. Что объединяет мел, мрамор, известняк? (формула – карбонат кальция)
17. Какой газ создает «парниковый эффект»? (углекислый газ)
18. Какова формула поваренной соли? (хлорид натрия)
Б) Участникам команд необходимо написать на карточках только число, обозначающее правильный ответ. За каждый правильный ответ – 1 балл
1. Сколько атомов йода в молекуле йода? (2)
2. Чему равен молярный объем? (22,4)
3. Средняя молярная масса воздуха (29)
4. Сколько атомов кислорода содержится в серной кислоте? (4)
5. Количество букв в названии химических элементов, входящих в 7 группу главную подгруппу (галогены – 8)
6. Вода может находиться в …..агрегатных состояний ( 3 )
7. При какой температуре вода переходит в лед? (ноль)
8. Абсолютный ноль (в Кельвинах) (273)
9. Какова массовая доля азота в воздухе? (78%)
10. Число Авогадро (6,02*10-23)
Приложение № 3
2. Этап – «Шифровка».
| Задание: | в верхней части листа записаны уравнения химических реакций, в нижней – беспорядочно расставлены точки с цифрами; каждой цифре соответствует сумма коэффициентов в вышенаписанных уравнениях реакций. Ваша задача: расшифровать замаскированный химический элемент. Для этого необходимо по порядку уравнивать химические реакции, подсчитывать сумму коэффициентов в уравнении, находить соответствующие точки и последовательно, с помощью ручек, соединять их друг с другом. Если вы правильно выполните задание, то узнаете, какой химический элемент спрятался за цифрами. |
Шифровка № 1.
|
Ba + O2 → BaO
Fe(OH)3 + HCl → FeCl3 + H2O
Na + S → Na2S
Fe + O2 → Fe3O4 |
5
8
4
6
| 
|
Шифровка № 2.
|
C + O2 → CO2
CH4 → C2H2 + H2
Ca + HCl → CaCl2 + H2
K + S → K2S |
3
6
5
4 | 
|
Шифровка № 3.
|
HNO3 + CaO → Ca(NO3)2 + H2O
Fe + O2 → Fe2O3
BaO + H2SO4 → BaSO4 + H2O
Fe + Cl2 → FeCl3 |
5
9
4
7 | 
|
(проверка заданий: Шифровка № 1 – N, № 2 – P, № 3 – O за правильный ответ - 2 балла)
3. Этап – «Угадай слово».
| Задание: | к какому типу химических реакций нужно отнести уравнения, приведенные в таблице. Таблица «Угадай слово» есть в схеме – конспекте урока. Необходимо правильно определить тип химической реакции, найти соответствующую букву, из букв сложить слово. |
1 Команда
Определите тип каждой химической реакции.
Из букв, которыми обозначены правильные ответы, вы получите фамилию французского химика, сформулировавшего в 1789 году независимо от Ломоносова, закон сохранения массы веществ.
| Схема химической реакции | Реакция обмена | Реакция соедине ния | Реакция разложе ния | Реакция замеще ния |
| Na + S →Na2S | К | Л | Е | К |
| Al + H2SO4→ Al 2(SO4)3 + H2 | П | Ш | Ж | А |
| H2O → H2 + O2 | Р | В | В | З |
| Na2 O + H2O→NaOH | Е | У | Л | И |
| Mg(OH)2 + H NO3→ Mg(NO3)2+ H2O | А | Б | О | Р |
| Zn+ HCl → ZnCl2 + H2 | Н | Г | У | З |
| NO + O2 → NO2 | Я | Ь | Ф | С |
| NaOH + H2SO4→ Na2SO4+ H2O | Е | Д | Х | Т |
2 команда
Определите тип каждой химической реакции.
Из букв, которыми обозначены правильные ответы, вы получите фамилию французского ученого - химика, впервые сформулировавшего в 1808 году закон постоянства состава.
| Схема химической реакции | Реакция обмена | Реакция соедине ния | Реакция разложе ния | Реакция замеще ния |
| KClO3→ KCl + O2 | А | Ю | П | С |
| CuC2 + Al → AlCl3 + Cu | К | Ф | Е | Р |
| Ba + O2 → BaO | Т | У | Ш | Б |
| MgO + HCl → MgCl2 + H2O | С | Х | Щ | Г |
| Zn + 2HCl = ZnCl2 + H2↑ | Я | Н | Э | Т |
3 команда
Определите тип каждой химической реакции.
Из букв, которыми обозначены правильные ответы, вы получите фамилию ученого, одного из основоположников атомно-молекулярного учения.
| Схема химической реакции | Реакция обмена | Реакция соедине ния | Реакция разложе ния | Реакция замеще ния |
| H2O2→ H2 + O2 | К | А | Л | Т |
| KNO3 → KNO2 + O2 | Б | У | О | И |
| Zn + HCl→ZnCl2 + H2 | Н | Е | Д | М |
| NaOH+ ZnCl2→Zn(ОН)2 + HCl | О | Л | Е | В |
| H2O + Na→ NaOH + H2 | В | У | А | Н |
| Al + O2→Al2O3 | И | О | Й | Т |
| Cu + O2→ CuO | Р | С | Ш | Я |
| Fe2O3 + H2→ Fe + H2O | Г | Д | Ф | О |
| BaCl2 + H2SO4→ BaSO4 + HCl | В | Х | М | Р |
Таблица «Угадай слово».
| Уравнения реакций | Типы химических реакций |
| соеди- нения | разло- жения | заме- щения | обмена |
| Mg + 2HCl → MgCl2 + H2 | Б | В | П | З |
| 2Fe(OH)3 → Fe2O3 + 3H2O | Г | И | К | Д |
| 2Ca + O2 → 2CaO | С | Ж | С | Ф |
| K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3 | Н | У | Т | Ь |
| 2HgO → 2Hg + O2 | А | М | Р | П |
| Br2 + 2KI → 2KBr + I2 | Ш | Л | О | И |
(Ответ: ПИСЬМО)
4. Этап – «Письмо».
| Видеофрагмент | Это письмо от одного из персонажей Н.В.Гоголя пьесы «Ревизор», от Аммоса Федоровича Ляпкина-Тяпкина. Все знают этого судью, но не все знают, что он очень увлекается химией. Вот что он «пишет»:
«Многоуважаемые коллеги-химики! Недавно я познакомился с одним из типов химических реакций – реакциями обмена. Несмотря на мои обширные познания в области химических наук, у меня возникла проблема: в моем распоряжении есть следующие реактивы – растворы серной кислоты, карбоната натрия, хлорида магния, гидроксида натрия. Все эти вещества сложные и, следовательно, они должны вступать в реакции обмена, но на практике оказалось, что не все они между собой взаимодействуют или… взаимодействуют, но я ничего не наблюдал. Почему? Чего я не учел? Помогите мне, пожалуйста, разрешить мою проблему. Буду вам премного благодарен. Искренне ваш коллега – судья А.Ф. Ляпкин-Тяпкин. R.S. Вместе с письмом высылаю вам все перечисленные реактивы.»
(реакции обмена)
(условия протекания реакций обмена – выделение газа, выпадение осадка, образование воды)
|
| Задание: | С реактивами, полученными от Ляпкина-Тяпкина, давайте проведем лабораторные опыты, иллюстрирующие случаи, когда можно наблюдать реакции обмена, и вы запишите соответствующие уравнения реакций с учетом правил написания реакций обмена в своих схемах-конспектах. И помните о правилах техники безопасности при выполнении лабораторных опытов – пробирки и склянки держим на уровне глаз, работаем аккуратно и с малым количеством реактивов.
Пробирка № 1 – выделение газа: H2SO4 + Na2CO3 → Пробирка № 2 – выделение осадка: Na2CO3 + MgCl2 → Пробирка № 3 – образование воды: NaOH + H2SO4 → |
В схемах – конспектах записано:
| Условия | Уравнения реакций |
| 1. Выделение газа | H2SO4 + Na2CO3 → |
| 2. Выделение осадка | Na2CO3 + MgCl2 → |
| 3. Образование воды | NaOH + H2SO4 → |
Приложение № 4
5. Этап – Химический букет.
В форме цветов записаны формулы веществ:
| Формула | АВ | А | В | СД | С | Д | СВ | АД |
| Количество цветков | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 |




АВ СД СВ АД
С
В
Д
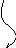
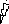


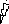

А
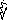

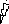
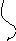
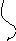
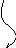
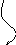

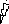

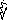
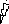


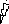
| Задание: | из химических цветов собрать соответствующие букеты химических реакций. |
|
| (на своих местах записывают схемы реакций в своих схемах – конспектах) |
На доске и в схемах – конспектах записано:
| Название «букета» | Уравнения из химических «цветов» |
| Реакция соединения |
|
| Реакция разложения |
|
| Реакция замещения |
|
| Реакция обмена |
|
Приложение № 5
6. Этап – «Химический снегопад»
«Синяя снежинка» - задание на «3»
Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Al + Cr2O3 → Al2O3 + Cr |
|
| б) Li + N2 → Li3N |
|
| в) K2S + CuCl2 → CuS↓ + KCl |
|
| г) N2O → N2 + O2 |
|
«Голубая снежинка» - задание на «4»
Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Ca + Cl2 → |
|
| б) HNO3 + Cu(OH)2 → |
|
| в) Mg + TiCl4 → |
|
| г) AgBr → |
|
«Белая снежинка» - задание на «5»
Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Mg + O2 → |
|
| б) Fe3O4 + Al → |
|
| в) H3PO4 + HCl → |
|
| г) Ba(OH)2 + H2SO4 → |
|
| д) H2O → |
|
Приложение № 6
| Задание СУПЕРИГРЫ: | суперигра – «Крестики-нолики»; за 30 секунд необходимо найти выигрышный путь, состоящий из уравнений реакций замещения |
| Fe2O3 + H2 → H2O + Fe | NO2 + H2O + O2 → HNO3 | AgNO3 → Ag + NO2 + O2 |
| Cl2 + KI → KCl + I2 | Na2SO4 + BaCl2 → BaSO4↓ + NaCl | Zn + O2 → ZnO |
| Al + HCl → AlCl3 + H2↑ | Cu(OH)2 → CuO + H2O | HCl + Zn → ZnCl2 + H2 |
Приложение № 7
Задание на «3»
Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Al + O2 → Al2O3 | реакция |
| б) MnO2 + H2 → Mn + H2O | реакция |
| в) H2O2 → H2 + O2 | реакция |
| г) HNO3 + Fe(OH)3 → Fe(NO3)3 + H2O | реакция |
Задание на «4»
Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) AgI → | реакция |
| б) MgO + H2SO4 → | реакция |
| в) Al + HCl → | реакция |
| г) Na + Cl2 → | реакция |
Задание на «5»
Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) HNO3 + Mg(OH)2 → | реакция |
| б) FeCl3 + Zn → | реакция |
| в) CH4 → | реакция |
| г) KOH + Ca(OH)2 → | реакция |
| д) Ba + O2 → | реакция |
Приложение № 8
Анкета для учащихся.
Уважаемый коллега!
Ответь, пожалуйста, на нижеперечисленные вопросы. Постарайся, чтобы твои ответы были искренними, честными и полными.
Твое отношение к сегодняшнему уроку (выбери вариант ответа):
а) отличный, интересный, захватывающий;
б) хороший, содержательный, заставляющий работать;
в) нормальный обычный;
г) скучный, работа без интереса;
д) бесполезный, совсем не интересный.
е) твой вариант ответа ____________________________________
________________________________________________________
Вспомни тему урока.
________________________________________________________
Какая цель стояла перед тобой на уроке.
________________________________________________________
________________________________________________________
Каков был план урока.
________________________________________________________
________________________________________________________
Какие события, факты, закономерности, формулы, явления, правила ты усвоил на уроке.
________________________________________________________
________________________________________________________
________________________________________________________
Чему новому ты научился на уроке.
________________________________________________________
________________________________________________________
________________________________________________________
Какие были главные мысли на уроке?
________________________________________________________
________________________________________________________
________________________________________________________
Какие ранее полученные знания ты использовал на уроке.
________________________________________________________
________________________________________________________
________________________________________________________
Какую оценку за работу на уроке ты бы поставил себе? ________
Какую оценку за работу на уроке ты бы поставил преподавателю?_
Спасибо за сотрудничество
Уважаемая Оксана Дмитриевна!
Спасибо Вам и Елене Юрьевне за подготовленную технологическую карту. Вы мастер. У Вас в колледже, наверное, их уже их разрабатывают? Ваша дидактическая игра подходит под «Общественный смотр знаний». Вы верно понимаете суть дидактической игры как вид учебных занятий, организуемых в виде учебных игр, реализующих ряд принципов игрового, активного обучения и отличающихся наличием правил, фиксированной структуры игровой деятельности и системы оценивания, один из методов активного обучения. Дидактическая игра — это такая коллективная, целенаправленная учебная деятельность, когда каждый участник и команда в целом объединены решением главной задачи и ориентируют своё поведение на выигрыш. Дидактическая игра — это активная и(или) интерактивная учебная деятельность по имитационному моделированию изучаемых систем, явлений, процессов. Для общеобразовательных дисциплин дидактическая игра особенно важна, т.к. её отличительная черта в том, что она включает конкретный учебный материал и способы оценивания в игровые действия.
Оксана Дмитриевна! Я сейчас администратор. Мне 65 лет и математику уже не веду, т.к. не хватает времени. Но когда-то играми увлекался. Посылаю Вам, как креативному педагогу, свой старый опыт. Математики должны понять суть и помогут Вам.
Еще раз, спасибо Вам за участие. Победа будет за нами!!! Ну, а замечания будут всегда. Главное понять для себя: принять или согласится? Какой сделать Вывод?
С уважением М.К.