предмет :химия
Дата 14.11.19г Урок № 19 класс-8
Тема урока: Типы химических реакций.
Цель урока. Сформировать умение классифицировать химические реакции по числу и составу исходных и полученных веществ. Научить определять тип реакции по данному химическому уравнению.
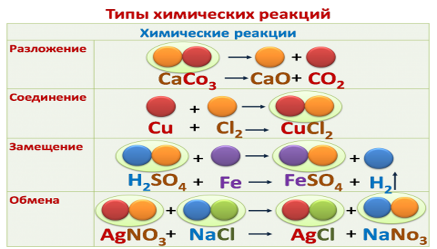
Основные понятия. Реакции разложения, соединения, замещения.
Планируемые результаты обучения
Предметные. Знать определения реакций разложения, соединения и замещения. Уметь определять тип реакции по данному химическому уравнению. Метапредметные. Развивать умения обобщать, устанавливать аналогии, классифицировать, самостоятельно выбирать основания и критерии для классификации.
Личностные. Формировать ответственное отношение к учению.
Основные виды деятельности учащихся. Записывать уравнения химических реакций различного типа. Определять тип реакции по данному химическому уравнению. Проводить простейший химический эксперимент, соблюдая правила техники безопасности.
Демонстрации. Прокаливание медной пластинки, горение магния.
Лабораторные опыты. Разложение основного карбоната меди(II).
Реакция замещения меди железом.
Оборудование и реактивы: компьютер,проектор, презентация "Типы химических реакций" (Приложение1.), на столах у учащихся инструктивная карточка для проведения исследования, набор соответствующих реактивов, штатив с пробирками.
Методы: словесный, проблемно-поисковый, наглядный, практический, исследовательский.
Ход урока
I. Организационный этап
Учитель. Здравствуйте,ребята. Сегодня у нас на уроке присутствуют учителя химии Джанкойского района. Повернитесь к гостям и поприветствуйте их. Садитесь.
II.АКТУАЛИЗАЦИЯ ЗНАНИЙ И УМЕНИЙ
Учитель. Мы с вами познакомились с основными понятиями химии.Ответьте пожалуйста на вопрос . Какие темы мы с вами изучили?.
Ответы детей (физические и химические явления. Химические реакции, признаки химических реакций. Валентность.)
Давайте проверим ваши знания. Я предлагаю вам открыть рабочие тетради,запишите число, классная работа и выполните задания. На выполнение задания вам дается 8 минут. ( слайд №1)
1.Выберите правильный ответ.
а). Чем химические реакции отличаются от физических явлений?
Изменение формы, агрегатного состояния вещества
Образование новых веществ
Изменение местоположения
б). Каковы признаки химической реакции?
Образование осадка, изменение цвета, выделение газа
Намагничивание, испарение, колебание
Рост и развитие, движение, размножение
в).Химическим уравнением называют
Условную запись химической реакции
Условную запись состава вещества
Запись условия химической задачи
2. Составить формулу, зная валентности химических элементов:
IV II III I I II III I III II
СО; NH; NaO; РСl; В О.
Найти Мr (Р2О5) и рассчитайте массовую кислорода и фосфора.
Учитель. Вы выполнили работу. Я предлагаю вам осуществить ее проверку. Поменяйтесь тетрадями и осуществите взаимопроверку. Внимание на экран. За каждый правильный ответ – задание 1 -1 балл задание2- 2балла задание 3-3 балла . Общее количество баллов занесите в оценочный лист.
(2 слайд) ответы на задания
задание 1 (2, 1, 1)
задание 2 СО2; NH3; Na2 O; РСl3; В 2О3
задание 3 Мr(Р2О5) = 2Ar (P)+5Ar(O) =2*31+5*16=142
W (Р)= 2Ar (P)/ Мr(Р2О5)*100%= 2*31/142 *100%=43,7%
W(O)= 5Ar(O)/ Мr(Р2О5)*100%= 5*16/ 142 **100% =56,3%
Ответ:56,3%,43,7%
С заданием справились. Молодцы. Переходим к следующему этапу нашего урока. III. Мотивационный этап
Учитель:
Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром .
О чем же пойдет речь на сегодняшнем уроке? (3 слайд)
Чтобы ответить на этот вопрос, попробуйте отгадать загадку:
" Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
Беседа
Учитель:
Великое множество различных реакций окружает нас в жизни
Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций)
Что такое классификация? (Деление на группы)
Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Учитель. Мы сегодня продолжим изучать химические реакции и познакомимся с типами химических реакций и их классификацией.
Запишите тему урока в тетрадь. Типы химических реакций.
Работа с учебником. Откройте учебник на странице 69.
Выпишите в тетради типы химических реакций . (4 слайд)
Внимание на экран. записываем определение и примеры по типам химических реакций. (5 слайд)
Введение понятия реакции соединения. Учащиеся записывают определение и уравнения реакций.
реакции соединения ( железо+сера) показываю демонстрационный опыт, вызываю ученика для записи химической реакции.
Введение понятия реакции разложения демонстрация разложение гидроскида меди. Записываем уравнение реакции
физ.минуткавозвращаемся к ( слайд 5) Введение понятия реакции замещения.Учащиеся записывают определение и уравнения реакций. ( слайд 5) Чуть позже вы выполните лабораторную работу. Введение понятия реакции обмена Учащиеся записывают определение и уравнения реакций. Демонстрация CuSO4+2NaOH=Cu(OH)2 + Na2SO4учащиеся записывают уравнение реакций.А теперь проведем лабораторную работу и определим, к какому типу принадлежат реакции проведенные вами.
Прежде чем перейдем к выполнению лабораторной работы повторим правила техники безопасности( слайд 6)
Инструктивная карточка для проведения опыта:( слайд 7) Лабораторный опыт №6. 1.в пробирку с гироксидом натрия опустите полоску фенолфталеинового индикатора. Что наблюдается? Затем по каплям приливайте к щелочи соляную кислоту до тех пор, пока раствор не обесцветится. О чем свидетельствует исчезновение окраски индикатора?
Лабораторный опыт №7 Железный гвоздь (Fe) опустите в раствор сульфата меди (II) (CuSO4 ). Через 2 минуты выньте гвоздь. Что наблюдаете? Кирпично-красный цвет налета на гвозде говорит об образовании чистой меди. Спрогнозируйте, что образовалось еще? Запишите уравнения реакции. Определите тип реакции. Укажите признаки, по которым вы определили, что реакция прошла?
Ответы к заданиям лабораторных опытов ( слайд 8) (самопрверка) (правильное рассуждение и написание химической реакции -5 баллов, одна ошибка-4 балла, две ошибки 3 –балла)
IV. ЗАКРЕПЛЕНИЕ ЗНАНИЙ
Этап выявления существенных признаков для определения типов химических реакций.
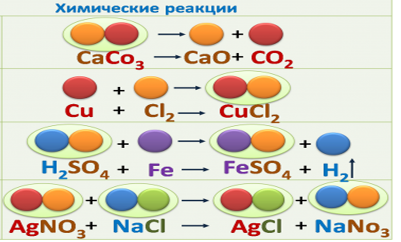
На экране представлены несколько химических реакций:(слайд №9)
2H2 + O2 - 2H2O; CaO + H2O -Ca(OH)2 Cu(OH)2 -CuO + H2O; 2HgO - 2Hg + O2
- можно ли выделить признак, по которому эти реакции, можно, разделить на группы?
- различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
На экране появляется (слайд №10) на котором представлены реакции:
(1) 2H2 + O2- 2H2O; (2) 4P + 5O2 - 2P2O5; (3) Na2O + SO3 - Na2SO4;
(4) CaO + H2O -Ca(OH)2
Обсуждаются вопросы:
- что объединяет все эти реакции? - в чём их отличие?
- как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом - сложные вещества. Во всех реакциях образуется одно сложное вещество.
обобщение материала. Итак, мы узнали, как классифицируют химические реакции слайд №11 ответ слайд №12
 .
.
Учитель. Работа учащихся у доски
Учитель. Теперь давайте вернемся к нашей цели .
Отметьте как вы считаете на сколько мы с вами достигли цели урока.
ИТОГ УРОКА
Учитель. Вы справились хорошо с заданиями. Сейчас подсчитайте общее количество набранных баллов за урок и поставьте себе оценку в оценочный лист.
Оцените свою работу на уроке: 17-19балл –оценка «5» 13-16 баллов – оценка «4» 9-12 баллов – оценка «3»
IV. РЕФЛЕСИЯ(слайд №13)
1. На уроке я работал
2. Своей работой на уроке я
3. Урок для меня показался
4. За урок я успел
5. Мое настроение
6. Материал урока мне был
VII. Домашнее задание. Итоги урока. Выставление оценок.(слайд №14)
Учитель. Наш урок подошел к концу. И, как финальная точка, запишите домашнее задание §21, зад. 1 – для тех, кто получил оценку «3»
зад.2– для тех, кто получил оценку «4»
зад. 3 – для тех, кто получил оценку «5» стр.71






 .
.



















