Просмотр содержимого документа
«Урок химии 11 класс "Строение атома"»
Строение атома
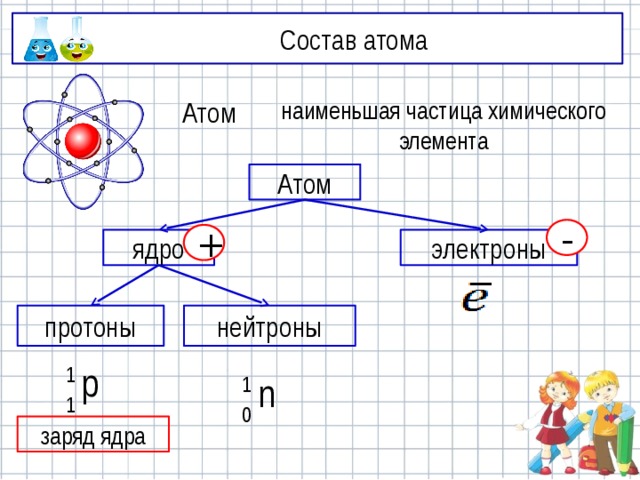
Состав атома
Атом
наименьшая частица химического элемента
Атом
-
+
электроны
ядро
протоны
нейтроны
p
1
n
1
1
0
заряд ядра

Состав атома
порядковый номер
массовое число
1
p
p
1
=
заряд ядра (порядковый номер элемента)
=
13
1
1
13
=
ē
ē
=
число протонов
p
1
1
n
-
=
массовое число
0
1
n
1
-
=
27
13
=
14
0
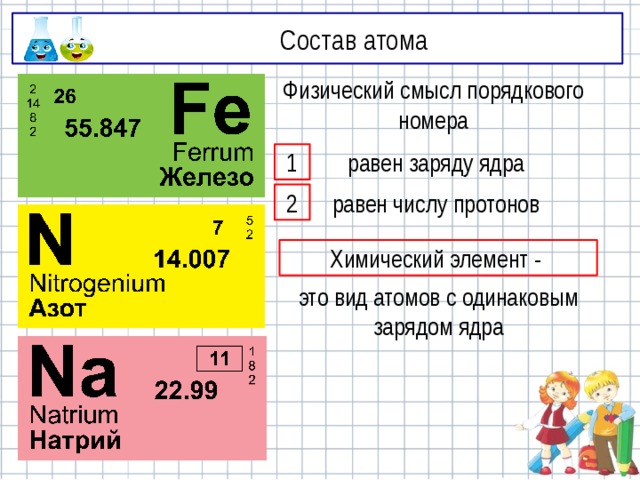
Состав атома
Физический смысл порядкового номера
1
равен заряду ядра
2
равен числу протонов
Химический элемент -
это вид атомов с одинаковым зарядом ядра

Состав атома
p
1
=
16
1
16
=
ē
n
1
=
32
-
16
=
16
0
Изотопы
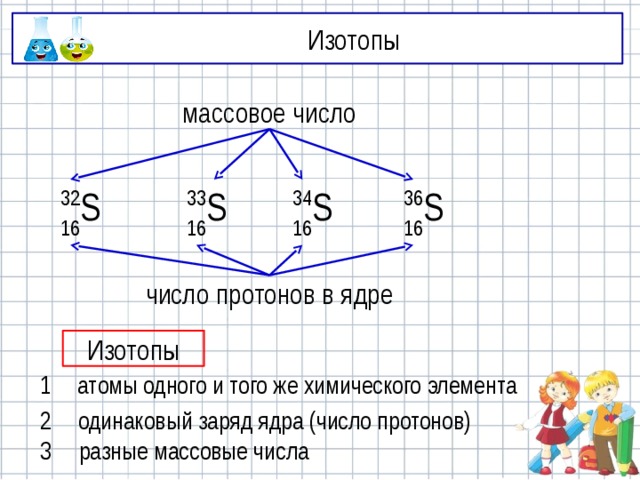
Изотопы
массовое число
33
34
S
36
S
32
S
S
16
16
16
16
число протонов в ядре
Изотопы
1
атомы одного и того же химического элемента
2
одинаковый заряд ядра (число протонов)
3
разные массовые числа
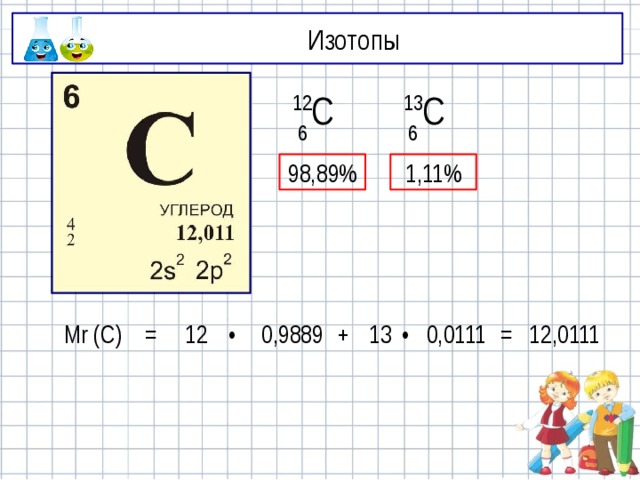
Изотопы
С
12
С
13
6
6
1,11%
98,89%
Mr (С)
=
12
•
0,9889
+
13
•
0,0111
=
12,0111
Состояние электронов в атоме
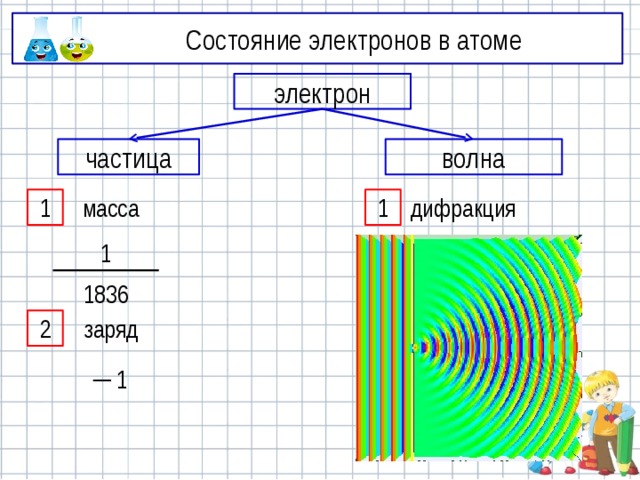
Состояние электронов в атоме
электрон
частица
волна
1
1
масса
дифракция
1
1836
2
заряд
─ 1

Атомные орбитали
Электронное облако
Атомная орбиталь -
та часть электронного облака, в которой вероятность нахождения электрона составляет 90-95%
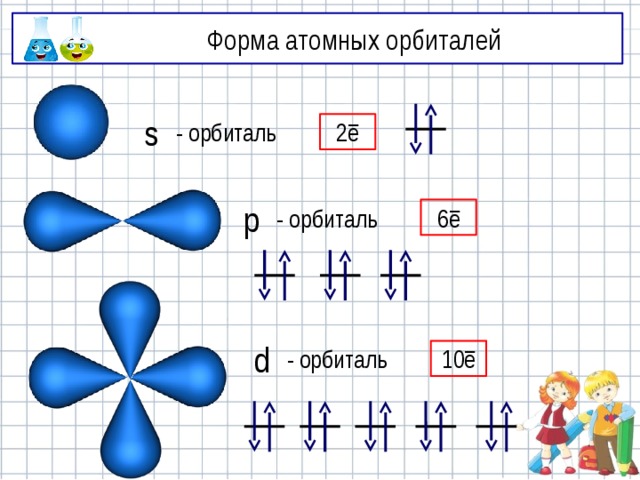
Форма атомных орбиталей
2 ē
- орбиталь
s
6 ē
- орбиталь
p
- орбиталь
10 ē
d

Форма атомных орбиталей
14 ē
f
- орбиталь

Энергетические уровни и подуровни
Число энергетических уровней
=
№ периода
Число ē на энергетическом уровне
I период
N = 2n 2
N – общее число ē на энергетическом уровне
+
n – номер энергетического уровня
N 1 = 2•1 2 = 2
2

Энергетические уровни
II период
N 2 = 2•2 2 = 8
+
2
8

Энергетические уровни
III период
N 3 = 2•3 2 = 18
+
2
8
18
8

Энергетические уровни
I V период
N 4 = 2•4 2 = 32
+
2
8
18
32
8

Энергетические уровни
V период
+
2
8
18
32
32
8

Энергетические уровни
VI период
+
32
32
8
32
18
2
8

Энергетические уровни
VII период
+
2
8
18
32
32
32
8

Энергетические подуровни
Число энергетических подуровней
№ уровня
=
d
f
s
p
d
p
f
s
s
d
f
s
p
d
p
s
d
p
s
f
s
p
+
3
7
2
1
4
5
6
2
8
32
18
32
8
32

Энергетические подуровни
E f
‹
E d
‹
‹
E p
E s
d
p
s

Электронные конфигурации атомов
1
Определить положение химического элемента в ПСХЭ
Н
I группа главная подгруппа, I период
2
Построить схему строения атома
Н
+1
1
Электронные конфигурации атомов
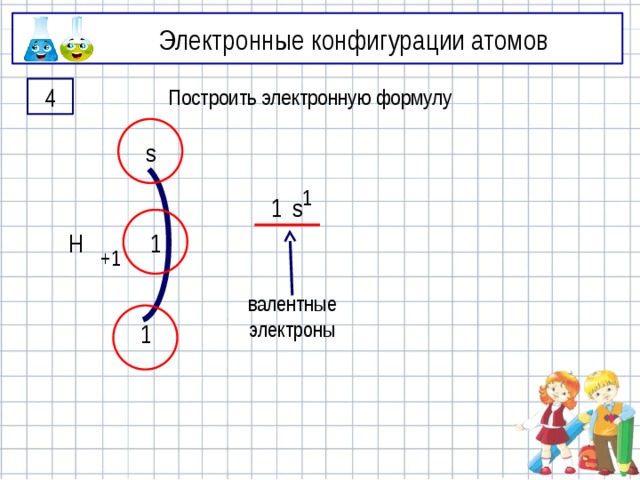
4
Построить электронную формулу
s
1
s
1
1
Н
+1
валентные электроны
1
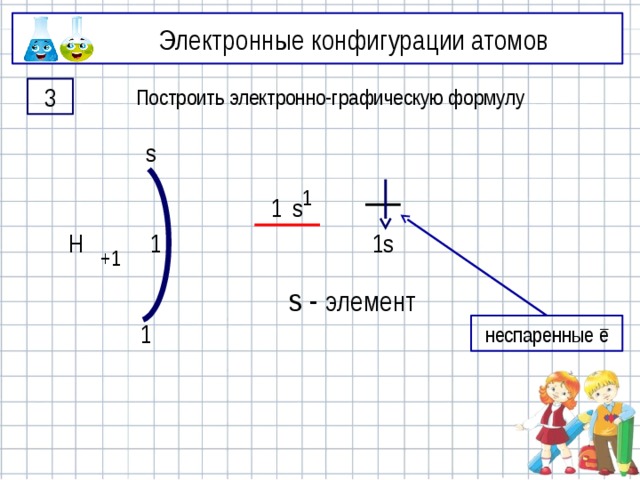
Электронные конфигурации атомов
3
Построить электронно-графическую формулу
s
1
1
s
1
1s
Н
+1
s - элемент
1
неспаренные ē
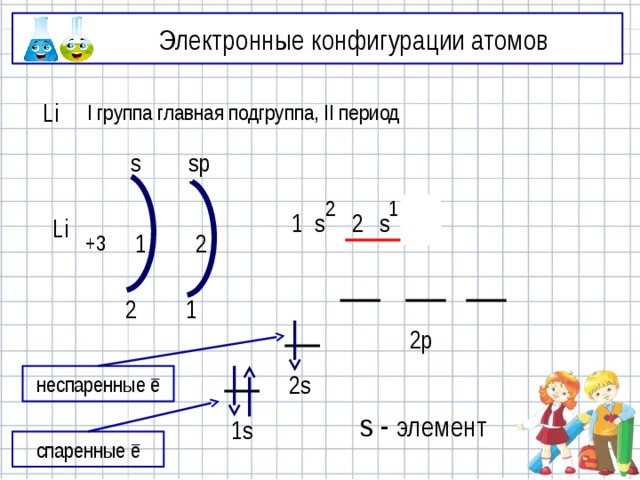
Электронные конфигурации атомов
I группа главная подгруппа, II период
Li
s
sp
0
2
1
s p
2
1
s
Li
2
+3
1
2
1
2p
2s
неспаренные ē
s - элемент
1s
спаренные ē

Электронные конфигурации атомов
B
III группа главная подгруппа, II период
s
sp
1
2
2
2
s p
1
s
B
2
+5
1
2
3
2p
2s
p - элемент
1s

Электронные конфигурации атомов
N
V группа главная подгруппа, II период
s
sp
3
2
2
s p
2
1
s
N
2
1
+7
2
5
2p
2s
p - элемент
1s

Электронные конфигурации атомов
O
VI группа главная подгруппа, II период
s
sp
4
2
2
s p
2
1
s
O
1
2
+8
2
6
2p
2s
p - элемент
1s

ЕГЭ
Вопрос 1

ЕГЭ
Вопрос 1
1
1)Sn 2) Pb 3) Ca 4) Ba 5) Sr
Определите, какие из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns 2 np 2
Запишите в поле ответа номера выбранных элементов.
ЕГЭ
Вопрос 2
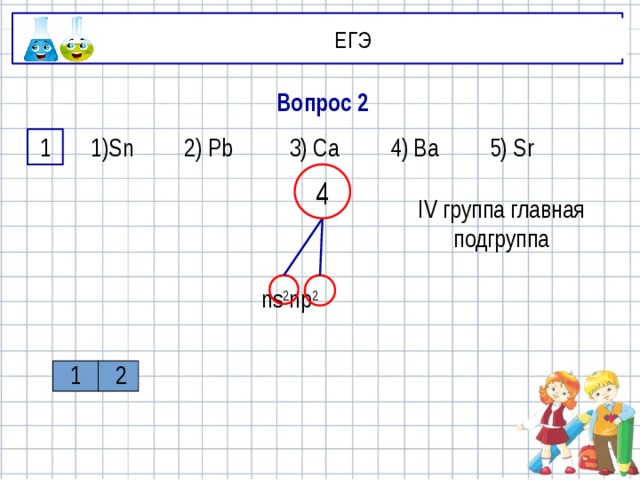
1
1)Sn 2) Pb 3) Ca 4) Ba 5) Sr
4
IV группа главная подгруппа
ns 2 np 2
2
1

Домашнее задание
§ 1-3



























































