Урок «Коррозия металлов»
Недостаточно только получить знания; надо найти им приложение.
Недостаточно только желать; надо делать.
И. Гёте
Данный урок проводился в 9 классе по программе Габриеляна О.С. Урок рассчитан на 2 часа. Этой теме предшествовали уроки по темам: «Физические свойства металлов», «Сплавы», «Общие химические свойства металлов», «Получение металлов».
Тип урока: изучение и первичное закрепление новых знаний.
Технология: элементы личностно-ориентированного, проблемного обучения, информационных технологий.
Оборудование и материалы:
ТСО: Компьютер, интерактивная доска, иллюстрации из Единой коллекции ЦОР: http://school-collection.edu.ru/catalog/rubr/d05469af-69bd-11db-bd13-0800200c9c09/75748/?interface=catalog&class=51&subject=31.
Оборудование: спиртовки, держатели для пробирок, спички, штативы, пробирки, гвозди, медная проволока, медная и серебряная монеты;
Реактивы: пробирки с заранее (за 2 дня) подготовленными учащимися образцами эксперимента по изучению условий коррозии:
пробирка №1 - железный гвоздь в воде, пробирка плотно закрыта;
пробирка №2 - железный гвоздь в воде, пробирка не закрыта;
пробирка №3 - железный гвоздь в растворе хлорида натрия;
пробирка №4 - железный гвоздь, обвитый медной проволокой, в растворе хлорида натрия;
пробирка №5 - железный гвоздь, обвитый алюминиевой проволокой, в растворе хлорида натрия;
пробирка №6 - железный гвоздь находится в растворах хлорида и гидроксида натрия.
Компьютерные презентации по теме «Коррозия металлов», подготовленные учащимися.
Бланки-задания для выполнения домашней работы (Приложение1).
Форма организации учебной деятельности: фронтальная, групповая, индивидуальная.
Цель урока:
- изучение основных закономерностей процесса коррозии, значения коррозии в жизни человека и возможных способов защиты металлических изделий от коррозии.
Задачи:
изучить сущность химической и электрохимической коррозии металлов, закрепить представления об окислительно-восстановительных реакциях.
продолжить развитие умений проведения химического эксперимента с соблюдением правил Техники безопасности и прогнозирования его результатов, коммуникативных умений в ходе коллективного обсуждения;
продолжать формирование познавательной активности, интереса к предмету, убеждений учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире,
В результате изучения темы «Коррозия металлов», необходимо:
знать: понятие о коррозии, ее видах и способах защиты металлов от коррозии; условия, способствующие и препятствующие коррозии.
уметь: характеризовать условия и способы предупреждения коррозии металлов.
Ход урока:
Учитель: Здравствуйте! Ребята, как вы думаете, что общего в этих изображениях? (изображения демонстрируются на интерактивной доске)





Верно, это изделия из сплавов металлов. А как вы думаете, подвержены ли они влиянию окружающей среды? Верно, вот что происходит со временем с металлами и сплавами


- они разрушаются. Кто из вас знает, как называется такой процесс? «Коррозия металлов» - это тема нашего урока. Запишите в тетрадь дату и тему урока. Цель нашей работы сегодня «Изучение основных закономерностей процесса коррозии, значения коррозии в жизни человека и возможных способов защиты металлических изделий от нее».
Коррозия или как ее иногда называют - «Рыжий дьявол» - это давний и очень опасный враг большинства металлов, применяемых в быту, технике и на производстве. Коварство этого извечного врага в том, что, невидимый, он остается всегда целым и невредимым, а металлы и сплавы несут огромные потери.
Чтобы победить врага, необходимо проникнуть во все его тайны. Поэтому эпиграфом к нашему уроку выбрано высказывание Гёте: «Недостаточно только получить знания; надо найти им приложение. Недостаточно только желать; надо делать».
Сообщение о вреде коррозии с презентацией (задание выдано ученикам на предыдущем уроке, одному или группе, подготовка презентации по желанию). Примерное содержание сообщения:
По подсчетам экономистов, ущерб, наносимый коррозией, во много раз превышает потери даже от такого страшного стихийного бедствия, как пожары! Да это и неудивительно, ведь огонь буйствует сравнительно редко, а коррозия действует постоянно, ни на один час, ни на одно мгновение не прекращая свою подрывную деятельность. Около четверти всех производимых в мире металлов и сплавов – это 30 млн тонн – становятся ежегодно жертвами коррозии. Она их уничтожает! Существенные убытки она причиняет даже косвенно. Вспомните хотя бы утечку нефти и газа из съеденного коррозией трубопровода. Коррозия досрочно выводит из строя детали, оборудование и целые сооружения. Знаменитая Эйфелева башня – символ Парижа - неизлечимо больна, только постоянная химиотерапия помогает бороться со смертельным недугом, источник которого коррозия. Башню красили уже 18 раз, отчего ее масса (9 тыс тонн) каждый раз увеличивается на 70 тонн
Потери от коррозии в сотни раз превосходят стоимость самого металла, так как они означают напрасный труд людей, создавших конструкцию, и предполагают дополнительный труд по замене проржавевших изделий, потери готовой продукции, загрязнение окружающей среды. (Можно использовать ЦОР).
Учитель: Чтобы успешно бороться с коррозией, о ней нужно много знать. Прошу открыть выданные вам учебники Рудзитиса на стр 116-118 и учебники Габриеляна на стр 41-42. После знакомства с данными о коррозии в учебниках вы должны выписать в тетрадь определение коррозии, предложить классификацию по протекающим процессам, записать уравнения реакций, характеризующие их химизм. Вам для этой работы потребуется 7 минут. Работаете в парах.
По окончании работы один из вас запишет полученную информацию на доске, а второй ученик пояснит эти записи. (Пример записи на доске и в тетради): 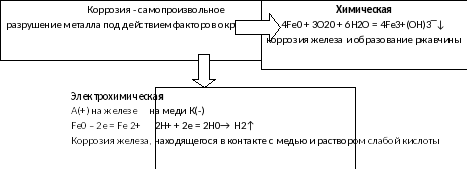
Сравните полученные сведения с тем, что записано в ваших тетрадях. У кого есть замечания, дополнения?
Изучение и объяснение любого явления – всегда очень длительный процесс. Мы сейчас познакомимся с историей изучения процесса коррозии.
Сообщение об истории изучения коррозии с презентацией (задание выдано ученикам на предыдущем уроке, одному или группе, подготовка презентации по желанию). Примерное содержание сообщения:
Люди издавна интересовались вопросами коррозии и защиты металлов от нее. В Древнем Египте было замечено, что латунные изделия (сплав меди и цинка) со временем покрываются слоем губчатой меди, а цинк окисляется. В средние века было распространено отбеливание монет из сплава меди с серебром в растворе винного камня, при этом медь растворялась, а на поверхности монеты оставалось серебро. Древнегреческий историк Геродот и древнеримский ученый Плиний Старший упоминают о применении олова для защиты железа от ржавчины. Средневековые алхимики мечтали о получении нержавеющего железа.
Интересный способ превращения железа в сталь через ржавление в земле был известен людям с глубокой древности. Черкесы, например, закапывали полосовое железо в землю, а, откопав его через 10-15 лет, выковывали из него сабли, которые могли перерубить даже ружейный ствол, щит, кости врага. В земле железо, конечно, ржавело, но одновременно оно насыщалось углеродом и азотом при контакте с веществами почвы. После выкапывания ржавое железо нагревали в горнах, ковали, а затем охлаждали водой – закаляли. Позднее перешли к плавке железа под слоем древесного угля, вместо закапывания в землю.
Уже в 20-х годах XIX века электрохимическую коррозию изучают Гемфри Дэви и Майкл Фарадей, и многие другие ученые. Однако правильной, научно обоснованной, теории электрохимической коррозии не было. Существовала лишь теория, выдвинутая в 1830 году швейцарским ученым Де ла Ривом, оказавшаяся неверной, согласно которой подвергаться коррозии может лишь металл, в котором есть инородные включения. В начале 30-х годов XX века советский ученый Александр Наумович Фрумкин, изучая амальгамы металлов (сплавы со ртутью), показал, что активный металл амальгамы растворяется в кислотах, хотя амальгама – однородный сплав. В 1935 году А.И.Шултин объяснил коррозию как индивидуальных металлов, так и сплавов. Он рассмотрел механизм протекания процесса коррозии и факторы, влияющие на его скорость.
В том же 1935г Я.В.Дурдин подтвердил растворение металлов в кислотах без наличия инородных включений. Т.о., советские ученые, в первую очередь А.И.Шултин и Я.В.Дурдин, сформулировали теорию электрохимической коррозии металлических материалов. (Можно использовать ЦОР).
Учитель: Вы знаете, что химия – наука экспериментальная. Большинство процессов, протекающих в природе, быту и на производстве мы можем воспроизвести в лаборатории. Но для многих из них требуется большой промежуток времени, чтобы получить результат. 2 дня назад группа ваших одноклассников-экспертов заложила эксперимент, связанный с коррозией железа, т.к. он длителен по времени. Осторожно, не встряхивая, подвиньте к себе штативы, давайте послушаем объяснение наблюдаемых процессов и их причины.
Примерные комментарии учащегося из группы экспертов по закладке опыта:
При закладке опыта мы создали разные условия, в которых находился железный гвоздь:
пробирка №1 - железный гвоздь в кипяченой воде, пробирка плотно закрыта;
пробирка №2 - железный гвоздь в кипяченой воде, пробирка не закрыта;
пробирка №3 - железный гвоздь в растворе хлорида натрия;
пробирка №4 - железный гвоздь, обвитый медной проволокой, в растворе хлорида натрия;
пробирка №5 - железный гвоздь, обвитый алюминиевой проволокой, в растворе хлорида натрия;
пробирка №6 - железный гвоздь находится в растворах хлорида и гидроксида натрия.
В каких пробирках гвоздь прокорродировал, а в каких нет? Почему? Почему в одних случаях коррозия усиливается, а в других замедляется? Что усиливает коррозию? Что замедляет ее?
Примерные объяснения ученика из группы экспертов, при желании с презентацией:
В пробирке №1 – железо практически не прокорродировало, водопроводная вода – слабый электролит, без доступа кислорода коррозия практически не идет.
В пробирке №2 – железо прокорродировало слабо, в чистой воде с доступом кислорода коррозия идет. Мы наблюдаем химическую коррозию.
В пробирке №3 - железо прокорродировало сильнее, чем во 2 пробирке, так как хлорид натрия сильный электролит, то коррозия в нем идет быстрее, чем в воде. Мы наблюдаем химическую коррозию, но здесь коррозия больше, следовательно, хлорид натрия – увеличивает скорость коррозии.
В пробирке №4 - железо (находилось в контакте с медью, в растворе хлорида натрия) прокорродировало, образовалось много ржавчины, так как хлорид натрия сильный электролит, то коррозия в нем идет быстрее, особенно в случае контакта железа с медью - менее активным металлом. Мы наблюдаем электрохимическую коррозию. Скорость коррозии высока, т.к. раствор хлорида натрия – сильный электролит, а медь - менее активный металл, чем железо.
В пробирке №5 - железо не прокорродировало, ржавчины не образавалось, так как железо находилось в контакте с алюминием - более активным металлом, то даже в сильнокоррозионной среде железо оказывается защищенным до тех пор, пока коррозии подвергается алюминий. В данном случае также наблюдается электрохимическая коррозия, но корродирует не железо, а алюминий, т.к. железо менее активный металл.
В пробирке №6 - железный гвоздь находился в растворах хлорида и гидроксида натрия. Железо практически не подверглось коррозии, можно предположить, что гидроксид натрия – замедляет коррозию, причина -наличие гидроксид-ионов, которые и являются ингибиторами.
Таким образом, коррозия идет активно, если присутствует кислород, процесс идет в среде сильного электролита, есть контакт с менее активным металлом. Коррозия идет медленно или отсутствует, если есть контакт с более активным металлом или присутствует ингибитор. (Можно использовать ЦОР).
Учитель: Великий Гете сказал: «Просто знать – еще не все, знания нужно уметь использовать». Давайте попробуем применить полученные сегодня знания для борьбы с коррозией. Какие меры борьбы с коррозией вам известны? Основные методы защиты металлов от коррозии записываем по ходу сообщения.
Сообщение о мерах борьбы с коррозией с презентацией (задание выдано ученикам на предыдущем уроке, одному или группе, подготовка презентации по желанию). Примерное содержание сообщения:
Защита более активным металлом. Протекторы – слитки более активного металла, чем обшивка днища корабля (чаще – цинк)
Защита малоактивным металлом, но нельзя допускать нарушения целостности покрытия
Отделение металла от агрессивной среды (смазка, окраска, покрытие лаками, эмалями)
Использование ингибиторов (чаще орг.вещества или неорг.соли)
Электрозащита – нейтрализация тока, возникающего при коррозии, постоянным током в противоположном направлении) Так защищают нефте- и газопроводы
Пассивация металлов – образование плотно прилегающих оксидных пленок.
Изготовление сплавов, стойких к коррозии. (Можно использовать ЦОР).
Примерная запись в тетради:

Итак, ребята, мы многое узнали о коррозии. Оказывается, не такая уж она непобедимая, как это кажется на первый взгляд. Но коррозия бывает и полезна. Реабилитировать ее попытается …
Сообщение о применении коррозии с презентацией (задание выдано ученикам на предыдущем уроке, одному или группе, подготовка презентации по желанию). Примерное содержание сообщения:
Коррозия может не только вредить, но и служить человеку. Индийские ученые научились превращать ржавчину в защитное покрытие. Для этого на изделие, покрытое слоем ржавчины, наносят специальный состав, благодаря которому слой ржавчины становится прочным панцирем, на него наносят слой краски, которая лучше держится, чем непосредственно на металлической поверхности. И крыше, покрытой железом, дают сначала немного заржаветь, а только потом красят.
Существует особая обработка металлов, когда в специально подобранном электролите ток энергично растворяет металл, т.е. идет коррозия. За короткое время возникает профиль детали, при этом очень высокая чистота обработки и скорость в 5-15 раз больше, чем при резании.
Сама ржавчина на низколегированных сталях крепко сцепляется с металлом и защищает его от дальнейшей коррозии.
Учитель: Сейчас я попрошу вас, используя записи в тетради, вспомнив то, о чем услышали сегодня ответить на вопросы:
Что такое коррозия? Какие виды коррозии вы знаете?
При каких условиях коррозия протекает особенно интенсивно?
Почему луженый (покрытый оловом) бак в местах повреждения быстро ржавеет, а оцинкованный – нет?
Почему стоматологи не поставят рядом со стальной золотую коронку?
Домашнее задание: записи в тетради. Статья параграфа 10. Заполните отчет по проведенной практической работе на бланке «Эксперимент». Ответьте письменно на вопросы теста, подготовьте устные ответы на вопросы, пользуясь дополнительными источниками информации. (Приложение 1)
Все, кто готовил сообщения, презентации и эксперимент, получают оценку, в соответствии с вкладом в работу группы.
Я надеюсь, что те знания, которые вы сегодня получили, пригодятся вам в быту и в дальнейшем на производстве. «Недостаточно только получить знания; надо найти им приложение. Недостаточно только желать; надо делать». Хотелось бы, чтобы эти слова И.Гёте вы приняли как руководство к действию.
Приложение1
Эксперимент:
Перед вами 6 пробирок. В каких пробирках гвоздь прокорродировал, а в каких нет? Почему? Объясните, что происходит в каждой пробирке. Что усиливает коррозию? Что замедляет коррозию?
Пробирка № 1. Кипяченая вода + железный гвоздь, пробирка закрыта пробкой, т.е. не возможен доступ воздуха. Железо не прокорродировало, так как чистая вода - слабый электролит, доступ воздуха в пробирку закрыт, то коррозия практически не идет.
Пробирка № 2. Кипяченая вода + железный гвоздь. Железо прокорродировало _ _ __, так как чистая вода слабый электролит, то коррозия в ней идет очень медленно. В данном случае наблюдается _ _ _ _ _ _ _ _ _ _ коррозия
Пробирка № 3. Раствор хлорида натрия (NaCl) + железный гвоздь. Железо прокорродировало _ _ _ _ _ _ _, так как хлорид натрия _ _ _ _ _ _ _ электролит, то коррозия в нем идет _ _ _ _ _ _ _. В данном случае наблюдается _ _ _ _ _ _ _ _ _ _ коррозия
Пробирка № 4. Раствор хлорида натрия (NaCl) + железный гвоздь обвитый медной проволокой. Железо прокорродировало, образавалось _ _ _ _ ржавчины, так как хлорид натрия _ _ _ _ электролит, то коррозия в нем идет _ _ _ , особенно в случае контакта с медью - _ _ _ _ _ активным металлом. В данном случае наблюдается _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ коррозия
Пробирка № 5. Раствор хлорида натрия (NaCl) + железный гвоздь обвитый алюминиевой проволокой. Железо не прокорродировало, ржавчины не образавалось, так как железо находится в контакте с алюминием - _ _ _ _ активным металлом, то даже в сильнокоррозионной среде железо оказывается защищенным до тех пор, пока коррозии подвергается алюминий. В данном случае наблюдается _ _ _ _ _ _ _ _ _ _ _ _ _ коррозия
Пробирка № 6. Раствор хлорида натрия (NaCl) + раствор щелочи + железный гвоздь. Железо не прокорродировало, ржавчины не образавалось, так как ионы ОН- являются ингибиторами – замедлителями коррозии
(слабо; химическая; сильнее; сильный; быстрее; химическая; много; сильный; быстрее; менее; электрохимическая; более; электрохимическая)
Таким образом, коррозия идет активно, если
Коррозия идет медленно или отсутствует, если
(Присутствует кислород. Контакт с менее активным металлом. Среда сильного электролита. Присутствует ингибитор. Контакт с более активным металлом.)
1. Выполните тест:
1. Слово “коррозия” в переводе с латинского означает:
а) разрушать; б) окислять; в) разъедать; г) ржаветь.
2. Окисление металла в среде не электролита:
а) электрохимическая коррозия; б) язвенная коррозия;
в) точечная коррозия; г) химическая коррозия.
3. Разрушение металла, находящегося в контакте с другим металлом в присутствии водного раствора электролита:
а) газовая коррозия; б) химическая коррозия;
в) сплошная; г) электрохимическая коррозия;
4. Эмалирование это:
а) способ предания красоты металлическому изделию;
б) электрохимический метод защиты металлов от коррозии;
в) защитное неметаллическое покрытие металла;
г) защитное металлическое покрытие металла.
5. Легирование это:
а) специальное введение в сплав элементов, замедляющих процесс коррозии;
б) покрытие железного листа слоем олова;
в) создание контакта с более активным металлом;
г) покрытие металла краской.
6. Вещества, замедляющие процесс коррозии называются:
а) ингибиторы; б) электроды; в) протекторы; г) краски.
7. Присоединение к защищаемому металлу другого, более активного металла называется:
а) металлопокрытие; б) контактная защита;
в) легирование; г) протекторная защита.
2. Подготовьте устные ответы на следующие вопросы:
- Сияющие золотые купола православных церквей символизируют пламя свечи – знак обращения души верующего к Богу. Какие цели преследовало золочение куполов? Что в данном случае важнее – польза или красота? Какие физико-химические свойства золота делают возможным золочение?
- Скульптуры из бронзы создавались еще в глубокой древности. В XIX веке для отливки статуй начали применять чугун (например, памятник князю Владимиру в Киеве). XX век вооружал скульпторов нержавеющей сталью и титаном (монумент покорителям космоса в Москве). Какой из перечисленных материалов в наибольшей степени подвержен коррозии, а какой – в наименьшей?
- Почему поверхность статуи, отлитой из бронзы, содержащей даже незначительное количество цинка, со временем покрывается белыми точками?
- В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса. У Колосса Родосского бронзовая оболочка была смонтирована на железном каркасе. Колосс Родосский считался одним из семи чудес света, однако просуществовал всего 66 лет и рухнул во время землетрясения. С чем связана столь скоротечная жизнь этого чуда света?

































