Алгоритм решения расчётных задач "на смеси". Учащиеся при изучении данной темы необходимо:
Знать: состав воздуха, понимать различие между массовой и объемной долей.
Уметь: определять массовую долю растворенного вещества; производить расчеты, связанные с понятием «массовая доля»
Просмотр содержимого документа
«Алгоритмы решения расчётных задач по химии. МАССОВАЯ И ОБЪЕМНАЯ ДОЛИ КОМПОНЕНТОВ СМЕСИ (ДОЛЯ ПРИМЕСЕЙ)»
Алгоритмы решения расчётных задач по химии
МАССОВАЯ И ОБЪЕМНАЯ ДОЛИ КОМПОНЕНТОВ СМЕСИ
(ДОЛЯ ПРИМЕСЕЙ)
При изучении данной темы необходимо:
Знать: состав воздуха, понимать различие между массовой и объемной долей.
Уметь: определять массовую долю растворенного вещества; производить расчеты, связанные с понятием «массовая доля».
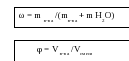
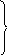 РАСЧЕТНЫЕ ФОРМУЛЫ
РАСЧЕТНЫЕ ФОРМУЛЫ
Решение задач.
№1. В 380 мл воды растворили 20 г иодида калия. Определите массовую долю соли в полученном растворе.
Решение.
Определим массу полученного раствора: m р-ра = m в-ва + m Н2О = 20 + 380 = 400 г
Подставляем данные задачи в формулу и определяем массовую долю соли в растворе.
ω = m в-ва /(mв-ва + m H2O) = 20 / 400 = 0,05 ( или 5%).
№2. Сколько граммов хлорида натрия потребуется для приготовления 250 г 10% -го раствора?
Решение.
1. Определяем массу вещества в растворе:
m в-ва = ω × m р-ра = 0,1 × 250 = 25 г хлорида натрия
2. Определяем массу воды, необходимой для приготовления раствора:
m H2O = m р-ра – m в-ва = 250 – 25 = 225 г
№ 3. Приготовить 500 г 30%-го раствора соли, используя 40%-ный и 5%-ный растворы.
Решение.
Составим «крест». Запишем друг под другом процентные концентрации исходных растворов, а правее между ними – процентную концентрацию того раствора, который необходимо приготовить:
40 %

 30 %
30 %
5 %
Вычитая из концентрации более концентрированного раствора ( 40%-го) концентрацию конечного раствора ( 30% ), получаем цифру ( 10), которую записываем в правом нижнем конце «креста». Аналогично, вычитая из концентрации конечного раствора ( 30 % ) концентрацию более разбавленного из исходных растворов ( 5 % ), получаем цифру ( 25 ), которую помещаем в правом верхнем углу. Итак, « крест » готов:
4 0 % 25 % ( 30 % - 5 % )
0 % 25 % ( 30 % - 5 % )

 30 %
30 %
5 % 10 % ( 40 % - 30 % )
Цифры, стоящие в правой части «креста», используются при расчете масс исходных растворов, при смешении которых образуется раствор с заданной концентрацией:
m ( 40 %-го раствора ) = (500× 25 %) / ( 25 + 10 ) % = 357,1 г
m ( 5 5 –го раствора ) = (500× 10 %) / ( 25 + 10 ) % = 142,9 г
Ответ : 357,1 г 40 % - го раствора и 142,9 г 5 %-го раствора.
Задачи.
Определите массу соли, содержащейся в 150 г раствора с массовой долей соли 15 %.
В 60 г раствора содержится 18 г соли. определите массовую долю соли в данном растворе.
Какие массы соли и воды потребуются для приготовления 200 г 6% - го раствора данной соли?
Какой объем кислорода может быть получен из 5 м3 воздуха, если объемная доля кислорода в воздухе составляет 21 % ?
Определите массу чистого карбоната кальция в 5 г природного известняка, содержащего 12 % примесей.
Определите массовые доли элементов в серной кислоте.
2







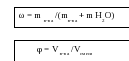
 РАСЧЕТНЫЕ ФОРМУЛЫ
РАСЧЕТНЫЕ ФОРМУЛЫ
 30 %
30 %  0 % 25 % ( 30 % - 5 % )
0 % 25 % ( 30 % - 5 % )