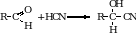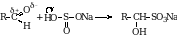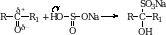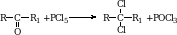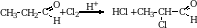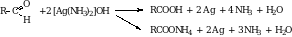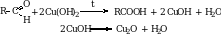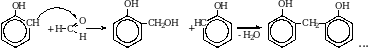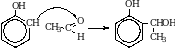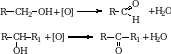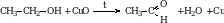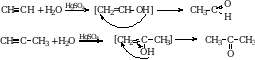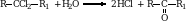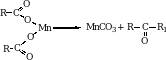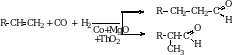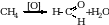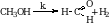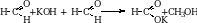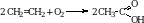АЛЬДЕГИДЫ (алканали) И КЕТОНЫ(алканоны).
Альдегиды и кетоны – это производные углеводородов, в молекулах которых содержится одна или более карбонильных групп С=О.
Карбонильная группа иногда называется оксогруппой, поэтому эти соединения называют оксосоединениями.
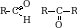 Общая формула альдегидов и кетонов.
Общая формула альдегидов и кетонов.
Гомологический ряд.
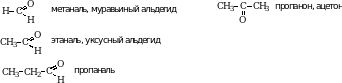
Номенклатура. Названия альдегидов производят от названия соответствующих алканов, добавляя к их названию суффикс –АЛЬ. Нумерацию цепи начинают от альдегидной группы.
Наряду с международной номенклатурой для альдегидов широко используют тривиальные названия: метаналь – формальдегид, этаналь – ацетальдегид.
При составлении названий кетонов по международной номенклатуре самую длинную цепь углеродных атомов нумеруют с того конца, к которому ближе карбонильная группа. К названию соответствующего углеводорода добавляют суффикс –ОН и далее цифрой указывают положение карбонильной группы в цепи. Для кетонов простейшего строения более распространена рациональная номенклатура, в соответствии с которой в названии указывают два радикала, связанные карбонильной группой, и добавляют слово КЕТОН.
Физические свойства. Муравьиный альдегид – газ с резким раздражающим запахом. Хорошо растворяется в воде. 40% водный раствор формальдегида называется формалином.
Следующие гомологи альдегидов жидкости. Высшие альдегиды – твердые вещества.
По рациональной номенклатуре уксусный альдегид называют ацетальдегидом.
Ацетон и следующие представители кетонов жидкости, высшие кетоны – твердые вещества.
Высокая химическая активность альдегидов и кетонов определяется карбонильной группой С=О. Двойная связь в этой группе, как и у алкенов состоит из одной 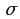 - и одной
- и одной 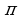 -связи. Но эта связь сильно поляризована. Причина этого – разная электроотрицательность атомов углерода и кислорода. Электронная плотность смещается в сторону кислорода.
-связи. Но эта связь сильно поляризована. Причина этого – разная электроотрицательность атомов углерода и кислорода. Электронная плотность смещается в сторону кислорода.
Химические свойства альдегидов и кетонов.
1. Присоединение водорода – гидрирование. Реакция протекает при нагревании в присутствии катализаторов (никель, платина, палладий). Альдегиды образуют первичные спирты, кетоны – вторичные.

2. Присоединение циановодорода (синильной кислоты). Альдегиды и кетоны присоединяют по карбонильной группе полярную молекулу синильной кислоты. Полученные соединения называются оксинитрилами, молекула которых содержит на один атом углерода больше. Чем исходный альдегид. Оксинитрилы используют для получения гидроксикислот, аминокислот.
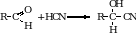
3. Присоединение гидросульфита натрия. Альдегиды способны присоединять молекулу гидросульфита натрия. Эта важная реакция позволяет выделить альдегиды из смеси с другими веществами. Образующиеся сульфопроизводные выпадают в осадок из водных растворов альдегидов и очень легко разлагаются с образованием исходного альдегида при обработке их кислотой (кроме альдегида образуется соль, выделяется SO2 и вода).
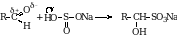
В эту реакцию вступают только те кетоны, которые содержат хотя бы одну метильную группу.
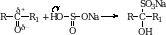
4. Присоединение магнийорганических соединений (реактивов Гриньяра). Французский химик Франсуа Огюст Виктор Гриньяр в 1900 г. получил органические вещества, содержащие связанные с углеродом атом металла – магния. Альдегиды и кетоны присоединяют реактив Гриньяра по карбонильной группе.
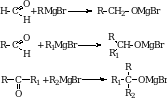
Полученные соединения подвергаются гидролизу с образованием спиртов и MgOHBr.
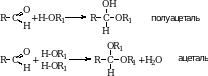
Присоединение спиртов. Эта реакция приводит к образованию полуацеталей. Полуацетали довольно неустойчивые соединения.
В избытке спирта в присутствии хлороводорода можно получить полные простые эфиры гидратной формы альдегида – ацетали.
Кетоны в этих условиях ацеталей не образуют.
6. У кетонов карбонильный кислород может замещаться на галоген. При этом получаются дигалогенопроизводные.
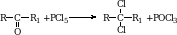
7. У альдегидов на галоген замещаются атомы водорода, находящиеся в радикале.
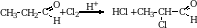
8. Альдегиды легко окисляются. При окислении альдегидов образуются соответствующие кислоты. Эти реакции являются качественными на альдегидную группу. Реакция с аммиачным раствором оксида серебра (реакция серебряного зеркала).
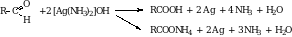
В качестве окислителя может использоваться свежеосажденный гидроксид меди (II). При этом образуется осадок кирпично-красного цвета.
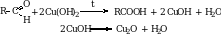
Кетоны окисляются труднее. При действии на кетоны сильных окислителей происходит разрыв цепи и образование смеси различных кислот.
9. Альдегиды и кетоны вступают в реакцию поликонденсации с фенолом.
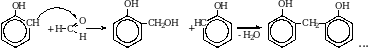
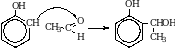
Получение альдегидов и кетонов.
1. При окислении первичных спиртов получаются альдегиды, а вторичных – кетоны. В качестве окислителей можно использовать хромовую смесь, перманганат калия, кислород воздуха, оксид меди.
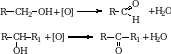
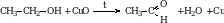
2. Гидратация алкинов. При гидратации ацетилена образуется уксусный альдегид. При гидратации всех остальных алкинов образуются кетоны.
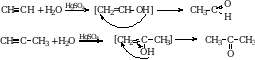
3. Гидролиз дигалогенопроизводных. Если атомы галогенов расположены у последнего атома углерода, то получаются альдегиды.

Если атомы галогенов расположены у одного из средних атомов углерода, то образуются кетоны.
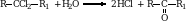
4. Из карбоновых кислот. При пропускании смеси карбоновых кислот над катализатором (MnO2 или ThO2) при высокой температуре образуются их соли, которые затем подвергаются пиролизу).
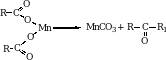
5. Оксо-синтез. Прямое присоединение СО и Н2 к непредельным соединениям. Этим способом получают альдегиды в промышленности. Реакция протекает при повышенной температуре и давлении в присутствии катализаторов.
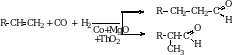
Формальдегид. Его можно получить при неполном окислении метана.
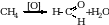
Каталитическим окислением метанола.
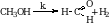
Формальдегид может вступать в реакцию окисления-восстановления (реакцию Канниццаро)
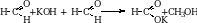
Ацетальдегид. Получают при окислении этена.
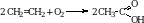
Применение альдегидов и кетонов.
Формальдегид применяют для получения фенолформальдегидных и карбамидных полимеров, органических красителей, взрывчатых веществ, различных клеящих материалов и лаков, используют в кожевенной промышленности, а также в качестве дезинфицирующего средства в медицине.
Ацетальдегид имеет большое промышленное значение. Из него получают уксусную кислоту, этанол, этилацетат, бутанол, хлораль и многие другие продукты.
Ацетон применяют как растворитель лаков, красок, используют в производстве кинопленки, ацетатного шелка.





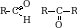 Общая формула альдегидов и кетонов.
Общая формула альдегидов и кетонов.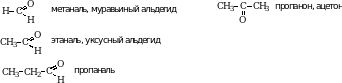
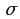 - и одной
- и одной 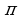 -связи. Но эта связь сильно поляризована. Причина этого – разная электроотрицательность атомов углерода и кислорода. Электронная плотность смещается в сторону кислорода.
-связи. Но эта связь сильно поляризована. Причина этого – разная электроотрицательность атомов углерода и кислорода. Электронная плотность смещается в сторону кислорода.