Электролиз растворов и расплавов электролитов.
ЭЛЕКТРОЛИЗ – это процесс разложения расплавов и растворов электролитов под действием электрического тока.
В раствор или расплав какого-либо электролита опускают электроды: катод (-) и анод (+).
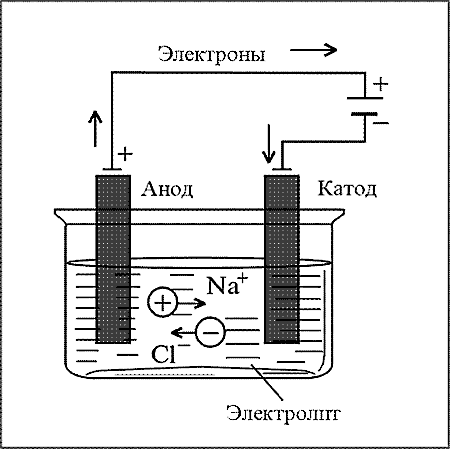
При этом ионы, образовавшиеся при диссоциации электролита, движутся к электродам и разряжаются на них, принимая или отдавая электроны. Электролиз расплавов.
1)Расплав хлорида натрия. Он содержит катион натрия и анион хлора.

| катод: | Na+ + 1e Na0 | 2 | На катоде: разряжается КАТИОН натрия: |
| анод: | 2Cl- - 2e Cl20 | 1 | На аноде: разряжается АНИОН хлора: |
Cуммарное уравнение электролиза: 2NaCl(расплав) �\s\up9(эл. ток� 2Na + Cl2
2) Расплав гидроксида натрия.
4NaOH (расплав) �\s\up9(эл. ток�4Na + O2 + 2H2O
| катод: | Na+ + 1e Na0 | 4 |
| анод: | 4ОН- - 4e O2 + 2H2O | 1 |
3) Расплав оксида алюминия в криолите.

Криолит – Na3[AlF6] используют для уменьшения температуры плавления оксида алюминия.
Электролиз проводится на графитовых электродах, при этом часть электрода сгорает в выделяющемся кислороде, выделяются оксиды углерода.
2Al2O3 (расплав) �\s\up9(эл. ток�4 Al + 3O2
Электролиз растворов электролитов с инертными электродами.
| Катодный процесс-разрядка катиона зависит от положения в электрохимическом ряду напряжений. | Анодный процесс |
| 1. Металлы правее Н: разряжаются на катоде Ме | 1. Анионы бескислородных кислот (кроме F-) – разряжаются до простого вещества: S2- I- Br -Cl- |
| 2. Металлы от Al до Н: идёт два параллельных процесса: а) разрядка металла Ме б) разрядка воды: Н2 | 2. Анионы кислородсодержащих кислот и F- не разряжаются, идёт разрядка воды: О2 |
| 3. Если в растворе ионы Н+ - они разряжаются до Н2 | 3. Если есть ОН- он разряжается с выделением О2 |
| 4. Металлы левее алюминия – НЕ РАЗРЯЖАЮТСЯ, идёт разрядка воды: Н2 | 4. Анионы карбоновых кислот – реакция Кольбе. Происходит процесс декарбоксилирования и выделяется алкан (в результате сдваивания алкильных радикалов). Пример: 2CH3COO- -2e 2CO2+ CH3-CH3 |
Примеры:
1) раствор хлорида натрия. NaCl + H2O �\s\up9(эл. ток�

| 2Н2О +2е H2 + OH- | 1
| катод: около катода Na+ и H2O. Натрий левее Al, поэтому идёт разрядка воды. |
| 2Cl- - 2e Cl2 | 1 | анод: около анода хлорид-анион и вода. Разряжается ион Cl- |
Cуммарное уравнение электролиза:
2NaCl + 2H2O �\s\up9(эл. ток�Сl2 + H2 + 2NaOH
На электродах выделяются газообразные продукты – хлор и водород, в растворе накапливается гидроксид натрия.
2) раствор сульфата меди (II) CuSO4 + H2O �\s\up9(эл. ток�
| Cu2+ +2е Cu | 1 | катод: около катода Cu2+ и H2O.Медь левее Н, поэтому она сама будет разряжаться на катоде: |
| 2H2O - 4eO2+ 4H+ | 1 | анод: около анода – сульфат- анион и вода. Разряжается вода. |
Cуммарное уравнение электролиза:
CuSO4 + H2O �\s\up9(эл. ток�Cu + O2 + H2SO4
На катоде выделяется металл – медь, на аноде – газообразный кислород, в растворе накапливается серная кислота.
Электролиз растворов солей с растворимым анодом.
Если анод из того же металла, что и металл в составе соли (например, медный анод в растворе сульфата меди), то на аноде не происходит разрядки воды или аниона. Происходит процесс РАСТВОРЕНИЯ АНОДА: Ме+n + nē = Ме0
Пример: электролиз раствора сульфата никеля с никелевыми электродами.
катод: Ni2+ + 2ē = Ni0
анод: Ni0 - 2ē = Ni2+
Коррозия металлов.
Коррозия – это разрушение металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе.
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
Благородные металлы не подвергаются коррозии из-за химической инертности;
Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии;
Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия происходит при воздействии на металл сухих газов, её называют газовой. 3Fe + 2O2 = Fe3O4
В аппаратах химических производств возможны процессы:
Fe + 2HCl FeCl2 + H2
2 Fe + 3Cl2 2FeCl3
Электрохимическая коррозия – разрушение металла в присутствии воды и кислорода, либо в растворах электролитов.
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
Электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).

В таком загрязнённом металле идёт перенос электронов от железа к меди, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+, а на поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
а) 2H+ + 2e = H2;
б) O2 + 2H2O + 4e=4OH–
Пример: при контакте железа с оловом в растворе соляной кислоты происходят процессы:
анод: Fe –2e = Fe 2+,
катод: 2H+ + 2e = H2
Суммарная реакция: Fe + 2H+ = H2 + Fe2+ ,
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
анод: Fe –2e = Fe 2+,
катод: O2 + 2H2O + 4e=4OH–
Суммарная реакция: Fe 2+ + 2OH – = Fe(OH)2
4Fe(OH)2 + O2+ 2H2O = 4Fe(OH)3 Образуется ржавчина.
Методы защиты от коррозии.
| 1.Защитные покрытия | 2. Создание сплавов, стойких к коррозии | 3. Изменение состава среды | 4.Электрохимические методы защиты. |
| а) Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие). б) Покрытие краской, лаками, смазками. в) Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте) | Нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью. | Добавление в среду, окружающую металлическую конструкцию, ингибиторов коррозии (веществ, подавляющих процессы коррозии) | Протекторная защита: присоединение к металлической конструкции пластинок из более активного металла – протекторов. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается. |






















