СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Учебное пособие по Молекулярной биологии
Данное учебное пособие предназначено для освоения раздела «Генетика развития» дисциплины «Молекулярная биология, медицинская генетика» учащихся. Разработана на основе государственного образовательного стандарта по специальности среднего профессионального образования и рабочим программам учебной специальности 0301000 «Лечебное дело» и квалификаций 0301013 «Фельдшер».
Включает в себя теоретический материал по разделу, представленный в виде таблиц, схем и иллюстраций.
В ходе ознакомления с данным учебным пособием у учащихся развиваются познавательные универсальные учебные действия: общеучебные универсальные действия - самостоятельное выделение и формулирование познавательной цели, поиск и выделение необходимой информации, структурирование знаний; регулятивные универсальные учебные действия - целеполагание, планирование, прогнозирование, контроль; знаково-символические действия - моделирование; логические универсальные действия - анализ, синтез, сравнение, классификация; коммуникативные универсальные учебные действия.
При рассмотрении вопросов стволовые клетки, строения клетки, тканей и органов многоклеточных животных основное внимание уделяется формированию у учащихся эволюционного мышления при изучении живой природы во всех её проявлениях. Важно показать, что в процессе эволюции у организмов на основе единых фундаментальных законов строения и функционирования клеток сложились различные варианты организации тканевых и органных систем. Основными положениями этой теории являются тезисы о том, что сходные в функциональном отношении ткани у филогенетически различных групп животных имеют сходное строение и что в процессе эволюции могли сформироваться несколько вариантов организации сходных в функциональном отношении тканей и органов.
Использование самых современных молекулярно-биологических данных о строении и функционировании стволовых клеток.
Это положение подразумевает хорошее владение учениками основами общей биологии, генетики, теории эволюции, химии и других биологических наук.
При изучении предмета необходимо подчеркивать не только интернациональный характер науки (особенно на современном этапе её развития), но и пропагандировать достижения отечественных ученых, многие из которых внесли исключительный вклад в развитие молекулярной биологии.
Важно сформировать твердое убеждение у учащихся, что неблагоприятные факторы (как внешней, так и внутренней природы), включая вредные привычки (наркотики, алкоголь, табак), стрессы, нарушенный психоэмоциональный фон, серьезно сказываются на состоянии организма, затрагивая самые глубинные молекулярно-генетические основы деятельности клеток, и что с подобными рода нарушениями бороться чрезвычайно трудно, и порой невозможно.
Эта часть раздела предполагает широкое использование иллюстративного материала (схемы, электронные фотографии) непосредственно на занятиях (особенно при изучении структуры стволовых клеток), а также (по возможности) изучение микроскопических препаратов тканей и органов
(в разделах «Генетика развития»). Необходимо шире использовать возможности коммуникационно - информационных технологий, подключаясь к многочисленным сайтам по молекулярной биологии , анатомии и физиологии, имеющихся в Интернете.
Текущие знания проверяются с помощью тестовых контрольных работ после каждого раздела и традиционных опросов в течение изучения темы.
Просмотр содержимого документа
«Учебное пособие по Молекулярной биологии»
ШЫҒЫС ҚАЗАҚСТАН ВОСТОЧНО-КАЗАХСТАНСКАЯ
ОБЛЫСЫ ОБЛАСТЬ
СЕМЕЙ ҚАЛАСЫ ГОРОД СЕМЕЙ
БІЛІМ МЕКЕМЕСІ УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «АВИЦЕННА» МЕДИЦИНАЛЫҚ МЕДИЦИНСКИЙ КОЛЛЕДЖ
КОЛЛЕДЖІ «АВИЦЕННА»

УТВЕРЖДЕНО
на заседании Методического Совета
Учреждения образования
«Авиценна» медицинского колледжа
протокол № ___ ___/________/2015 г
Заместитель директора по УР,
председатель методического Совета
_________________ Адельханова Д. О.
УЧЕБНОЕ ПОСОБИЕ
«БИОЛОГИЯ СТВОЛОВЫХ КЛЕТОК, ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ»ПО ДИСЦИПЛИНЕ «МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, МЕДИЦИНСКАЯ ГЕНЕТИКА»
РАЗДЕЛ: «ГЕНЕТИКА РАЗВИТИЯ»
ДЛЯ СПЕЦИАЛЬНОСТИ 0301000 «ЛЕЧЕБНОЕ ДЕЛО»
И КВАЛИФИКАЦИЙ 0301013 «ФЕЛЬДШЕР»
Рассмотрена и одобрена
на заседании ЦМК ОПД
/_____/ /______/ 2015 года
Протокол № ___
Председатель ЦМК ОПД
___________ Жакупова К.М.
Составил преподаватель
дисциплины «Молекулярная биология,
медицинская генетика»
__________ Акимбаев А.К.
СОДЕРЖАНИЕ
| Пояснительная записка
Выписка из типовой рабочей программы учебной дисциплины «Молекулярная биология,медицинская генетика»
Тема 1. Генетические механизмы онтогенеза. Дифференциальная активность генов как основа морфогенеза.
1.2. Дифференциальная активность генов как основа морфогенеза.
1.3.Генетическая тождественность клеток в пределах организма.
1.4. Изменение генетической функции ядра в ходе дифференциации. 1.5. Дифференциальная активность генов в онтогонезе. 1.6. Поведение клеток в культуре тканей
Тема 2. Тератогенез. Тератогенные факторы.Тератогенные периоды онтогенеза.
2.1. Врожденные пороки развития.Их классификация.
2.2. Факторы среды,вызывающие нарушения развития. 2.3. Нейрогуморальная регуляция процессов роста и развития. Тема 3. Клеточные механизмы возникновения врожденных пороков развития. Стволовые клетки, их применение в медицине.
3.1.Технология выращивания искусственных органов на основе стволовых клеток.
3.2. Технологии биопечати.
3.3. Виды стволовых клеток.
3.4. Искусственные механические органы.
4. Глоссарий
5. Тестовые задания по разделу
6. Список использованной литературы
| 3
5
6
7
8
9
10
11
11
12
13
14
16
19
20
24
26
29
32
|
Пояснительная записка
Данное учебное пособие предназначено для освоения раздела «Генетика развития» дисциплины «Молекулярная биология, медицинская генетика» учащихся. Разработана на основе государственного образовательного стандарта по специальности среднего профессионального образования и рабочим программам учебной специальности 0301000 «Лечебное дело» и квалификаций 0301013 «Фельдшер».
Включает в себя теоретический материал по разделу, представленный в виде таблиц, схем и иллюстраций.
В ходе ознакомления с данным учебным пособием у учащихся развиваются познавательные универсальные учебные действия: общеучебные универсальные действия - самостоятельное выделение и формулирование познавательной цели, поиск и выделение необходимой информации, структурирование знаний; регулятивные универсальные учебные действия - целеполагание, планирование, прогнозирование, контроль; знаково-символические действия - моделирование; логические универсальные действия - анализ, синтез, сравнение, классификация; коммуникативные универсальные учебные действия.
При рассмотрении вопросов стволовые клетки, строения клетки, тканей и органов многоклеточных животных основное внимание уделяется формированию у учащихся эволюционного мышления при изучении живой природы во всех её проявлениях. Важно показать, что в процессе эволюции у организмов на основе единых фундаментальных законов строения и функционирования клеток сложились различные варианты организации тканевых и органных систем. Основными положениями этой теории являются тезисы о том, что сходные в функциональном отношении ткани у филогенетически различных групп животных имеют сходное строение и что в процессе эволюции могли сформироваться несколько вариантов организации сходных в функциональном отношении тканей и органов.
Использование самых современных молекулярно-биологических данных о строении и функционировании стволовых клеток.
Это положение подразумевает хорошее владение учениками основами общей биологии, генетики, теории эволюции, химии и других биологических наук.
При изучении предмета необходимо подчеркивать не только интернациональный характер науки (особенно на современном этапе её развития), но и пропагандировать достижения отечественных ученых, многие из которых внесли исключительный вклад в развитие молекулярной биологии.
Важно сформировать твердое убеждение у учащихся, что неблагоприятные факторы (как внешней, так и внутренней природы), включая вредные привычки (наркотики, алкоголь, табак), стрессы, нарушенный психоэмоциональный фон, серьезно сказываются на состоянии организма, затрагивая самые глубинные молекулярно-генетические основы деятельности клеток, и что с подобными рода нарушениями бороться чрезвычайно трудно, и порой невозможно.
Эта часть раздела предполагает широкое использование иллюстративного материала (схемы, электронные фотографии) непосредственно на занятиях (особенно при изучении структуры стволовых клеток), а также (по возможности) изучение микроскопических препаратов тканей и органов
(в разделах «Генетика развития»). Необходимо шире использовать возможности коммуникационно - информационных технологий, подключаясь к многочисленным сайтам по молекулярной биологии , анатомии и физиологии, имеющихся в Интернете.
Текущие знания проверяются с помощью тестовых контрольных работ после каждого раздела и традиционных опросов в течение изучения темы.
ВЫПИСКА ИЗ ТИПОВОЙ РАБОЧЕЙ ПРОГРАММЫ
УЧЕБНОЙ ДИСЦИПЛИНЫ
«МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, МЕДИЦИНСКАЯ ГЕНЕТИКА»
Тематический план раздела « Генетика развития»
| Специальность
| Теория | Темы занятий |
| 0301000 «Лечебное дело» | 6 | Тема 1. Генетические механизмы онтогенеза. Дифференциальная активность генов как основа морфогенеза. |
| Тема 2. Тератогенез. Тератогенные факторы. Тератогенные периоды онтогенеза. | ||
| Тема 3. Клеточные механизмы возникновения врожденных пороков развития. Стволовые клетки, их применение в медицине.
|
Тематическое содержание раздела «Генетика развития»
| Тема занятия | Содержание |
| Тема 1. Генетические механизмы онтогенеза. Дифференциальная активность генов как основа морфогенеза. | Дифференциальная активность генов как основа морфогенеза. Этапы онтогенеза. Гены, контролирующие эмбриональную индукцию. Гомеобоксы у человека и наследственные болезни. |
| Тема 2. Тератогенез. Тератогенные факторы. Тератогенные периоды онтогенеза. | Тератогенные факторы. Тератогенные периоды онтогенеза. Обосновать влияние отрицательных тератогенных факторов.
|
| Тема 3. Клеточные механизмы возникновения врожденных пороков развития. Стволовые клетки, их применение в медицине. | Критические периоды развития. Классификация, диагностика и профилактика ВПР. Свойства стволовых клеток.
|
Генетические механизмы онтогенеза. Дифференциальная активность генов как основа морфогенеза.
Онтогенез - это индивидуальное развитие особи от ее зарождения до смерти. У разных групп организмов онтогенез имеет свои особенности, которые, в частности, зависят от способа размножения. У одноклеточных организмов онтогенез совпадает с клеточным циклом.
Продолжительность онтогенеза может быть разной. Например, в секвойи более 3000 лет, некоторые виды черепах живут до 150 лет, белуга (представитель осетровых ) - до 100 лет. Из беспозвоночных животных значительная продолжительность жизни наблюдается у некоторых молюсков, членистоногих ( например, у речного рака- до 20 лет).
При половом размножении исходной стадией онтогенеза является зигота (при партеногенезе - неоплодотворенная яйцеклетка).
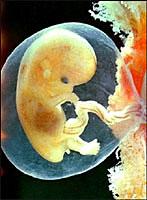
Эмбриональный (зародышевый) период - это время, когда новый организм (эмбрион) развивается внутри материнского организма или внутри яйца, семени и т.д.. Он завершается рождением (вылупливанием, прорастанием).
Постэмбриональное (послезародышевый) период длится от момента рождения (выхода из зародышевых оболочек, покровов семени) и до момента вступления организмом способности к размножению.
У организмов некоторых видов после размножения наступает смерть (лососевые рыбы - кета, горбуша и др.). В других организмах (большинство позвоночных животных, некоторые насекомые, паукообразные, моллюски, многолетние растения и т.п.) способность к размножению сохраняется определенное время - период половой зрелости. После ее потери смерть в таких организмов наступает не сразу, а через некоторое время (от нескольких дней у насекомых до нескольких лет и десятилетий в крупных млекопитающих, и т.д.). Это время называется периодом старения, когда снижается уровень обмена веществ, происходят необратимые изменения в организме, которые, в конце концов, приводят к смерти.
Существует два типа онтогенеза: прямой и непрямой. Непрямое развитие может быть личиночным. Прямое развитие существует в двух формах: неличиночная и внутриутробный. Личиночная форма характеризируется наличием одной или нескольких личиночных стадий. Личинки активно питаются. Этот тип развития сопровождается метаморфозом. Неличиночная форма развития свойственна рыбам, пресмыкающимся, птицам. Яйца этих животных богатые желтком. Для дыхания, выделения и питания зародыша, существуют временные органы. Внутриутробное развитие характерно для млекопитающих и человека. Все функции зародыша осуществляются за счет организма матери с помощью специального органа - плаценты.
Выделяют следующие этапы эмбрионального развития:
а) оплодотворения - образование зиготы,
б) дробление - образование бластулы,
в) гаструляция - образование зародышевых листков,
г) гисто - и органогенез - образование тканей и органов зародыша.
При личиночной форме онтогенеза эмбриональный период начинается с образования зиготы и заканчивается выходом из яйцевых оболочек. При неличинковой форме онтогенеза эмбриональный период начинается с образования зиготы и заканчивается выходом из зародышевых оболочек. При внутриутробной форме эмбриональный период начинается с образования зиготы и продолжается до рождения.
В результате оплодотворения образуется зигота - начальная стадия развития нового организма. Стадия зиготы длится от нескольких минут до нескольких часов. У некоторых видов животных уже в зиготе осуществляется интенсивный синтез белка, матрицей которого на начальных стадиях является собственная иРНК яйцеклетки. В это же время появляется ярко выраженная двусторонняя симметрия. У лягушки, например, точка, в которой спермий проник в яйцеклетку, как раз и определяет площадь симметрии зародыша и положения будущей дорсальной губы бластопора. Установлено, что в зиготе млекопитающих и человека до начала следующей стадии эмбриогенеза также происходит дифференцировка и перемещение участков цитоплазмы, что приводит к двусторонней симметрии.
Следующая стадия эмбриогенеза - дробление. Дроблением называют ряд митотических делений зиготы, между которыми нет типичной интерфазы: пресинтетический период отсутствует полностью, а синтетический период очень короткий и начинается еще в телофазе предыдущего митоза.
В результате этого дочерние клетки зиготы (бластомеры) не распространяются к размерам материнских клеток и с каждым делением становятся все меньше и меньше и, наконец, результат дробления - бластула (морула) почти не отличается по размеру от зиготы.
Дробление зависит от типа яйцеклетки и может быть полным и неполным; равномерным и неравномерным; синхронным и асинхронным, но в любом случае обязательно заканчивается образованием бластулы.
В зависимости от типа дробления различают целобластулу, амфибластулу, дискобластулу, стерробластулу.
По окончании периода дробления у многоклеточных животных наступает период образования зародышевых листков - гаструляция. Гаструляция - процесс развития из однослойного зародыша двухслойного (гаструлы), а в большинстве из них - впоследствии и трехслойного.
Образование зародышевых листков происходит в два этапа. Сначала образуется ранняя гаструла, которая имеет два зародышевых листка (эктодерму и энтодерму), а затем поздняя гаструла, когда формируется третий зародышевый листок - мезодерма. На первом этапе возможны четыре способа: инвагинация (впячивание), как у ланцетника; иммиграция (выселение клеток), как у кишечнополостных, эпиболия (обрастание), как у лягушки, и деламинация (разделение), как у некоторых кишечнополостных.
Второй этап гаструляции предусматривает два варианта: телобластический и энтероцельний.
Дальнейшие клеточные деления, перемещение, рост и дифференцировка зародышевых листков приводят к образованию тканей – гистогенез. Процесс формирования органов называется органогенезом. Гистогенез и органогенез идут параллельно и завершаются в основном в конце эмбрионального периода.
Дифференциальная активность генов как основа морфогенеза
При половом размножении многоклеточные животные и растения развиваются из одной клетки - зиготы; в случае вегетативного размножения, - как правило, из группы довольно однородных клеток. В процессе же развития из одной клетки или группы однородных клеток формируется сложный организм, состоящий из большого числа разнородных клеток. У млекопитающих насчитывают около ста различных клеточных типов, которые в той или иной степени стойко сохраняют свои признаки.
Возникновение из однородных клеток в течение индивидуального развития большого разнообразия клеточных форм, отличающихся по строению и функции, представляет процесс дифференциации. Появляющиеся в процессе дифференциации различия сохраняются клетками при размножении, т. е. оказываются наследственно закрепленными. Дифференциация - образование в процессе развития из однородных клеток разнообразных по морфологическим признакам и функциям клеток, тканей и органов. Дифференциация является одной из основ онтогенетического развития организма. Осуществляется она в период интерфазы и является реализацией генетической информации, идущей от ДНК ядра.
Биохимически дифференциация проявляется в синтезе специфических для клеток данной ткани белков. Дифференциация основана на разновременном вступлении генов в детерминацию онтогенеза (генов вступление ступенчатое), т. е. на дифференциальной транскрипции генов, функционирующих в разные фазы онтогенеза и синтезирующих соответствующие молекулы и-РНК.
Генотипы клеток различных дифференцированных тканей особи идентичны (они соответствуют генотипу исходной зиготы), однако в них функционируют разные гены. В настоящее время процесс клеточной дифференцировки объясняется с позиций теории дифференциальной активности генов, которая является одной из наиболее плодотворных и обобщающих теорий, сложившихся в биологической науке в ХХ в. Согласно этой теории, специализация клеток является результатом действия соответствующих групп генов, характерных для каждого типа клеток.
Последующий морфогенез в большей степени зависит от сложных взаимодействий между тканями, чем морфогенез на ранних стадиях развития. Следует отметить также, что начало клеточной дифференцировки, имеющей место в раннем развитии, представляет уникальные возможности для исследования процесса регуляции на уровне генома в клетках животных.
Для раннего развития характерно возникновение функциональных различий между клетками и появление пространственно разграниченных специфичных группировок дифференцированных типов клеток там, где они прежде отсутствовали. Эти процессы должны в основном зависеть от становления мозаичного характера генетической активности в ядрах дифференцирующихся клеток, в результате чего возникает вопрос о регуляции действия генов.
Чтобы принять предположение о том, что процесс дифференцировки является результатом дифференциальной активности генов, необходимы некоторые предпосылки. Прежде всего можно сказать, что в настоящее время хорошо известна взаимосвязь на молекулярном уровне между геномной ДНК и структурой различных белков клетки.
Характерные свойства клеток зависят от функциональных и структурных особенностей находящихся в них белков. В то же время, чтобы эти свойства клеток могли проявиться, необходима реализация генетической информации, в которой закодирована структура белков. Таким образом, дифференцировка, в конечном счете, зависит от транскрипции содержащейся в геноме информации.
Второй предпосылкой теории дифференциальной активности генов является предположение о том, что у многоклеточных организмов ядро каждой живой клетки содержит тот же самый геном, что и ядро зиготы. Факты, подтверждающие данное предположение, стали накапливаться уже с 1892 г., когда Дриш провел эксперименты с целью проверить правильность подобной точки зрения. Дриш, а вслед за ним и другие эмбриологи-экспериментаторы показали, что по крайней мере на самых ранних стадиях развития (на стадиях дробления) можно перемещать ядра из одних клеток в другие, не вызывая при этом нарушений в развитии. Поскольку ядра, определяющие в норме развитие энтодермальных клеток, могут также индуцировать развитие мезодермы и наоборот, то очевидно, что эти ядра должны содержать все гены, необходимые для развития как энтодермы, так и мезодермы.
Полученные данные показывают, что каждое ядро на стадии дробления содержит все гены зиготы. В этих опытах изменяли нормальный процесс распределения ядер по разным секторам цитоплазмы при дроблении яйца, кратковременно надавливая на него стеклянной пластинкой, которую затем удаляли. И Дриш, и его последователи считали, что подобные эксперименты являются прямой проверкой теории о разнокачественности ядер при дроблении, выдвинутой Вильгельмом Ру в 1883 г. Эта гипотеза в известном смысле - прямая противоположность существующей ныне теории дифференциальной активности генов.
Ру предполагал, что дифференцировка клеточных функций - это результат расхождения в разные клеточные ядра качественно различных генов. Согласно этой теории, каждая клетка содержит в своем ядре только те гены, которые необходимы для программирования характерных для нее функций. Специализация в развитии - это, таким образом, результат постепенного формирования мозаики клеток, содержащих различные части генома.
Несмотря на то что эти эксперименты Дриша и его последователей расценивались как доказательство того, что упомянутая теория Ру неверна, можно было, однако, утверждать, что эти опыты показывают равнозначность геномов в начальный период развития, довольно далеко отстоящий от начала действительной дифференцировки клеток и даже от начала видимого контроля над морфогенезом со стороны этих ядер. Однако разнообразные эксперименты, предпринятые позднее, наводили на мысль, что даже высокодифференцированные клетки содержат полный геном, равноценный геному ядра зиготы.
Очень рано стало известно, что в норме все клетки организма содержат одинаковое число хромосом. Существенную роль в этом сыграли исследования политенных хромосом насекомых, у которых удалось выявить основные черты поперечной структуры в хромосомах клеток разных типов. Кроме того, хромосомные аномалии, связанные с мутациями, вызывающими структурные изменения в одной ткани, можно обнаружить и в хромосомах клеток другой ткани.
Хорошо известным примером является ген Bar у Drosophila, влияющий на развитие глаза. Бриджес показал, что у мух, мутантных по этому гену, видна дупликация определенного участка в политенных хромосомах клеток слюнных желез, хотя очевидно, что клетки слюнных желез не могут быть ответственны за особенности морфогенеза глаза мухи. Другие примеры касаются структуры крыльев этого объекта; и в этом случае внутрихромосомные аномалии также выявляются цитологически в ядрах клеток слюнных желез. Следовательно, дифференцированные клетки одной ткани, по-видимому, содержат генетическую информацию, которая определяет характерные особенности других тканей.
1.3. Генетическая тождественность клеток в пределах организма.
Возникает вопрос: каков механизм поддержания стабильности дифференцированного состояния; почему клетки, детерминированные в определенном направлении, сколько бы раз они ни делились, сохраняют свою специфичность? Вейсман полагал, что в основе детерминации лежат неравнонаследственные деления. Носителем полной генетической информации, т. е. детерминантов (генов) всех признаков взрослого организма, является оплодотворенная яйцеклетка.
Тканевые клетки получают набор генов, соответствующих их структуре и функциям. Это означает, что в нервных клетках нет генов гемоглобина, а в клетках печени - генов, кодирующих белки мышц. В качестве подтверждения своей гипотезы Вейсман использовал данные по диминуции хроматина у лошадиной аскариды. Он полагал, что диминуция - это как раз тот процесс, при котором тканевые клетки освобождаются от лишнего генетического материала.
Эта гипотеза оказалась ошибочной. Диминуционные деления (их обычно одно или два) происходят в раннем эмбриогенезе (3-7 делений дробления), т. е. тогда, когда тканеспецифические гены еще не начинают функционировать. Собственно говоря, диминуция - это первый акт детерминации, разделяющий зародышевые половые и соматические клетки. Все типы тканевых клеток развиваются после диминуционных делений. Нельзя не отметить, что диминуция наблюдается у ничтожного числа из ныне известных видов животных.
Данные цитогенетики показывают, что у видов, у которых диминуция отсутствует, кариотипы всех тканевых клеток одинаковы; цитофотометрия свидетельствует о том, что клетки различной дифференцировки по содержанию ДНК не различаются; наконец, данные молекулярной гибридизации нуклеиновых кислот указывают на идентичность спектра нуклеотидных последовательностей в клетках разных тканей.
Следовательно, гены гемоглобина присутствуют не только в эритроидных клетках, где они активно функционируют, но и в клетках мозга, печени, почек и других тканей. Таким образом дифференциация происходит на основе неизменного в количественном отношении генома, сохраняющего полный спектр всех своих компонентов. Однако допускается, что в процессе дифференцировки отдельные гены избирательно повреждаются и в данных тканевых клетках уже никогда не будут функционировать. В таком случае в клетках кишечного эпителия гены гемоглобина не работают не потому, что они там отсутствуют, а вследствие повреждения их структуры или выпадения незначительных по размерам последовательностей, регулирующих транскрипцию.
Экспериментальные данные, опровергнувшие и эту точку зрения на механизм дифференциации, были получены в начале 60-х гг. Неоплодотворенные яйцеклетки облучали большой дозой ультрафиолета, которая инактивировала ядра, но практически не повреждала цитоплазму. С помощью микрохирургической техники в такие энуклеированные яйцеклетки пересаживались ядра из дифференцированных клеток - эпителия кишечника головастика. В некоторых случаях удалось получить полностью нормальных плодовитых взрослых особей. Если для опыта брали ядра одной особи, то все развившиеся животные представляли собой клон, т. е. были сходны между собой так, как и однояйцевые близнецы человека.
Из опытов можно сделать два вывода:
- во-первых, в процессе детерминации и дифференцировки не происходит необратимых повреждений генома;
- во-вторых, перенесение ядра тканевой клетки в неоплодотворенное яйцо, по крайней мере в некоторых случаях, приводит к полному возврату дифференцированного состояния и детерминации.
Другие примеры частичной обратимости дифференцированного состояния могут быть показаны с помощью гибридизации соматических клеток in vitro. В настоящее время техника подобных экспериментов достаточно высока, поэтому довольно легко можно получить гибриды между клетками даже далеких видов с разными типами молекулярной организации генома, например между клетками птиц и млекопитающих. Однако в природе едва ли существуют условия, при которых резко нарушается стабильность дифференцированного состояния, а тем более происходит передетерминация.
Таким образом, поскольку детерминация и дифференцировка не связаны с количественными или качественными изменениями генома (в абсолютном большинстве случаев), принято считать, что эти процессы основаны на эпигеномной наследственности. Сущность ее состоит в постоянном воспроизведении в ряду поколений соматических клеток такой надмолекулярной организации хромосом, которая позволяет функционировать в каждом типе клеток строго определенным наборам генов.
Экспериментальные исследования ранних стадий развития амфибий также показали однородность ядер, образующихся при дроблении. Например, Шпеман (1928) перетягивал после оплодотворения яйцеклетку так, что только в одной половине оказывалось ядро (в этой половине шли деления), другая же, безъядерная половина не дробилась. Между обеими частями яйцеклетки оставался узкий мостик цитоплазмы. После 4-гo деления, когда было уже 16 ядер, одно из них попало в безъядерную часть, и она после этого начинала дробиться, из нее образовывалась полноценная личинка.
Сходные опыты на яйцеклетках стрекоз показали, что ядро зиготы в процессе первых делений не утрачивает способности давать начало целому организму. Выяснению потенций ядра на более поздних стадиях развития способствовала методика пересадки ядер. Ядро яйцеклетки в момент второго деления созревания удалялось стеклянной иглой и на его место стеклянной пипеткой переносилось диплоидное ядро, взятое из клеток более поздних стадий развития.
При использовании ядер из клеток поздней бластулы наблюдалось нормальное развитие большинства яйцеклеток, тоже до стадии бластулы, и в значительном проценте случаев - образование полноценных личинок. Ряду авторов удалось получить развитие нормальных взрослых особей из энуклеированных яйцеклеток амфибий, в которые были пересажены ядра из клеток нейрулы, глазного бокала, кишечника головастиков и почки. Однако во всех опытах наблюдался определенный процент яйцеклеток, которые после пересадки ядер развивались только до стадии бластулы или же из них развивались аномальные личинки.
Для анализа причин этого явления из одной бластулы были пересажены ядра в ряд яйцеклеток, среди которых одни дали полноценное развитие личинок, другие - аномальное, а третьи развивались только до стадии бластулы. Пересаживая от них ядра, можно было убедиться, что способность ядер обеспечивать развитие яйцеклетки до определенной стадии сохраняется и при серийных пересадках, т. е. этот признак связан с какими-то генетическими факторами.
В дальнейшем оказалось, что ядра клеток, обеспечивающие развитие только до стадии бластулы, отличаются значительными хромосомными нарушениями: несколько меньше они у тех, которые давали аномальных личинок. Эти нарушения, вызванные, вероятно, повреждающим влиянием цитоплазмы яйцеклеток, на пересаженные в них ядра, однако, не препятствуют развитию зародыша до стадии бластулы. У высших растений геном соматических клеток также в основном репрессирован, и эта репрессия поддерживается эпигеномной наследственностью. Однако в этом случае полная дерепрессия генома в культуре растительной ткани наблюдается чаще. Например, из соматических клеток моркови и табака можно получить полноценные фертильные растения.
Механизм становления детерминации пока неизвестен, однако ясно, что у многих животных, напримере у амфибий, первичная детерминация связана с химической неоднородностью различных участков яйцеклетки. Поэтому и детерминация ядер, оказавшихся в ходе дробления в районе вегетативного полюса, будет иной, чем тех, которые попадут в цитоплазму аномального полюса.
В целом описанные выше опыты показали, что ядра соматических клеток обладают не только всей полнотой генетической информации, свойственной данному организму, но и потенциальной способностью обеспечивать нормальное индивидуальное развитие организма. Однако по мере развития деблокирование генетической информации ядер оказывается все более и более трудным, хотя, по-видимому, возможным в любом ядре, содержащем полное количество ДНК. Из этого следует, что в процессе онтогенеза наследственные структуры ядер не претерпевают каких-либо необратимых изменений.
1.4. Изменение генетической функции ядра в ходе дифференциации.
В настоящее время доказано, что никогда в ядре не функционирует весь геном. Отдельные гены последовательно, по мере развития, начинают функционировать, т. е. синтезировать соответствующие и-РНК, в то время как функция других генов блокируется. Таким образом приобретение клетками новых признаков и утрата старых в ряду клеточных поколений представляет собой результат эпигенетической изменчивости, которая и обеспечивает дифференциацию клеток. Механизм перестройки работы генетического аппарата в соматических клетках в ходе онтогенеза в настоящее время неизвестен.
Жакобом и Мано было открыто явление индуктивного синтеза ферментов у бактерий. Под действием субстрата в бактериальных клетках начинают функционировать те гены, которые обеспечивают выработку ферментов, необходимых для утилизации субстрата. Например, при действии галактозы бактериальные клетки начинали синтезировать фермент галактозидазу, без которого они не могут использовать галактозу. В связи с этим открытием многие исследователи полагали, что и в основе дифференциации клеток могут лежать сходные процессы.
Однако между индуктивным синтезом у бактерий и процессом дифференциации многоклеточных организмов существует принципиальное различие. Это различие состоит в том, что при индуктивном синтезе у бактерий выработка фермента продолжается все время, пока есть индуцирующий субстрат, и прекращается, как только этот субстрат исчезает. При дифференциации после действия индуктора (иногда довольно кратковременного) начавшийся процесс продолжается в значительной мере уже автономно. Но общие представления о репрессии и индукции вполне могут быть применимы для объяснения явлений клеточной дифференциации.
Показано, в частности, что возникновение различий в образующихся информационных РНК, которые определяют белковый синтез, обусловлены резкими изменениями в функционировании хромосом и ДНК ядра. Так, в политенных хромосомах личинок двукрылых при этом образуются утолщенные диски, вздутия и пуфы. В них хромосомы деспирализуются и идет интенсивный синтез РНК.
В различные периоды жизни личинки повышенную активность обнаруживают различные участки хромосом. Более того, под влиянием гормона линьки - экдизона - образуются два новых пуфа, которые существуют, пока действует гормон. Следовательно, в каждый отдельный период жизни в клетке функционирует только часть ее генетического аппарата, а остальная часть находится в репрессивном состоянии. После определенного отрезка времени начинает функционировать другая группа генов, которая, вероятно, одновременно репрессирует остальной генетический материал.
Репрессия большей части генетического материала и функционирование только небольшой части генов могут в самой общей форме объяснить, как при наличии одинаковых по количеству и структуре молекул ДНК образуются клетки с резкими различиями в белковом синтезе. Но при этом, естественно, встает вопрос о том порядке, в котором начинает функционировать генетический аппарат.
Поскольку онтогенез, понимаемый как развитие особи от яйцеклетки до смерти, слагался исторически, а изменение клеток в процессе онтогенеза есть проявление их наследственности, тo сама дифференциация должна отражать эти исторические черты. В общей форме, видимо, наиболее приемлема теория Т. Моргана, согласно которой сначала ядро воздействует на цитоплазму и, говоря современным языком, программирует белковый синтез, а затем цитоплазма оказывает влияние на ядро, избирательно блокируя ряд генов, которые до этого функционировали.
Цитоплазма, получившая определенную информацию, репрессирует все гены, которые не должны работать в данный момент, или же действует только на гены, которые регулируют активность генотипа в целом.
1.5. Дифференциальная активность генов в онтогенезе.
Развитие характеризуется сменой активности различных генов и их постепенным включением в работу при онтогенетическом развитии организма. Направленное влияние генетической информации на процессы развития связано с дифференциальным вступлением генов в детерминацию развития, т. е. со сменой явлений транскрипции разных гeнов. Хотя в дифференцированных клетках весь генный набор сохранен, однако далеко не все гены равно функциональны, т. е. далеко не одинаково транскрибируют свой код.
Процессы развития связаны со взаимодействием цитоплазмы и ядра. Здесь легко представить себе обратные связи, при которых возникают вещества цитоплазмы, - возможно, индукторы и репрессоры, регуляторы транскрибирования генов. Это отчетливо видно из фактов многочисленных мутаций, прерывающих процессы развития особи на разных его этапах. На каждом этапе онтогенеза активны только те гены, функция которых осуществляется именно на этом этапе.
Первоначально включенные гены, контролирующие основные процессы клеточного метаболизма, активны на протяжении всей жизни особи. Действие других генов может инактивироваться после выполнения ими своей функции. Чтобы наглядно представить себе этот процесс, достаточно вспомнить основной биогенетический закон Э. Геккеля, согласно которому в эмбриогенезе каждого вида повторяются основные черты эмбрионального развития его эволюционных предшественников. Ясно, что гены, контролирующие образование зачаточных жаберных щелей и других подобных органов, функционируют в онтогенезе плацентарных млекопитающих лишь ограниченное время.
Четкая упорядоченность в связи со стадиями индивидуального развития установлена для смены функционирования генов гемоглобина у млекопитающих. Подобных примеров можно привести немало, однако, с точки зрения генетики развития, наиболее интересны те случаи, где дифференциальная активность генов может быть прослежена непосредственно по изменению некоторых особенностей хромосом, иногда называемых особенностями хромосомного фенотипа. Наиболее ярким примером такого рода служат пуфы в гигантских политенных хромосомах.
Морфологически пуфы представляют собой вздутия определенных районов хромосом, обусловленные декомпактизацией отдельных дисков и интенсивным синтезом в них PHК. Пуфы, таким образом, можно рассматривать как высокоактивные в функциональном отношении тканеспецифичные и стадиеспецифичные гены. Установлена роль гормонов (в частности экдизона - гормона окукливания в индукции пуфов), а также роль белков, синтезированных ранними пуфами, в индукции поздних пуфов.
Иными словами, стероидные гормоны и белки - вероятно, не единственные факторы, ответственные за переключение генов в онтогенезе, а следовательно, и за смену фаз индивидуального развития организма. Особенно велика роль стероидных гормонов в регуляции генной активности у животных. Известно, что гормоны синтезируются в специализированных клетках желез внутренней секреции и циркулируют по всему организму.
Однако отдельные гормоны активируют гены не во всех клетках, а только в клетках-мишенях, содержащих специальные рецепторные белки, с которыми специфически связываются молекулы гормона. Это связывание происходит в цитоплазме, а затем образовавшийся комплекс проникает в ядро, где он взаимодействует с определенными негистоновыми белками хромосом. В отсутствие гормонов эти белки блокируют либо промоторные, либо иные, пока неизвестные регуляторные участки определенных генов.
Комплекс «гормон-рецепторный белок» снимает блокирующее действие негистонового белка-репрессора, следствием чего являются транскрипция данного гена, созревание и-РНК, транспорт ее в цитоплазму и синтез белка.
1.6. Поведение клеток в культуре тканей.
Анализ особенностей действия генов оказался возможным при изучении клеток в условиях культуры тканей. Современная методика позволяет в условиях твердых или жидких сред вводить группы клеток или отдельные клетки и обеспечивать их размножение. В некоторых случаях перевиваемые культуры клеток живут неограниченно долго. Получение колонии из отдельных клеток позволяет экспериментировать с клетками человека и других животных на уровне методик работы с микроорганизмами.
На этой основе развились современные исследования по изучению частот естественного и индуцированного мутагенеза по отдельным генам в клетках человека. Характерной чертой поведения дифференцированных клеток при их введении в культуру ткани служит процесс дедифференцировки. Клетки теряют специализированные функции и превращаются в фибробласты, похожие на клетки из раннего эмбрионального развития. Эти факты свидетельствуют, что, попадая в культуру ткани, в пробирке дифференцированные клетки теряют связь с регулирующей программой, и их гены, обеспечивавшие специализированные функции, «замолкают» в изолированных от организма условиях культуры ткани.
Вместе с тем имеются факты, когда функции генов жестко определяются создавшимися в клетке условиями. В этих случаях введение специализированных клеток в культуру не лишает их способности синтезировать свойственные им вещества. Это касается клеток, синтезирующих коллаген. Клетки из раковых опухолей эндокринных желез продолжают синтезировать гормоны. В некоторых случаях перевод клеток в культуры «запускает» функции генов. Описаны случаи, когда клетки в культуре из нормальных тканей начинали синтезировать инсулин.
Молчащие гены переходят в функциональное состояние под контролем биохимических регуляторов. Это показано на введении ядерных эритроцитов кур в условия культуры клеток человека НеLа. Клетки HeLa снабжают эритроциты кур веществами - дерепрессорами генов. Объем ядра эритроцитов увеличивается, и затем начинается транскрипция и-РНК и синтез белков. В течение клеточного цикла работа генов прерывается на время митоза. Это было доказано при исследовании синхронизированных культур клеток.
Изложенные факты свидетельствуют о многообразных формах регуляции действия генов в разных периодах и условиях индивидуального развития. Задача будущего - пройдя этап отдельных наблюдений, создать теорию регуляции генетической информации в процессах развития особи.
Тератогенез. Тератогенные факторы. Тератогенные периоды онтогенеза.

Тератогены (от греч. Τέρατος - урод, чудовище, урод ) - химические, физические и биологические факторы (например: ионизирующее излучение, некоторые лекарственные препараты, яды, вирусы) способны нарушать процессы эмбриогенеза, что приводит к возникновению аномалий развития. Механизм возникновения пороков развития называется тератогенезом.
К веществам, которые обладают тератогенным действием, относят алкоголь, никотин, наркотики, стрептомицин, тетрациклин, антагонисты фолиевой кислоты. Тератогенный эффект могут вызвать возбудители инфекционных заболеваний (простой герпес, вирусный гепатит, грипп, краснуха, ветрянка, токсоплазмоз, вирусы Коксаки, цитомегаловирус и др.).
В возникновении уродства имеет значение как действие (природа) тератогенного фактора, так и видовые, индивидуальные, возрастные и другие особенности каждого организма, на который подействовал тератогенный фактор. Один и тот же недостаток можно вызвать действием различных факторов и, наоборот, различные пороки развития возникают при действии одного и того же фактора.
На разных стадиях развития зародыш имеет неодинаковую чувствительность к повреждающему фактору среды. Периоды наибольшей чувствительности к тем или другим факторам получили название "критические периоды развития". Так, у человека такими периодами являются прогенез (гаметогенез), оплодотворение, имплантация (конец 1 - го и начало 2 - й недели внутриутробного развития), плацентация (у человека 3 - 6-й неделе беременности), гисто - и органогенез (3 - 4 -й месяц эмбриогенеза), роды.
К механическим факторам относят давление, сотрясения, механическую травму и др.
Среди физических факторов наибольшее значение имеют различные виды радиации, особенно проникающей, гипо - и гипертермия. Ионизирующее излучение (один из самых тяжелых за эффектом тератогенов) в различных дозах вызывает различной степени нарушения развития и различные формы уродства. Ионизирующее излучение даже в малых дозах, не вызывая патологических сдвигов в организме, вызывает мутагенный эффект на половые клетки. К уродливости приводит воздействие высокой температуры.
Значительным разнообразием характеризуются химические тератогены. Это могут быть случайные бытовые отравления и алкоголизм, хронические производственные отравления, лекарственные вещества.
К биологическим тератогенам относятся бактериальные токсины, вирусы, факторы иммунологической несовместимости. Например, вирус краснухи, гриппа, дифтерийный токсин. Особую заботу вызывают теперь употребление алкоголя, курение, злоупотребление лекарствами или наркотиками, которые негативно влияют на внутриутробное или постнатальное развитие.
Алкоголь - частый тератоген, а злоупотребление алкоголем во время беременности - частая причина химического индуцированного тератогенеза. Он непосредственная причина каждой 10- й эмбриональной патологии. С 10 умственно неполноценных детей пятеро рождается от родителей-алкоголиков. Чрезвычайно широкий спектр аномалий проявляется у детей, рожденных матерями, которые злоупотребляли алкоголем: пороки развития сердца, почек, половых органов, кожи, скелета и суставов, анэнцефалии, гидроцефалии, микроцефалии, челюстно - лицевой аномалии.
2.1.Врожденные пороки развития. Их классификация.
Врожденными пороками развития называют такие структурные нарушения, которые возникают в пренатальном онтогенезе, проявляются сразу или через некоторое время после рождения и вызывают нарушение функции органа. Последнее отличает врожденные пороки развития органов от аномалий, при которых нарушения функции обычно не встречаются. Поскольку врожденные пороки развития являются причиной примерно 20% смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетики, детской хирургии и ортопедии, патологической анатомии, то знание вопросов профилактики, этиологии, патогенеза, лечения и прогноза врожденных пороков развития имеют большое значение.
Различают несколько критериев, по которым классифицируют врожденные пороки развития: 1) причина их возникновения, 2)стадия, на которой оказывается воздействие, 3) последовательность их формирования в организме, 4) распостраненность и локализация.
В основе классификации врожденных пороков, принятой Всемирной организацией здравоохранения (ВОЗ), лежит анатомо-физиологический принцип (по месту локализации). В зависимости от причины возникновения все врожденные пороки развития разделяют на наследственные, экзогенные и мультифакториальные.
К наследственным относят пороки, вызванные изменением генов или хромосом в гаметах родителей, в результате чего зигота с момента возникновения несет соответствующую мутацию.
Экзогенными называют пороки, возникшие под влиянием тератогенных факторов, то есть компонентов окружающей среды различной природы и происхождения, действуя при эмбриогенеза, нарушают развитие тканей и органов (различные виды излучений, промышленные, пестициды, лекарственные препараты, вирусы, алкоголь, табачный дым и проч.).
Мультифакториальными называют пороки, возникающие в организме под влиянием как генетических, так и экзогенных факторов. Это можно понять, выходя из того, что факторы окружающей среды нарушают наследственный аппарат в клетках организма, который развивается.
Все нарушения, происходящие в пренатальном онтогенезе в зависимости от стадии, на которой проявляется генетическое или экзогенное воздействие, разделяют на гаметопатии, бластопатии, эмбриопатии и фетопатии. Если достаточно существенные нарушения развития возникают на стадии зиготы (гаметопатии) или бластулы (бластопатии), то дальнейшее развитие не происходит и зародыш погибает. Наибольшее клиническое значение имеют эмбриопатия и фетопатия.
Эмбриопатия - нарушение, возникшее в период от 15 дней до 8 недель эмбрионального развития.
Нарушения, которые появляются после 10 недель эмбрионального развития, называют фетопатиями. Она характеризирутся патологическими состояниями, которые, как правило, супровождаются отклонениями общего типа: снижением массы, различными функциональными нарушениями, задержкой интеллектуального развития и т.п., а существенные морфологические нарушения отсутствуют.
В зависимости от последовательности возникновения пороки подразделяют на первичные и вторичные. Если первичные недостатки обусловлены непосредственным действием тератогенного фактора, то вторичные - осложнением первичных, патогенетически с ними связаны.
Алкогольный синдром плода. Дети с алкогольным синдромом плода рождаются в 30-45% случаев употребления алкоголя матерями. Характерные черты лица: 1 – малая окружность головы, 2 - низкая носовая перегородка, 3 - складки глаз, 4 - короткий нос, 5 - уменьшенная средняя часть лица, 6 - тонкая нижняя губа.
В свою очередь, первичные пороки развития по распространенности в организме также разделяют на отдельные группы. Если некий недостаток связан только с одним органом, то порок является изолированным, или одиночным; системные пороки охватывают одну систему органов; множественные – имеются в органах двух и более систем.
По филогенетической значимости все врожденные пороки развития можно разделить на филогенетически обусловленные и нефилогенетические.
Филогенетически обусловленными называют такие недостатки, которые по своему виду напоминают определенные органы животных из типа Хордовые и подтипа Позвоночные. Если они напоминают соответствующие органы предковых групп или их зародышей, то такие пороки называют анцестральнимы (предков), или атавистическими (незаращение дужек позвонков и твердого неба, шейные и поясничные ребра, персистирование висцеральных дуг и пр.). Если недостатки напоминают органы родственных современных или древних, но боковых ветвей животных, то их называют аллогенными. Рассматривая филогенетически обусловленные пороки, можна выявить генетическую связь человека с другими хребетнимы, а также понять механизмы возникновения пороков в течении эмбрионального развития.
Нефилогенетическими считаются такие врожденные пороки, которые не имеют аналогов в нормальных предковых позвоночных животных. К таким недостаткам можно отнести, например, двойниковые увечья и эмбриональные опухоли, которые появляются вследствие нарушения эмбриогенеза, не отражают филогенетических закономерностей.
Установление причины врожденных пороков имеет большое прогностическое значение для носителя этих пороков и профилактическое - по следующему потомства. В настоящее время медицинские генетики и другие специалисты существенно продвинулись в области так называемого синдромологического анализа. Синдромологического анализ - это обобщенный анализ фенотипа больных с целью выявления устойчивых сочетаний признаков. Овладение этим методом помогает в установлении причины возникновения недостатков и основных патогенетических механизмов.
2.2.Факторы среды, вызывающие нарушения развития.
Факторы, которые вызывают изменения развития (аномалии, от греч. Тератод -чудовище), называются тератогенами. Наука о врожденных аномалиях называется тератологией. Врожденные аномалии, врожденные пороки развития - это тератомы.
Тератогены действуют в течение определенных критических периодов. Для любого органа наиболее критическим периодом является время его роста и образования специфических структур. Различные органы имеют разные критические периоды. Сердце формируется между 3 - м и 4 - й неделями. Головной мозг и скелет чувствительны к вредным воздействиям постоянно, начиная с 3 - й недели после оплодотворения до конца беременности.
Существует очень много тератогенов. Ионизирующая радиация, лекарственные препараты приводят к разрыву хромосом и изменения структуры ДНК.
К тератогенам можно отнести некоторые вирусы. У женщин, перенесших краснуху в первой трети беременности, в каждом из шести случаев рождались дети с катарактой, пороками слуха и глухотой. Чем раньше вирус краснухи поражает беременную женщину, тем больше риск, что пострадает зародыш.
Тератогенное действие имеют простейшие из класса споровики - токсоплазма. Если мать больна токсоплазмозом, то через плаценту токсоплазмы могут попасть в зародыш и вызвать поражение мозга и глаз. Многие лекарства способны вызывать пороки развития. Например, хинин может вызвать глухоту. Очень слабый транквилизатор талидомид широко использовался в 60 - х годах XX в. Он способен вызывает такие пороки, при которых длинные кости конечностей или отсутствуют, или резко деформированы, в результате чего образуются конечности, напоминающие плавники тюленя. У женщин, принимавших талидомид, родилось более 7000 детей с недостатками.
Вызвать пороки развития может патологическое состояние здоровья матери. Одной из причин врожденных пороков можно считать гипоксию. Гипоксия в период органогенеза тормозит плацентацию, развитие зародыша, и в ряде случаев, приводит к появлению врожденных пороков и гибели плода.
Неполноценное питание матери, дефицит микроэлементов, например, цинка, приводит к развитию пороков центральной нервной системы, гидроцефалии, микро - и анофтальмии, искривлению позвоночника, пороков сердца т.п.
Эндокринные заболевания у беременных часто являются причиной самопроизвольного аборта или нарушения морфологической и функциональной дифференциации органов плода, которые определяют высокую раннюю детскую смертность. Тератогенный эффект доказан при сахарном диабете. Диабетическая эмбриопатия проявляется комплексом врожденных пороков, из которых 37% - пороки костно-мышечной системы, 24% - пороки сердца и сосудов, 14 % - пороки центральной нервной системы. Пороки развития детей при сахарном диабете матери наблюдаются в 6% случаев.
2.3. Нейрогуморальная регуляция процессов роста и развития.
Скорость роста различных органов и тканей не одинакова, что приводит к определенным диспропорциям тела человека в эмбриогенезе и после рождения.
Регуляция роста сложная. Важное значение имеют генетическая конструкция и факторы внешней среды. Почти у каждого вида есть генетические линии, которые характеризуют предельные размеры особей. Реалезация же генетической информации в значительной степени зависит от действия гормонов. Наиболее важным гормоном является соматотропин, который вырабатывается гипофизом с момента рождения до подросткового возраста. Гормон щитовидной железы - тироксин - также играет важную роль в течение всего периода роста.
Скорость роста организма в постнатальном онтогенезе постепенно снижается до четырехлетнего возраста, затем некоторое время остается постоянной, а в определенном возрасте дает "скачок", который называется пубертатным скачком роста. Это связано с периодом полового созревания.
На рост и развитие человека влияют и некоторые патологические состояния. Например, при значительных нарушениях генетического материала в случае многочисленных аномалий половых хромосом (ХО, XXY, XXX, XYY). В частности, при синдроме Шерешевского-Тернера резко подавляется соматическое и половое созревание, при синдроме XYY мужчины имеют высокий рост, хорошо развитую мускулатуру.
На процессы развития значительное влияние оказывают отклонения в функционировании эндокринных желез как центрального, так и периферического происхождения. Классическими примерами таких нарушений является карликовость (нанизм) гипофизарного или гипоталамического происхождения, гигантизм, гипотиреоз.
3. Клеточные механизмы возникновения врожденных пороков развития. Стволовые клетки, их применение в медицине.
Первое предположение о существовании стволовых клеток было высказано именно русским ученым!
Максимов Александр Александрович (04.02.1874 – 04.12.1928) – выдающийся русский ученый, один из создателей унитарной теории кроветворения. Максимов А. А. родился в Санкт-Петербурге, где в 1896 году с отличием окончил Военно-медицинскую академию. С 1903 по 1922 гг. Максимов А. А. занимал пост профессора кафедры гистологии Военно-медицинской академии.
Максимов А. А. во многом предопределил направление развития мировой науки в области клеточной биологии. Его труды стали мировой научной классикой и до настоящего времени остаются одними из наиболее часто цитируемых среди работ отечественных исследователей.
Термин "стволовая клетка" Максимов А. А. предложил еще в 1908 году, чтобы объяснить механизм быстрого самообновления клеток крови. Он выступил с новой теорией кроветворения в Берлине на съезде гематологов. Именно этот год можно по праву считать началом истории развития исследований стволовых клеток!
Каждые сутки в крови погибают несколько миллиардов клеток, а им на смену приходят новые популяции эритроцитов, лейкоцитов и лимфоцитов. Максимов А. А. первый догадался, что обновление клеток крови — это особая технология, отличная от простых клеточных делений. Если бы клетки крови самообновлялись простым клеточным делением, это потребовало бы гигантских размеров костного мозга.
Несколько позже профессор московского НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи А.Я. Фриденштейн подтвердил предположение коллеги и, изучая возможности этих особых клеток, стал разрабатывать сферу их применения. Первые эксперименты по практическому использованию стволовых клеток были начаты еще в начале 1950-х годов. Именно тогда было доказано, что с помощью трансплантации костного мозга (основного источника стволовых клеток) можно спасти животных, получивших смертельную дозу радиоактивного облучения.
Понадобилось почти 20 лет, чтобы трансплантация костного мозга вошла в арсенал практической медицины. Только в конце 60-х были получены убедительные данные о возможности применения трансплантации костного мозга при лечении острых лейкозов.
В начале века ученые уже подозревали, что во многих тканях существуют клетки, способствующие регенерации (восстановлению) этих тканей и активизирующие деление обычных клеток. В 60-х годах советские ученые Александр Фриденштейн и Иосиф Чертков заложили основы науки о стволовых клетках костного мозга, доказав, что именно там главным образом и находится своеобразное депо замечательных клеток. Потом стало известно, что часть стволовых клеток мигрирует в крови, есть они и в различных тканях, в частности в кожной и жировой.
1970 год - Первые трансплантации аутологичных (своих собственных) стволовых клеток. Есть сведения, что в 70-х годах в бывшем СССР делали «прививки молодости» пожилым членам Политбюро КПСС, вводя им 2-3 раза в год препараты стволовых клеток.
1988 год - Стволовые клетки были впервые использованы для трансплантации; мальчик, которому была проведена операция, по сей день, жив и здоров.
1992 год - Первая именная коллекция стволовых клеток. Профессор Дэвид Харрис "на всякий случай" заморозил стволовые клетки пуповинной крови своего первенца. Сегодня Дэвид Харрис – директор крупнейшего в мире банка стволовых клеток пуповинной крови.
1996 год - За период с 1996 года по 2004 год были выполнены 392 трансплантации аутологичных (собственных стволовых клеток человека) стволовых клеток. Так в 1996 году преимущественно осуществлялась трансплантация костного мозга.
1996 год – Доказано, что облучение уничтожает раковые клетки, но убивает и только что пересаженные из костного мозга донора стволовые клетки. С начала 1996 года в РФ действует Закон "О радиоактивной безопасности населения".
1997 год - За предшествующие 10 лет в 45 медицинских центрах мира проведено 143 трансплантации пуповинной крови. В России проведена первая операция онкологическому больному по пересадке стволовых клеток из пуповинной крови младенцев.
1998 год - Первая в мире трансплантация "именных" стволовых клеток пуповинной крови девочке с нейробластомой (опухоль мозга). Биологическая страховка сработала – ребенок спасен. Общее число проведенных трансплантаций пуповинной крови превышает 600.
В этом же году американскими учеными Джеймсом Томсоном и Джоном Беккером удалось выделить человеческие эмбриональные стволовые клетки и получить их первые линии.
В 1998 г. ученые нашли способ выращивать стволовые клетки в питательной среде.
1999 год - Журнал «Science» признал открытие эмбриональных стволовых клеток третьим по значимости событием в биологии после расшифровки двойной спирали ДНК и программы «Геном человека».
В 1999 году между Санкт-Петербургским Государственным Медицинским Университетом имени академика И. П. Павлова и Европейским институтом поддержки и развития трансплантологии был заключен договор, согласно которому в Университете создается отделение трансплантации костного мозга, соответствующее всем международным требованиям. Открытие отделения произошло в июне 2000 года. Основная цель - выполнение трансплантации гемопоэтических стволовых клеток, в том числе и от неродственных доноров.
2000 год - В мире проведено 1.200 трансплантаций стволовых клеток пуповинной крови, из них двести родственных. Шестилетний ребенок с анемией Фанкони вылечен с помощью стволовых клеток пуповинной крови своего новорожденного брата. В этой истории интересно то, что второй ребенок был рожден после искусственного оплодотворения (ЭКО). Среди полученных эмбрионов был выбран один наиболее совместимый с реципиентом и не содержащий признаков болезни.
2001 год - Опубликованы первые официальные данные о возможности применения трансплантации стволовых клеток пуповинной крови у взрослых пациентов. Из них более 90% с хорошим результатом.
В этом же году показана способность взрослых гемопоэтических и стромальных клеток костного мозга человека дифференцироваться в кардиомиоциты и гладкомышечные клетки, эта способность используется в регенеративной кардиологии.
2003 год - Журнал Национальной Академии Наук США (PNAS USA) опубликовал сообщение о том, что через 15 лет хранения в жидком азоте стволовые клетки пуповинной крови полностью сохраняют свои биологические свойства. С этого момента криогенное хранение стволовых клеток стало рассматриваться, как "биологическая страховка". Мировая коллекция стволовых клеток, хранящихся в банках, достигла 72.000 образцов. По данным на сентябрь 2003 г. в мире произведено уже 2.592 трансплантаций стволовых клеток пуповинной крови, из них 1.012 – взрослым пациентам.
В выпуске The Lancet от 4 января 2003 г. опубликовано два сообщения о результатах инъекции аутологичных (собственных) стволовых клеток костного мозга больным, страдающим тяжелой стенокардией или перенесшим инфаркт миокарда. Источником культивированных мононуклеарных клеток служил костный мозг, взятый из гребня подвздошной кости больного. Через несколько месяцев отмечено заметное улучшение перфузии миокарда и функции левого желудочка.
2004 год - Общая мировая коллекция стволовых клеток пуповинной крови приближается к 400.000 образцов. В мире произведено около 5.000 трансплантаций пуповинной крови. Для сравнения, число трансплантаций костного мозга за тот же период составило около 85.000.
2005 год - Перечень заболеваний, при лечении которых может быть успешно применена трансплантация стволовых клеток, достигает нескольких десятков. Основное внимание уделяется лечению злокачественных новообразований, различных форм лейкозов и других болезней крови. Появляются сообщения об успешной трансплантации стволовых клеток при заболеваниях сердечно-сосудистой и нервной систем. Разработаны международные протоколы лечения рассеянного склероза. Проводятся многоцентровые исследования при лечении инфаркта миокарда и сердечной недостаточности. Ищутся подходы к лечению инсульта, болезни Паркинсона и Альцгеймера.
Исследования, как эмбриональных стволовых клеток, так и стволовых клеток взрослого организма ведутся чрезвычайно активно, в мировой научной прессе что ни день появляются все новые сообщения о достижениях ученых: одним удалось получить из стволовых клеток нейроны, другим - кожную или хрящевую ткань, третьим - вырастить сосуды, кость или даже челюсть!
Следующие 20 лет биология будет расшифровывать, как план строения организма упаковывается в одну клетку. Сейчас мы делаем первые шаги, чтобы переосмыслить наши биологические возможности и резервы. Термины "стволовые клетки", "пуповинная кровь", "криобанк" наши соотечественники впервые услышали сравнительно недавно - пять лет назад. Тем не менее, первое предположение о существовании стволовых клеток было высказано именно русским ученым!
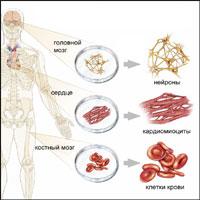
Уже сегодня стволовые клетки успешно используются при лечении тяжелых наследственных и приобретенных заболеваний, болезней сердца, эндокринной системы, неврологических заболеваний, болезнях печени, желудочно-кишечного тракта и легких, заболеваний мочеполовой и опорно-двигательной систем, заболеваний кожи. Во многих случаях своевременное лечение стволовыми клетками буквально «ставит человека на ноги»!
Сегодня фундаментальное изучение и применение стволовых клеток под силу только Медицинским Центрам Федерального значения, таких как ГУ Медицинским радиологическим научным центром Российской Академии Медицинских Наук в Обнинске (ГУ МРНЦ РАМН) и ФГУ Научным центром Акушерства, Гинекологии и Перинатологии Росмедтехнологий (ФГУ НЦ А, ГиП Росмедтехнологий). Надо отметить усилия в продвижении метода клиникой стволовых клеток.
За 21 год успешного изучения стволовых клеток был разработан и лицензирован метод выделения и культивирования мезенхимальных стволовых клеток из аутологичного костного мозга. Разработанная методика культивирования позволяет получить необходимое количество стволовых клеток с нужными характеристиками и их клеточного потомства в различные органы и ткани. При хранении в криобанке полученные культуры сохраняют высокий уровень выживаемости и высокую активность.
Мы располагаем всеми медицинскими технологиями, позволяющими в кратчайшие сроки поставить диагноз и определить круг проблем пациента. При необходимости он может проконсультироваться и получить лечение у наших специалистов. В нашей клинике собраны лучшие специалисты – академики, профессора, доктора и кандидаты наук, которые периодически принимают участие в авторитетных медицинских конгрессах, как в России, так и за рубежом.
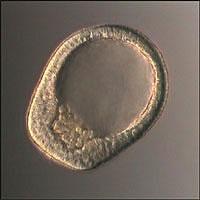
На сегодняшнем этапе развития науки ученые умеют выделять ранние недифференцированные стволовые клетки из бластоцист – пятидневных зародышей, представляющих собой эмбрион сферической формы, образующийся при делении оплодотворенной яйцеклетки, насчитывающий порядка сотен клеток и впоследствии развивающийся в плод. Такие эмбриональные стволовые клетки могут давать начало практически всем клеткам, входящим в состав человеческого организма, а также обладают способностью к самовоспроизведению в культуре. Возможность выращивать линии как эмбриональных, так и региональных плюрипотентных стволовых клеток в лабораторных условиях и направлять их дифференцировку в нужном направлении является ключом к спасению огромного количества жизней посредством контроля над развитием злокачественных опухолей, восстановления подвижности перенесших инсульт пациентов, излечения диабета, регенерации тканей поврежденного спинного и головного мозга, а также излечение многочисленных заболеваний, ассоциированных со старением. Таким образом, стволовые клетки дают исследователям возможность – впервые в истории человечества – манипулировать индивидуальным геномом in vitro. 
Уникальность взрослых стволовых клеток в том, что они позволяют в реальном времени декодировать как универсальные, общевидовые программы, так и индивидуальные программы развития одного организма. Стволовые клетки позволяют исследователям продвигаться вверх от «текста» гена к его функции: сперва в одном типе клеток, затем в разных органах и, наконец, в целом организме. Стволовые клетки в одном лице и «программисты», и «операторы» программ эмбриогенеза. Уникальная способность этих клеток воспроизводить эмбриогенез человека в лабораторных условиях делает их ключевыми игроками современной биологии.
В отличие от оплодотворенной яйцеклетки, имеющей лишь одну заданную траекторию развития, ЭСК и СК наделены гибкими альтернативными программами развития. Хотя в реальных условиях организма каждая клетка имеет лишь «one way ticket» («билет в одну сторону»), общий потенциал стволовых клеток организма позволяет обращать вспять до сих пор необратимые химические повреждения ДНК и клеточных органелл. Практические возможности индивидуального генома на уровне потенций ЭСК и ПСК только начинают осмысляться. Но уже очевидно, что расшифровка направленного репрограммирования стволовых клеток в культуре открывает дорогу в медицину ближайшего будущего. [Репин B.C., и др., 2002].
Технология выращивания искусственных органов на основе стволовых клеток
Биопринтер — биологическая вариация технологии reprap, устройство, способное из клеток создавать любой орган, нанося клетки слой за слоем, уже создано. В декабре 2009 года американской кампанией Organovo и австралийской кампанией Invetech было разработан биопринтер, рассчитанный на мелкосерийный промышленный выпуск. Вместо того, чтобы вырастить нужный орган в пробирке, гораздо легче его напечатать — так считают разработчики концепции.
Разработки технологии начались ещё несколько лет назад. До сих пор над данной технологией работают исследователи сразу в нескольких институтах и университетах. Но больше преуспели на этой ниве профессор Габор Форгач (Gabor Forgacs) и сотрудники его лаборатории Forgacslab в университете Миссури в рамках проекта Organ Printing, раскрывшие новые тонкости биопечати ещё в 2007 году. Для коммерциализации своих разработок профессор и сотрудники основали кампанию Organovo. Кампанией была создана технология NovoGen, которая включала в себя все необходимые детали биопечати как в биологической части, так и в части "железа". Была разработана лазерная калибровочная система и роботизированная система позиционирования головок, точность которой составляет несколько микрометров. Это очень важно для размещения клеток в правильном положении. Первые экспериментальные принтеры для Organovo (и по её "эскизам") строила компания nScrypt (рисунок 2). Но те устройства были ещё не приспособлены для практического использования, и применялись для шлифовки технологии.
В мае 2009 года кампания Organovo выбрала в качестве промышленного партнёра медицинскую кампанию Invetech. Эта кампания обладает более чем 30-летним опытом производства лабораторного и медицинского оборудования, в том числе и компьютеризированного. В начале декабря первый экземпляр 3D-биопринтера, воплощающего в себе технологию NovoGen, был отправлен из Invetech в Organovo. Новинку отличают компактные размеры, интуитивно понятный компьютерный интерфейс, высокая степень интеграции узлов и высокая надёжность. В ближайшее время Invetech намерена поставить ещё несколько таких же аппаратов для Organovo, а она уже займётся распространением новинки в научном сообществе. Новый аппарат имеет настолько скромные габариты, что его можно будет поставить в биологический шкаф, который необходим для того, чтобы обеспечить стерильную среду в процессе печати
Надо сказать, что биопечать — не единственный способ искусственно создавать органы. Однако, классический способ выращивания требует прежде всего изготовить каркас, задающий форму будущего органа. При этом сам каркас несёт опасность стать инициатором воспаления органа.
Преимущество биопринтера в том, что он не требует такого каркаса. Форму органа задаёт само печатающее устройство, располагая клетки в требуемом порядке. Сам биопринтер имеет две головки, наполняемые двумя типами чернил. В роли чернил в первой используются клетки различных типов, а во второй — вспомогательные материалы (поддерживающий гидрогель, коллаген, факторы роста). «Цветов» у принтера может быть больше двух — если требуется использовать разные клетки или вспомогательные материалы разного вида.
Особенностью технологии NovoGen является то, что печать ведётся не отдельными клетками. Принтер наносит сразу конгломерат из нескольких десятков тысяч клеток. Это есть основное отличие технологии NovoGen от других технологий биопечати.
Схема работы принтера представлена на рисунке 4.
Итак, сначала выращиваются требуемые ткани. Затем выращенная ткань нарезается цилиндрами в соотношении диаметра к длине 1:1 (пункт a). Далее — пункт b — эти цилиндрики на время помещаются в специальную питательную среду, где они приобретают форму маленьких шаров. Диаметр такого шара — 500 микрометров (пол миллиметра). Оранжевый цвет ткани придаётся с помощью специального красителя. Далее, шарики загружаются в картридж (пункт c) — который содержит пипетки, наполняемые шариками в порядке один-за-другим. Сам трёхмерный биопринтер (пункт d) должен наносить эти сфероиды с микрометровой точностью (то есть ошибка должна быть меньше тысячной доли миллиметра). Принтер также оборудуется камерами, которые способны наблюдать в реальном времени процесс печати.
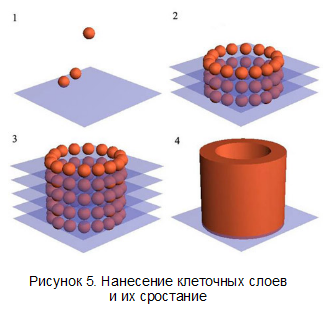
Созданный образец принтера работает сразу с тремя «цветами» - два вида клеток (в последних опытах Форгача это были клетки сердечной мышцы и эпителиальные клетки) — а третий — это смесь, включающая в себя скрепляющий гель, содержащий коллаген, фактор роста и ряд других веществ. Эта смесь позволяет органу сохранять форму, прежде чем клетки срастутся между собой (пункт d). По словам Габора, принтер не воспроизводит структуру органа в точности. Однако, этого и не требуется. Природная программа клеток сама корректирует структуру органа.
Схема собирания органа и срастания шаров в орган показана на рисунке 5.
В ходе экспериментов биопринтер из клеток эндотелия и клеток сердечной мышцы цыпленка напечатал «сердце» (рисунок 6). Через 70 часов шарики срослись в единую систему, а через 90 часов - «сердце» начало сокращаться. Причём клетки эндотелия сформировали структуры, подобные капиллярам. Также мышечные клетки, первоначально сокращавшиеся хаотично, с течением времени самостоятельно синхронизировались и стали сокращаться одновременно. Впрочем, к практическому использованию этот прототип сердца пока что не пригодно — даже если вместо куриных клеток использовать человеческие — технология биопечати должна быть ещё улучшена.



Гораздо лучше принтер справляется с созданием более простых органов — например, кусков человеческой кожи или кровеносных сосудов. При печати кровеносных сосудов коллагеновый клей наносится не только на края сосуда, но и в середину. А затем, когда клетки сростутся, клей с лёгкостью удаляется. Стенки сосуда состоят из трех слоёв клеток — эндотелий, гладкие мышцы и фибробласты. Но исследования показали, что в печати можно воспроизводить только один слой, состоящий из смеси этих клеток — клетки сами мигрируют и выстраиваются в три однородных слоя. Этот факт может облегчить процесс печати многих органов. Таким образом команда Форгача уже может создавать очень тонкие и ветвящиеся сосуды любой формы. Сейчас исследователи работают над наращиванием слоя мышц на сосудах, что сделает сосуды применимыми для имплантации. Особый интерес представляют сосуды толщиной менее 6 миллиметров — так как для больших существуют подходящие синтетические материалы.
Иллюстрация с другими экспериментами биопечати — на рисунке 7. 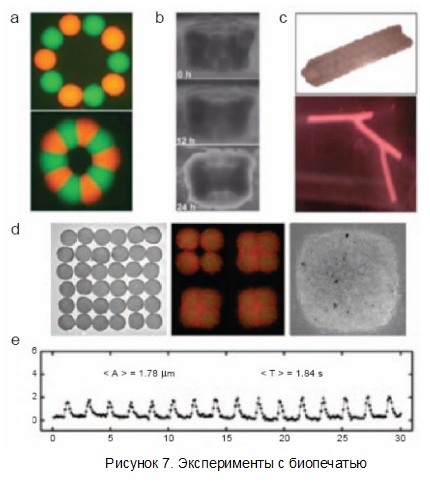
Пункт a — кольцо из двух видов биочернил. Они специально окрашены разными флуоресцирующими веществами. Ниже — это же кольцо через 60 часов. Клетки самостоятельно срастаются. Пункт b - развитие трубки, набранной из колец, показанных на картинке. Пункт c сверху - 12-слойная трубка, составленная из клеток гладких мышечных волокон пуповины; пункт c, внизу - разветвлённая трубка прообраз сосудов для трансплантации. Пункт d - построение сокращающейся сердечной ткани. Слева показана решётка (6 на 6) из сфероидов с клетками сердечной мышцы (без эндотелия), распечатанных на коллагеновой "биобумаге". Если в те же "чернила" добавляются клетки эндотелия (второй рисунок — красный цвет, кардиомиоциты же тут показаны зелёным), они заполняют сначала пространство между сфероидами, а через 70 часов (пункт d, справа) вся ткань становится единым целым. Внизу: график сокращения клеток полученной ткани. Как видно, амплитуда (отмерена по вертикали) сокращений составляет примерно 2 микрона, а период — около двух секунд (время отмечено по горизонтали) (фото и иллюстрации Forgacs et al).
На рисунке 8 также приведены структура распечатанных тканей сердца (фотографии Forgacs etal).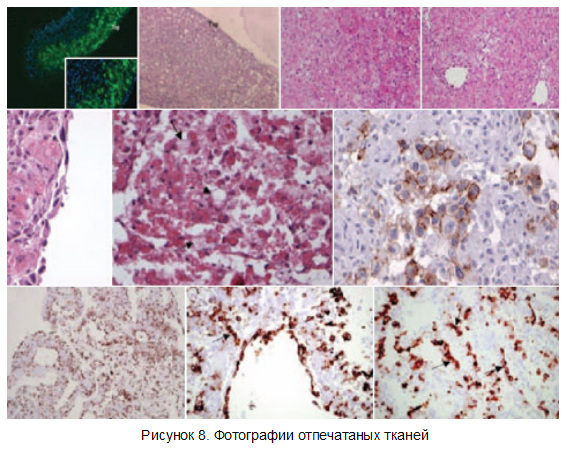
Первые образцы 3D-биопринтера от Organovo и Invetech будут доступны для исследовательских и медицинских организаций в 2011 году.
Следует отметить, что Organovo не является единственным игроком на данном рынке. Некоторое время назад западная биотехнологическая компания Tengion представила свою технологию воссоздания органов. Между подходами Tengion и Organovo есть некоторые различия. К примеру две технологии по-разному подходят к организации живых клеток в группы для создания тканей, кроме того принтеры компаний по-разному подходят к проблеме получения образцов и генного анализа. В обеих компания отмечают, что сталкиваются с одними и теми же трудностями - довольно сложно воспроизводить сложные ткани, оба принтера очень долго настраиваются на один тип трехмерной печати. Также разработка самого принтера — это лишь часть задачи. Также требуется создать специальное программное обеспечение, которое поможет моделировать ткань перед печатью и быстро перенастроить принтер. Сам принтер должен справится с созданием сложнейшего органа за несколько часов. По тонким капиллярам следует как можно скорее подавать питательные вещества, иначе орган погибнет. Тем не менее, обе компании имеют одинаковую конечную цель – «печать» органов человека.
Поначалу оборудование будет использоваться в исследовательских целях. Например, напечатанные фрагменты печени можно будет использовать в токсикологических экспериментах. Позже искусственные фрагменты кожи и мышц, капилляры, кости можно будет использовать для лечения тяжёлых травм и для пластических операций. Как Organovo, так и Tengion сходятся в том, что оборудование, способное быстро и качественно печатать органы целиком появится примерно в 2025-2030 году. Внедрение биопечати позволит сильно удешевить создание новых органов. Новые органы можно будет использовать для замены устаревших частей тела человека и как результат - радикального продления жизни (иммортализма). В перспективе биопечать позволит изобретать новые биологические органы для усовершенствования человека и животных и изобретения искусственых живых существ.
3.2.Технологии биопечати.
Этот пост о биопринтерах - изобретении, которое поможет человеку выращивать новые органы взамен износившихся от старости и таким образом значительно продлить ему жизнь.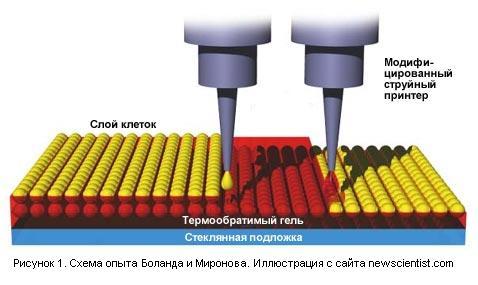
О технологии биопечати, разработанной Габором Форгачем в кампании Organovo, я уже рассказывал в одном из своих прошлых постов. Однако, это не единственная технология создания искусственного создания органов из клеток. Справедливости ради стоит рассмотреть другие. Пока что до массового применения они все далеки, но то, что такие работы ведутся, радует и вселяет надежду, что по крайней мере одна линия искусственных органов достигнет успеха.
Первое — это разработки американских учёных Владимира Миронова (Vladimir Mironov) из медицинского университета Южной Каролины (Medical University of South Carolina) и Томаса Боланда (Thomas Boland) из университета Клемсона (Clemson University). Первым исследования начал доктор Боланд, который придумал идею и начал исследования в своей лаборатории, и увлёк ею своего коллегу.
Вместе они с помощью принтера смогли реализовать технологию нанесения клеток слой за слоем. Для опыта были взяты старые принтеры Hewlett-Packard – старые модели использовались потому что у их картриджей достаточно крупные отверстия, чтобы не повредить клетки. Картриджи были тщательно очищены от чернил, и вместо чернил в них была залита клеточная масса. Также пришлось несколько переделать конструкцию принтера, создать программное обеспечение для контроля над температурой, электрическим сопротивлением и вязкостью "живых чернил".
Наносить клетки на плоскость слой-за-слоем ранее пытались и другие учёные, но эти впервые смогли это сделать с помощью струйного принтера.
На нанесении клеток на плоскость учёные останавливаться не собираются.
Чтоб напечатать трёхмерный орган, в качестве клея для соединения клеток предполагается использовать экзотический термообратимый (или "термореверсируемый") гель, созданный недавно Анной Гатовска (Anna Gutowska) из тихоокеанской северо-западной национальной лаборатории (Pacific Northwest National Laboratory) .
Этот гель является жидким при 20 градусах по Цельсию и затвердевает при температуре выше, чем 32 градуса. И, к счастью, он не вреден для биологических тканей.
При печати на стеклянную подложку наносятся через один слои клеток и слои геля (см. рисунок 1). Если слои достаточно тонкие, то клетки потом сростаются. Гель не мешает сростанию клеток, и в то же самое время придаёт конструкции прочность до того момента, когда клетки сростутся. После чего гель может быть легко удалён с помощью воды.
Команда уже провела несколько экспериментов, используя легко доступные клеточные культуры, типа клеток яичника хомяка .
По мнению авторов, трёхмерная печать может решить проблему создания новых органов для медицины взамен повреждённых или выращивание органов для биологических опытов. Скорее всего, первой будет пущено в массовое использование технология выращивания больших участков кожи для лечения людей, поражённых ожогами. Поскольку исходные клетки для культивирования "живых чернил" будут взяты от самого пациента, так что проблемы с отторжением быть не должно .
Заметим также, что традиционное выращивание органов может занять несколько недель — так что пациент может не дождаться нужного органа. При пересадке органа от другого человека обычно только каждому десятому удаётся дождаться своей очереди на орган, остальные погибают. Но технология биопечати при наличии достаточно количества клеток может потребовать всего несколько часов для построения органа.
Во время печати потребуется решать такие проблемы, как питание искусственного органа. Очевидно, принтер должен печатать орган со всеми сосудами и капиллярами, через которые уже в процессе печати следует подавать питательные вещества (впрочем, как показали опыты Габора Форгача, по крайней мере некоторые органы способны формировать капилляры самостоятельно). Также орган должен быть напечатан не более чем за несколько часов — поэтому для повышения прочности креплений клеток предполагается добавлять в скрепляющий раствор белок коллаген .
По прогнозу учёных, уже через несколько лет биопринтеры появятся в клиниках. Перспективы, которые при этом открываются, огромны .
Для печати по этой технологии сложного органа, состоящего из большого количества клеток, требуются картриджи с большим разнообразием чернил. Однако, доктор Фил Кэмпбелл (Phil Campbell) и его коллеги из американского университета Карнеги-Меллона (Carnegie Mellon University), в частности, профессор роботехники Ли Вейсс (Lee Weiss) — которые тоже проводят эксперименты с биопечатью — придумали способ, как уменьшить количество видов чернил без вреда для результирующего органа .
Для этого в качестве одного из биоцветов он предложил использовать раствор, содержащий фактор роста BMP-2. В качестве другого биоцвета стволовые использовались клетки, полученные из мышц ног мышей .
Далее, принтером были нанесены на стекло четыре квадрата со сторонами по 750 микрометров — в каждом из них концентрация гормона роста была различна. Стволовые клетки, оказавшиеся на участках с фактором роста, начали превращаться в клетки костной ткани. И чем большей была концентрация BMP-2, тем выше "урожай" дифференцированных клеток. Стволовые же клетки, которые оказались на чистых участках, превратились в мышечные клетки, так как этот путь развития стволовая клетка выбирает по умолчанию.
Ранее клетки различных видов выращивались отдельно. Но, по словам учёного, совместное выращивание клеток делает эту технику более близкой к природной. "Вы можете создать такую структуру подложки, в которой один конец будет развивать кость, ещё один край — сухожилие, а третий — мускулы. Это обеспечивает вам больший контроль над регенерацией ткани", — говорит автор работы. И при этом будет использоваться только два вида чернил — что упрощает конструкцию биопринтера .
Проблемой управляемого изменения клеточных структур заинтересовались и учёные из России. «На сегодняшний день ведется очень много разработок, связанных с выращиванием тканей из стволовых клеток, — комментирует учёный Николай Адреанов. — Наилучших результатов ученые достигли при выращивании эпителиальной ткани, так как ее клетки очень быстро делятся. А теперь исследователи пытаются с помощью стволовых клеток создать нервные волокна, клетки которых в естественных условиях очень медленно восстанавливаются».
Также по словам Ли Вейсса, занимавшегося разработкой принтера, их технология ещё далека от промышленного внедрения. Кроме того, не помешало бы расширение знания о биологии. "Я могу напечатать довольно сложные вещи. Но, вероятно, один из самых серьёзных ограничивающих факторов (для данной технологии) - это понимание биологии. Нужно точно знать, что именно печатать". На другую проблему указывает кандидат биологических наук, старший научный сотрудник Института биологии развития РАН Александр Ревищин. «В принципе печать тканей “клеточными чернилами” возможна, однако технология пока еще несовершенна, — отметил он — Например, если пересадить стволовые клетки в непривычные условия, эти клетки потеряют нить естественного развития и связь с окружающими клетками, что может привести к их перерождению в опухоль».
Но, будем надеется, что в ближайшие годы технология будет отработана.
Виды стволовых клеток.
Стволовые клетки человека - недифференцированные клеточные элементы, обладающие свойствами самообновления и дифференцировки. Сам термин «стволовая клетка» ввел петербургский гематолог А. Максимов в 1908 году. Вторым основоположником клеточной терапии был С.Воронцов, работавший в 20-е гг. в Париже. Большой вклад в исследования стволовых клеток в России в 60-70-е гг. сделали гематологи А.Фриденштейн и И.Чертков. Стволовые клетки человека можно классифицировать в соответствии с их дифференцировочным потенциалом.
1) Тотипотентные клетки способны формировать все эмбриональные и экстра-эмбриональные типы клеток. К ним относятся только оплодотворённый ооцит и бластомеры 2 – 8 клеточной стадии.
2) Плюрипотентные клетки способны формировать все типы клеток эмбриона. К ним относятся эмбриональные стволовые клетки, первичные половые клетки и клетки эмбриональных карцином.
3) Другие типы стволовых клеток локализуются в сформировавшихся тканях взрослого организма (adult stem cells) и называются взрослыми, регионарными или тканевыми стволовыми клетками. Они варьируют по способности к дифференцировке от мульти- до унипотентных.
Однако в последние годы чаще используется классификация стволовых клеток по источникам их выделения: эмбриональные, фетальные (выделенные из абортивного материала) и стволовые клетки взрослого организма.
|
|
|
|
Первое применение стволовых клеток пуповинной крови в качестве альтернативы трансплантациям костного мозга произошло в 1988 году в Париже, когда ребенку с анемией Фанкони была произведена трансплантация стволовых клеток, выделенных из пуповинной крови сестры.
С этого момента по всему миру - сначала в США и в Европе, а затем и в России, начали создаваться банки пуповинной крови и проводиться сотни исследований с применением терапии стволовыми клетками пуповинной крови.
В 2005 году компания «Транс-Технологии» получила лицензию Федеральной службы по надзору в сфере здравоохранения и социального развития на применение новых клеточных технологий в здравоохранении, после чего был открыт первый в Санкт-Петербурге Банк стволовых клеток. За время работы компанией был накоплен огромный опыт как по хранению, так и по трансплантации стволовых клеток.
1. Эмбриональные стволовые клетки (ЭСК)
получают из так называемой внутренней клеточной массы раннего эмбриона на этапе бластоцисты (4-7 день развития). Это «идеальные» стволовые клетки, из которых в дальнейшем развивается весь организм. Все специализированные клетки организма по мере формирования эмбриона дифференцируются из неспециализированных эмбриональных стволовых клеток.
Эмбриональные стволовые клетки обладают рядом положительных и отрицательных характеристик, к которым относятся:
Плюрипотентность - способность стволовой клетки дифференцироваться в несколько типов клеток различных тканей и органов (нервные клетки, красные кровяные тельца, клетки печени, клетки поджелудочной железы, кардиомиоциты, клетки эпидермиса, мышечные клетки и др.).
Низкий уровень иммунореактивности – Эмбриональные стволовые клетки не несут на своих мембранах специфических молекул, которые могут быть опознаны иммунными клетками реципиента как чужеродные. По этой причине эмбриональные стволовые клетки практически никогда не отторгаются после трансплантации и не вызывают так называемой «реакции хозяин против трансплантата.
Онкологические осложнения - трансплантация эмбриональных СК может спровоцировать рост доброкачественных и злокачественных новообразований. 
Формирование тератомы после трансплантации эмбриональных стволовых клеток при моделировании экспериментального инсульта.
Erdo F, Buhrle C, Blunk J, Hoehn M, Xia Y, Fleischmann BK, Focking M, Kustermann E, Kolossov E, Hescheler J, Hossmann K-A, and Trapp T.
Host-dependent tumorogenesis of embrionic stem sell transplantation in experimental stroke. Journal of Cerebral Bloob Flow and Methabolism. 2003, 23:780-785.
Этический аспект - Основным источником эмбриональных СК является абортивный материал или материал, оставшийся невостребованным после искусственного оплодотворения.
В случае ЭСК невозможно использовать аутологичный (собственный) материал
1. Фетальный клеточный материал - клетки зародыша на 9-12 неделе развития.
Наиболее веским обоснованием для использования фетального материала является возможность применения материала необходимого генеза. Вместе с тем возникают проблемы этического характера, а также множество вопросов относительно качества материала.
Возможность применения материала необходимого генеза - В 60-90-е гг. прошлого века при лечении психоневрологических заболеваний трансплантировали фетальный клеточный материал, в котором присутствовали стволовые клетки поврежденной ткани.
Этический аспект – Материал, оставшийся в результате прерывания беременности, т.е. аборта.
Качество материала - Использование непроверенного фетального материала может привести к заражению реципиента СПИДом, гепатитами, цитомегаловирусом и др. Проверка материала занимает время и достаточно дорогостоящая, что приводит к увеличению стоимости услуг.
1. ГЕМОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ (ГСК)
Гемопоэтические стволовые клетки (ГСК) - популяция мультипотентных стволовых клеток - в настоящее время охарактеризована наиболее полно. ГСК находятся в красном костном мозге взрослого организма. Впервые популяция ГСК была выделена из костного мозга (КМ) мыши около 30 лет назад. Клоногенные свойства этих клеток, доказанные позднее в экспериментах in vivo и in vitro, позволили выделять данные клетки с высоким уровнем чистоты (~85 %-95 %). Фенотипическим "портретом" чистых популяций ГСК считается присутствие на поверхности клетки маркеров CD34, CD133, c-kit (CD117), и отсутствие CD38, и специфических маркеров коммитированных клеток крови: гликофорина A, CD2,CD3, CD4, CD8, CD14, CD15, CD16, CD19, CD20, CD56 и CD66b (Lin-). Долгое время считалось, что ГСК способны дифференцироваться только в клетки крови. Однако исследования по выявлению мультипотентности ГСК, выполненные в последние годы, показали, что при трансплантации в кровоток ГСК могут дифференцироваться также в гепатоциты, клетки эпителия и эндотелий.
На основании экспериментальных работ, выполненных в течение последних лет, ГСК можно считать агентами клеточной терапии только при повреждениях печени и сосудов. Несмотря на разработанные протоколы выделения чистых популяций ГСК из взрослого организма, нет методик их культивирования in vitro(в лабораторных условиях). Существующие методы позволяют лишь сохранить или незначительно обогатить популяцию гемопоэтических стволовых клеток. Уже первые попытки их культивирования показали необходимость присутствия фидерного слоя из клеток стромы костного мозга. Как выяснилось позднее, именно клетки стромы костного мозга являются ключевыми регуляторами популяции ГСК. Стромальные элементы определяют пролиферацию и дифференцировку ГСК в костном мозге. Следует отметить, что стромальные клеточные элементы выделяют факторы, определяющие дифференцировку ГСК и миграцию ГСК в костный мозг.
ГСК способны мигрировать не только в костный мозг, но и из костного мозга в кровоток. Показано, что выход ГСК из костного мозга происходит в ответ на воздействие факторов мобилизации: гранулоцитарно-макрафагального колоние-стимулирующего фактора (ГМ-КСФ), гранулоцитарного колоние-стимулирующего фактора (Г-КСФ). Эти факторы также выделяются клетками стромы. Воздействие ГМ-КСФ и Г-КСФ увеличивает количество ГСК в периферической крови на порядок.
ГСК могут являться инструментом клеточной терапии при некоторых заболеваниях. Современный уровень развития биотехнологии позволяет исследователям использовать аутологичные ГСК, выделяя их из периферической крови в достаточном количестве. Однако механизмы трансдифференцировки ГСК в настоящий момент изучены недостаточно.
До последнего времени костный мозг являлся единственным источником гемопоэтических стволовых клеток. После некоторых медицинских процедур и введения в организм так 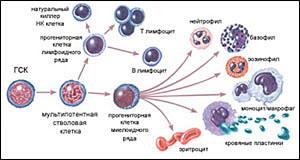
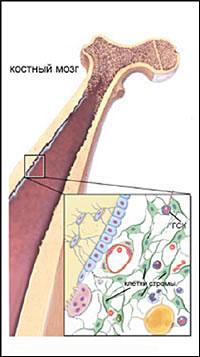
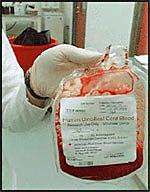
называемых факторов мобилизации (Г-КСФ и ГМ-КСФ) в периферической крови можно увеличить количество ГСК. Нехватка образцов костного мозга заставила исследователей обратить внимание на альтернативные источники стволовых клеток крови. Несомненно, одним из них является пуповинная/плацентарная кровь. В последние годы исследования применимости пуповинной крови шагнули далеко вперед и многие врачи сошлись во мнении, что трансплантация стволовых клеток пуповинной крови может быть альтернативой пересадки костного мозга при онкогематологических и гематологических заболеваниях.
Итак, ГСК мультипотентны, могут дифференцироваться в клетки различных органов. При работе с ГСК можно использовать аутологичный материал, и как следствие нет риска отторжения при трансплантации реципиента. Они подвергаются криоконсервации, иными словами существует возможность хранения собственных клеток «про запас» с возможностью их использования через длительное время при сохранении всех свойств и возраста клеток на момент забора. Они не дают опухолей in vivo, при введении в организм не вызывают роста новообразований. На сегодняшний день их нельзя культивировать ex vivo, на настоящий момент не выработаны стабильно воспроизводимые методики увеличения количества гемопоэтических клеток в лабораторных условиях.
2. СТВОЛОВЫЕ КЛЕТКИ НЕРВНОЙ ТКАНИ
Стволовые клетки нервной ткани (НСК) расположены в специфических областях мозга человека и других млекопитающих.
Источником стволовых клеток нервной ткани является головной мозг как сформировавшегося, так и развивающегося организма. В результате проведенных экспериментов по трансплантации НСК клетки с донорской меткой были обнаружены в сердце, печени, центральной нервной системе, кишечнике и легких, что доказывает их мультипотентность.
Несмотря на то, что НСК являются мультипотентными и существует возможность их культивирования in vivo, их применение влечет за собой массу сложностей.Выделение стволовых клеток нервной ткани связано с полным разрушением головного мозга, что делает невозможным применение аутологичного материала, а, как следствие этого, появляются те же проблемы этического и иммунологического характера, что и при использовании фетальных клеток.
Для клеточной терапии НСК наиболее перспективны при использовании их ортодоксального дифференцировочного потенциала (нейроны и глия). К настоящему моменту разработаны коктейли химических индукторов коммитации НСК к дифференцировке в одном направлении (Bithell and Williams 2005). НСК локализованы в субэпендимном клеточном слое 3 и 4 желудочков головного мозга (Romanko et al., 2004). Таким образом, выделение НСК связано с разрушением головного мозга донора (Rietze et al., 2001). Но при этом возможно использование аллогенного материала для клеточной терапии ЦНС в связи с наличием гематоэнцефалического барьера и отсутствием иммунологических реакций на чужеродный материал, введенный в ЦНС реципиента. Эксперименты с применением фетального материала при терапии болезни Паркинсона к настоящему моменту уже проведены как на экспериментальных животных, так и в клинике (Burnstein et al., 2004).
3. СТВОЛОВЫЕ КЛЕТКИ КОЖИ
Стволовые клетки кожи выделяют из покровных тканей как эмбриона, так и взрослого организма. Клеточную терапию стволовыми клетками кожи связывают прежде всего с восстановлением кожных покровов, например, с восстановлением кожи после обширных ожогов. Сегодня подобные разработки уже применяют в клинике.
4.СТВОЛОВЫЕ КЛЕТКИ СКЕЛЕТНОЙ МУСКУЛАТУРЫ
Стволовые клетки скелетной мускулатуры выделяют из поперечнополосатой мускулатуры. Эти клетки способны к дифференцировке в клетки нервной, хрящевой, жировой и костной тканей, а также, естественно, в клетки поперечнополосатой мускулатуры. Однако последние исследования показывают, что клетки скелетной мускулатуры являются не чем иным, как отдельной популяцией мезенхимных стволовых клеток (см. ниже).
5.СТВОЛОВЫЕ КЛЕТКИ МИОКАРДА
В 90-х гг. ХХ века из миокарда новорожденных крыс были выделены клеточные элементы, способные к дифференцировке в кардиомиоциты и эндотелий сосудов. Трансплантация таких клеток в область инфаркта миокарда приводит к развитию в зоне повреждения новых кардиомиоцитов и сосудов, в результате чего восстанавливаются функции органа. Однако методика выделения данных клеточных элементов очень сложна и связана с полным разрушением мышечной ткани сердца.
6.МЕЗЕНХИМНЫЕ СТВОЛОВЫЕ КЛЕТКИ (МСК)
Традиционным источником МСК является строма костного мозга. В результате проведенных исследований мезенхимные стволовые клетки были обнаружены также в подкожной жировой ткани, которая в больших количествах остается после пластических операций.
В настоящее время ведется множество научно-исследовательских работ по выделению достаточного количества МСК из костной ткани и пуповинной крови.
Мезенхимные стволовые клетки человека рассматривают как один из основных элементов клеточной терапии. Действительно, МСК плюрипотентны и могут дифференцироваться в клетки костной, жировой, мышечной, хрящевой, нервной и прочих тканей. Неоспоримым достоинством работы с МСК служит то, что существует возможность применения аутологичного материала.
| Источники МСК | |||
| | | | |
| Костный мозг | Жировая ткань | Костная ткань | Пуповинная кровь |
3.4. Искусственные механические органы.
Искусственные механические органы — пожалуй, наиболее реалистичный на сегодня способ починить порядком износившееся тело, которому уже не поможет традиционный терапевтический «ремонт». Что касается других методов, то пересадка органов осложняется дефицитом доноров и биологической несовместимостью. А стволовые клетки, о которых так много говорят, к сожалению, пока слишком далеки от практического применения.
Первыми искусственными органами, видимо, стоит считать зубные протезы. Позднее хирурги стали вживлять металлические суставы и связки, а затем появились и электронные протезы конечностей. Но назвать эти аппараты «революцией в искуственных органах» можно лишь с натяжкой. Конечно, они улучшают качество жизни, но прожить можно и без них. Для создания таких аппаратов главное — подобрать прочный, легкий и безопасный материал, изготовить из него нужную деталь и разработать технологию «установки» в человеческое тело.
Другое дело — наши внутренние органы. Миллионы людей ежегодно умирают от тяжелых болезней сердца, легких, печени и почек, и помочь им зачастую нет никакой возможности. Почти все изобретенные аппараты для поддержания жизни — искусственное легкое, печень или почки — занимают места не меньше, чем холодильник и рассматриваются лишь как временная мера. Как правило, пациент находится около такой машины постоянно и ожидает органа для пересадки. Но подходящих доноров удается найти далеко не всегда.
Но не все так безнадежно. Самым «простым» из этих органов является сердце. Еще в 1938 году американские хирурги впервые использовали аппарат искусственного кровообращения. Не так давно было создано искусственное сердце AbioCor, которое позволяет человеку не просто «доживать», а ходить и даже заниматься спортом. А последняя разработка — австралийский прибор VentrAssist — вовсе должна работать 50 лет. Но об этом аппарате мы расскажем позднее, потому что его технические характеристики будут выглядеть слишком блекло без теоретического вступления.
Параметры искусственного тела
Идеальные искусственные органы — это машины, которые будут работать десятки лет под большими нагрузками и не требовать какого-либо технического обслуживания. Скажем, мощность сердца человека в покое составляет чуть больше 3 ватт. Это значит, что за день оно совершает работу почти в 90 килоджоулей. То есть «поднимает» тонну груза на четвертый этаж. При физической нагрузке, естественно, его производительность должна значительно возрастать. А теперь представьте, что такой аппарат еще должен умещаться в груди, иметь запас энергии, и не останавливаться ни на минуту в течение всей жизни.
Искусственные легкие — не менее сложная задача. Поверхность «оригинальных» дыхательных органов примерно равна теннисному корту. За одну минуту на ней двадцать раз равномерно «разливается» и убирается стакан крови. Кроме того, постоянно происходит самоочищение легких от сажи, пыли и других вредных частиц, которые мы вдыхаем. Если добавить, что такой орган по объему не должен превышать пяти литров, становится понятно, что работа над таким аппаратом еще очень далека от завершения.
Печень — тоже довольно маленький орган, в котором умещается «химический завод» и мощная система фильтрации. Только за одну минуту через нее проходит полтора литра крови, которую нужно очистить от продуктов жизнедеятельности, не нарушив при этом электролитный, гормональный и белковый баланс. Многие вещества, например — алкоголь, лекарства, жиры, не просто задерживаются в печени, но и перерабатываются в форму, наиболее удобную для выведения из организма. Кроме того, этот орган отвечает за синтез примерно литра желчи — эмульгатора пишевых жиров.
Еще один орган, без которого человек прожить не может — это почка. Аппарат, его замещающий должен, как и печень, фильтровать всю кровь организма. Но на этом функция почек не заканчивается: их биологический «компьютер» анализирует состав крови и на основании этих данных поддерживает в очень узких пределах содержание практически всех растворенных в ней веществ.
Беспроводное сердце
Теперь, когда мы оценили масштабы задачи, посмотрим, как она решается в отношении сердца. Аппарат AbioCor денверской компании Abiomed — это настоящее искусственное сердце, которое заменяет оба желудочка и обеспечивает поступление крови в легкие и остальные органы человека. В приборе размером с грепфрут и весом 900 граммов находятся титановый насос, блок управления и батарея. Ее емкости хватает на 30 минут автономной работы, а зарядка происходит через кожу: то есть на поверхность тела не выходит никаких проводов. Внешняя батарея, носимая на поясе, позволяет оставаться без подзарядки несколько часов.
Такой аппарат предназначен для пациентов с конечной стадией сердечной недостаточности и неблагоприятным прогнозом. Причем, создатели аппарата заявляют, что он позволяет больным не просто «доживать», но гарантирует им вполне приемлемое качество жизни.
Первое сердце AbioCor было пересажено в 2001 году. С тех пор было установлено не более 20 аппаратов, однако в компании смотрят на перспективы аппарата оптимистично и оценивают рынок в 100000 операций в год.
Насос на 50 лет
Аппарат VentrAssist, созданный австралийскими исследователями, в отличие от сердца AbioCor, не может полностью заменить природный орган. VentrAssist лишь помогает перекачивать кровь левому желудочку — самому нагруженному отделу сердца.
Внутрь тела помещается лишь титановый роторный насос. Его ресурс австралийцы оценивают как 50 лет непрерывной работы. Контроллер и батарею, емкости которой хватает на 8 часов, больной носит на поясе.
По замыслу разработчиков, такой прибор должен помочь многим людям с сердечной недостаточностью. Однако в медицинской практике он появится лишь после соответствующего разрешения лицензирующих органов.
Если жизнь дорога…
Сердце AbioCor сейчас стоит чуть меньше 100 тысяч долларов, VentrAssist обойдется примерно в 50. Однако эта цена значительно меньше затрат, связанных с каждой пересадкой донорского сердца.
Если учесть еще и те средства, которые уходят на медицинское обслуживание больных с сердечной недостаточностью, станет понятно: искусственное сердце не только полезно, но и выгодно для медицинской индустрии. А финансовые стимулы, как известно — самые сильные. В том числе и для технического прогресса.
Остается только уточнить, что поддерживать этот прогресс ценой собственной жизни совершенно необязательно. При своевременной профилактике сердечных заболеваний ваше собственное сердце может прослужить значительно дольше, чем 50 лет. И главное, практически бесплатно.
4. Глоссарий
Асимметричное деление - Такое митотическое деление, при котором дочерние клетки не равнозначны по дифференцировочному потенциалу. Считается, что одна дочерняя клетка сохраняет статус, а вторая - под влиянием факторов микроокружения дифференцируется.
Банк клеток - Учреждение, производящее гарантированное, по определенным правилам, хранение клеточных образцов, обеспечивающие их последующие применение.
Банкирование - Процесс длительного хранения криоконсервированных образцов стволовых клеток.
Биодеградация - Процесс разрушения химического соединения под воздействием биологического объекта. То же, что биологическое разрушение химических соединении.
Биосовместимость - Интегральная характеристика естественного или искусственного трансплантата, позволяющая ему приживаться в организме реципиента.
Бипотентный - Способный развиваться [дифференцироваться] только в двух направлениях.
Внутренняя клеточная масса (ВКМ) - У млекопитающих - скопление клеток, расположенное внутри бластоцеля у одного из полюсов. Клетки ВКМ в дальнейшем образуют сам зародыш, а также его провизорные органы - амнион, аллантоис, желточный мешок. ВКМ - основной источник эмбриональных стволовых клеток. Син.: эмбриобласт, зародышевый узелок.
Гемопоэтическая стволовая клетка (ГСК) - Мультипотентная стволовая клетка взрослого организма, способная к дифференцировке во все клетки крови. Син.: гематопоэтическая стволовая клетка, СКК - стволовая кроветворная клетка.
Графт - Тканеинженерный эквивалент любой ткани или органа.
Дедифференцировка [от лат. de-differentia - потеря различий] - Утрата клетками специфических свойств с возвращением их морфофункциональной организации к более примитивному состоянию.
Дифференцировка [от лат. differentia - различие] - Процесс, в ходе которого клетки стойко реализуют закрепленные детерминацией потенции к развитию до дефинитивного морфофункционального состояния. Дифференцировка клеток происходит как в развивающихся, так и в зрелых тканях и характеризуется экспрессией части генома. Основа дифференцировки - синтез цито- и тканеспецифичных белков.
Иммунофлюоресценция - Метод определения количества и/или распределения какого-либо антигена или антитела [иммунного комплекса], при котором антитела маркируются [прямо или косвенно] с помощью флюоресцентного красителя. В случае прямой иммунофлюоресценции [direct immunofluorescence] маркировка антитела производится непосредственно перед его воздействием на ткань. При косвенной иммунофлюоресценции [indirect immunofluorescence] маркировка антитела производится после его соединения с антигеном с помощью флюоресцентно-маркирующей анти-иммуноглобулиновой сыворотки.
Индуктор дифференцировки [от лат. inductio - наведение, побуждение] - Вещество, которое может стимулировать дифференцировку стволовых клеток и клеток-предшественников в определённом направлении.
Индуцированная дифференцировка - Дифференцировка клеток, происходящая в результате воздействия на них определённых факторов биологической или химической природы.
Кластер дифференцировки [cluster differentiation, cluster designation, CD] - Внесенная в специальную номенклатуру группа моноклональных антител, которые имеют совпадающую специфичность и связывают определенную маркерную молекулу. Допустимо применение термина CD по отношению к маркерной молекуле. В настоящий момент насчитывается более 300 CD, внесенных в номенклатуру.
Клетка-предшественник - Клетка, находящаяся на низком уровне дифференцировки, но уже коммитированная к развитию в клетки определённой линии.
Клетки «боковой популяции», SP-клетки, Side- population (SP) - Популяция клеток, которые обладают способностью выкачивать некоторые флуоресцентные красители [Hoechst и др.] и изначально представляющие собой гемопоэтические клетки.
Клеточная трансплантация - Трансплантация [трансфузия] различных типов клеток с целью восстановления повреждённых тканей и органов, либо замещения патологически изменённых собственных клеток реципиента.
Клеточный рост - Процесс деления клеток в организме либо в культуре, не сопровождающийся повышением их уровня дифференцировки.
Клон - Потомство клеток, возникшее от одного общего предшественника.
Клонирование - Искусственное создание генетически идентичных исходным ДНК, клеток, организмов.
Колониеобразующие единицы (КОЕ) - Клетки, способные пролиферировать с образованием колоний в культуре или в органах другого организма.
Костные морфогенетические белки; Bone morphogenetic proteins (BMPs) - Белки, входящие в состав суперсемейства трансформирующих факторов роста. Экспрессируясь в областях организаторов зародыша, они, наряду с другими белками суперсемейства, выполняют разнообразные функции: контролируют клеточную репродукцию, программируемую гибель клеток, миграцию клеток, установление осей зародыша, спецификацию мезодермы, дифференциацию нервной системы и органов чувств, морфогенез кишки. У взрослых особей экспрессируются в основном клетками скелетных тканей и являются молекулярными регуляторами остеогенеза.
Криоконсервирование- Метод длительного сохранения клеток, тканей и органов путём их глубокой заморозки в жидком азоте с применением специальных добавок, сохраняющих жизнеспособность клеток или тканей.
Линейные поверхностные антигены, Lineage surface antigen (Lin) - Поверхностные антигены, характеризующие определенную [данную] клеточную линию.
Маркер - Поверхностная или внутриклеточная молекула, характерная для определенной линии клеток на данном этапе дифференцировки в норме либо при патологии.
Миграция - Процесс перемещения любых клеток, обусловленный сложными избирательными взаимодействиями клеточных рецепторов на мембранах мигрирующих клеток и их микроокружения. In vivo данный процесс проявляется перемещением клеток в другие органы.
Мехенхима - Зародышевая соединительная ткань большинства многоклеточных животных, в том числе человека. Из мезенхимы образуются собственно соединительная ткань, кровеносные сосуды, многие мышцы, висцеральный скелет, пигментные клетки и нижний слой соединительнотканной части кожи.
Микроокружение - 1. Сложная система, включающая клетки и внеклеточный матрикс, обеспечивающая выживание, рост и дифференцировку стволовых клеток посредством специфических биологически активных молекул - сигнальных факторов и межклеточных взаимодействий. 2. Клеточный состав и тип межклеточного вещества, характерный для данной ткани.
Мононуклеарная фракция клеток [от лат. monos - один и nucleus - ядро] - Клетки, выделенные из костного мозга или периферической крови посредством отделения от эритроцитов, тромбоцитов и гранулоцитов на градиенте плотности.
Мультипотентная клетка - Клетка, способная дифференцироваться в нескольких направлениях в пределах тканевых производных одного зародышевого листка.
Мультипотентные мезенхимальные стромальные клетки (ММСК) - Гетерогенная популяция клеток стромы костного мозга и некоторых иных источников, способная к дифференцировке в клетки, имеющие мезенхимальное происхождение: адипоциты, остеоциты, хондроциты, а также в особых условиях in vitro - в клетки эктодермального и энтодермального фенотипа.
Недифференцированный (недифференцированная клетка) - Клетка, не обладающая характеристиками клеток той или иной тканевой принадлежности и способная претерпевать процесс дифференцировки.
Нейральные стволовые клетки (НСК) - Региональные стволовые клетки, обладающие потенциалом дифференцировки в нейральные и глиальные элементы.
Опухолевая стволовая клетка (Cancer stem cell) - Самоподдерживающаяся клетка, являющаяся источником развития злокачественной клеточной популяции. Считается доказанным наличие таких клеток при лейкозах и некоторых солидных опухолях.
Пассаж - Пересев клеточной культуры.
Перенос ядра соматической клетки - Правильное название так называемого «терапевтического клонирования», отражающее процедуру репрограммирования ядра с целью получения линий эмбриональных стволовых клеток с геномом исходной соматической клетки, позволяющую получать иммунологически совместимый клеточный материал.
Персистенция [от англ. persistence - постоянство, живучесть, выносливость] - Применительно к стволовым клеткам - феномен присутствия и сохранения функционально активных донорских стволовых клеток в организме реципиента.
Пластик-адгезивные клетки - Клетки, способные посредством своих рецепторов прикрепляться к культуральному пластику или стеклу.
Пластичность - Гипотетическая способность стволовых клеток взрослого дифференцироваться в клетки нескольких направлений дифференцировки - производных различных зародышевых листков под воздействием различных стимулов.
Плюрипотентная клетка [от лат. pluro - много; potentia - способность] – способная дифференцироваться по множеству различных направлений в пределах всех зародышевых листков, а также клетки внезародышевых органов.
Приживление - Явление интеграции трансплантата в организм реципиента, не сопровождающееся реакцией отторжения.
Примитивность - Отсутствие у клетки специфических свойств и функций; её потенциальная способность претерпевать процесс дифференцировки с образованием высокоспециализированного потомства.
Пролиферация - [лат. proliferatio, от proles - потомство и ferre - носить, приносить] - Процесс клеточного деления, осуществляющегося путем митоза.
Регенеративная медицина - Область медицины, занимающаяся вопросами восстановления повреждённых или патологически измененных тканей и органов посредством трансплантации стволовых клеток, клеток-предшественников и управления их дифференцировкой.
Регионарные стволовые клетки (РСК) - Стволовые клетки, имеющиеся в дефинитивных тканях и обладающие дифференцировочными потенциями в пределах данной ткани.
Репрограммирование ядра соматической клетки - Изменение генетической программы ядра при его переносе в гетерологическую цитоплазму. Репрограммирование ядра клетки может происходить при её трансдифференцировке без переноса ядер.
Репродуктивное клонирование - Клонирование с целью создания нового организма, генетически идентичного исходному.
Самообновление стволовой клетки - Свойство стволовых клеток, заключающееся в поддержании собственной популяции за счет симметричных или асимметричных делений.
Скаффолд-технология [от англ. scaffold - леса, подмостки] - Культивирование клеток на трёхмерных подложках - носителях естественного или искусственного происхождения с целью пространственного формирования будущего клеточного трансплантата.
Слияние - Объединение цитоплазматического и генетического материала гетерологичных клеток [например донора и реципиента], в результате чего донорские СК приобретают характеристики клеток реципиента. Син.: фьюжн, фузоморфогенез [от англ. fusion - слияние и лат. morphogenesis - придание формы].
Со(ко)культивирование - Совместное культивирование двух или нескольких клеточных линии.
Спонтанная дифференцировка - Самопроизвольная, происходящая в отсутствии воздействия внешних факторов дифференцировка стволовых клеток.
Стволовая клетка - любая недифференцированная или малодифференцированная клетка, которая способна поддерживать собственную популяцию и продуцировать по крайней мере 1 тип коммитированных клеток-предшественников.
Стволовые клетки пуповинной крови - Стволовые клетки, выделенные из сосудов пупочного канатика после рождения ребёнка.
Стволовые клетки взрослых, стволовые клетки дефинитивных тканей; adult stem cells - Стволовые клетки, находящиеся в тканях взрослого организма.
Стволовые клетки костного мозга - Собирательное понятие, под которым понимают как минимум две различные популяции стволовых клеток, находящиеся в костном мозге: стволовые кроветворные клетки [СКК] или гемопоэтические стволовые клетки [ГСК] и мультипотентные мезенхимальные стромальные клетки [ММСК] - общие предшественники мезенхимальных производных.
Стромальные клетки - Совокупность клеток преимущественно соединительнотканной природы [ММСК, ретикулярных клеток, адипоцитов, фибробластов и др.] формирующих каркас [основу] кроветворных органов. Исключение - тимус, в котором стромальные клетки имеют эпителиальное происхождение. Также этим термином могут обозначаться собственно соединительнотканные клетки всех остальных паренхиматозных и трубчатых органов, главным образом формирующие их механический каркас.
Терапевтическое клонирование - Некорректное название процедуры переноса ядра соматической клетки с целью получения индивидуальной линии ЭСК.
Тканевая инженерия - Междисциплинарная область знаний, включающая в себя биологию, медицину и технические науки, изучающая создание in vitro эквивалентов тканей и органов, использующая принцип трансплантации клеточной культуры на биосовместимом носителе.
Тканевая ниша стволовой клетки - Отдельная область костного мозга или любой ткани, состоящая из стромальных клеток, обеспечивающая молекулярные сигналы, селективно опосредующие самообновление популяции и дифференцировку СК путём взаимодействий клетка-клетка и близкодействующих [паракринных] молекулярных взаимодействий.
Тотипотентный [от лат. totalis - общий, целый и potentia - способность] - Клетка, способная дифференцироваться не только во все клеточные линии, характерные для данного вида, но и, размножаясь, формировать целостный организм.
Трансдифференцировка [от лат. trans - через и differentia - различие] - Способность стволовой клетки взрослого дифференцироваться в клетки другого зародышевого листка. Син.: пластичность.
Трансплантат [от лат. transplanto - пересаживать] - Совокупность клеток, фрагмент ткани или орган, используемый для пересадки.
Унипотентный [от лат. unos - один и potentia - способность] - Способный дифференцироваться только в одном направлении [в клетки одной линии]. Например: стволовые сперматогенные клетки.
Фетальные стволовые клетки [от лат. fetus - плод] - Стволовые клетки плода, источником которых служит абортивный материал на 9-12 неделях беременности.
Фидер [от англ. feed - кормить] - Слои поддерживающих клеток, необходимых для выживания и функционирования в культуре некоторых типов клеток. Фидер осуществляет метаболические, сигнальные и иммунопротекторные функции.
Хоуминг [от англ. homing - возвращение домой] - Способность клеток мигрировать или «возвращаться» в ткани, из которых они были получены, и интеграция клеток в эти ткани посредством специфических рецепторов хоуминга. Процесс хоуминга включает в себя три этапа: миграцию клеток по кровеносному руслу, их трансмиграцию в ткани через стенки капилляров, и т. н. lodging - удержание клеток в ткани посредством специфических рецепторов.
Эмбриоидные тельца - Структуры, формируемые ЭСК в суспензионнои культуре и имитирующие предимплантационную стадию развития в условиях in vitro.
Энграфтмент - Условное понятие, характеризующее долю трансплантированных клеток, которые избегают гибели в раннем посттрансплантационном периоде, мигрируют в тканевые ниши и осуществляют свойственные им функции.
Ядросодержащие клетки костного мозга - Клетки костного мозга, содержащие цельные, сегментированные или полиморфные ядра.
5.Тестовые задания по разделу «Генетика развития», тема: Стволовые клетки
1. РЕГИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ ПО СПОСОБУ ДИФФЕРЕНЦИАЦИИ МОГУТ БЫТЬ
1) тотипотентными
2) плюрипотентныеми
3) фетальными
4) унипотентными
2. РЕГИОНАЛЬНЫЕ КЛЕТКИ ПОЛУЧАЮТ ИЗ
1) внутриклеточной массы раннего эмбриона
2) клеток зародыша на 9 – 12 развития, выделенных из абортивного материала.
3) стволовых клеток взрослого организма
4) эмбриобласта на 5-7 сутки развития человеческого зародыша
3. МЕЗЕНХИМНЫЕ, ГЕМОПОЭТИЧЕСКИЕ И СТРОМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ ОТНОСЯТ К МУЛЬТИПОТЕНТНЫМ, ТАК КАК ОНИ
1) имеют мезенхимное происхождение
2) способны к дифференцировке в различные типы мезенхимальных тканей, а также в клетки других зародышевых слоев
3) клетки взрослого организма
4) фетальные клетки
4. ДЕЛЕНИЕ СТВОЛОВОЙ КЛЕТКИ
1) митотического типа
2) мейотического типа
3) прямое
4) ассиметричное
5. В РЕЗУЛЬТАТЕ ДЕЛЕНИЯ СТВОЛОВОЙ КЛЕТКИ ОБРАЗУЮТСЯ
1) две клетки с диплоидным набором хромосом
2) четыре клетки с гаплоидным набором хромосом
3) материнская и дочерняя клетки
4) две клетки с гаплоидным набором хромосом
6. ТКАНЕСПЕЦИФИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ ПО ТИПУ ДИФФЕРЕНЦИАЦИИ ОТНОСЯТСЯ К
1) унипотентным
2) тотипотентным
3) мультипотентным
4) плюрипотентным
7. МАТЕРИНСКАЯ СТВОЛОВАЯ КЛЕТКА ПОСЛЕ ДЕЛЕНИЯ
1) дифференцируется
2) используется для самоподдержания популяции, сохраняет плюрипотентность
3) производит региональные структуры
4) становится унипотентной
8. ДОЧЕРНЯЯ КЛЕТКА ПОСЛЕ ДЕЛЕНИЯ
1) мультипотентна
2) используется для самоподдержания популяции, сохраняет плюрипотентность
3) производит региональные структуры
4) становится унипотентной
9. СТВОЛОВАЯ НИША ЭТО
1) экологические условия, обеспечивающие жизнедеятельность клетки
2) микроокружение стволовой клетки
3) ингибиторы
4) интегрины
10. ФАКТОРЫ, СОСТАВЛЯЮЩИЕ НИШУ СТВОЛОВОЙ КЛЕТКИ
1) базальная мембрана, молекулы внеклеточного матрикса и соседние клетки, регуляторные молекулы
2) базальная мембрана, молекулы внеклеточного матрикса
3) соседние клетки, регуляторные молекулы
4) молекулы внеклеточного матрикса и соседние клетки, регуляторные молекулы
11. НИША АКТИВНО УЧАСТВУЕТ
1) в регуляции пролиферации и дифференциации стволовых клеток
2) в регуляции пролиферации и дифференциации стволовых клеток, обеспечивает самоподдержание стволовых клеток и длительное их пребывание в состоянии покоя
3) в обеспечении самоподдержания стволовых клеток и длительного их пребывания в состоянии покоя
4) в длительном пребывании клеток в состоянии покоя
12. ОДНО ИЗ НАЗНАЧЕНИЙ НИШИ В ТКАНЯХ ВЗРОСЛОГО ОРГАНИЗМА
1) стимулирование к дифференцировке
2) стимулирование к трансдифференцировке
3) необходимость поддерживать тканевой гомеостаз для ограничения пролиферации стволовых клеток
4) стимулирование пролиферации
13.ВЛИЯНИЕ НИШИ НА СК
1) абсолютно
2) относительно
3) не абсолютно
4) прямое
14. СТВОЛОВЫЕ КЛЕТКИ ОКАЗЫВАЮТ ВЛИЯНИЕ НА НИШУ
1) нет
2) относительно
3) не продуцируют внеклеточные регуляторные молекулы
4) продуцируют значительное число внеклеточных регуляторных молекул
15. ОСНОВНЫМ КОМПОНЕНТОМ НИШИ СТВОЛОВЫХ КЛЕТОК КОСТИ ЯВЛЯЮТСЯ
1) остеоциты
2)ранние остеобласты
3) ранние фибробласты
4) остокласты
16. ИММОРТАЛЬНОСТЬ ЭТО СВОЙСТВО
1) ткенеспецифических стволовых клеток
2) региональных стволовых клеток
3) истинных эмбриональных стволовых клеток
4) эмбриональных герминальных клеток
17. НАИМЕНЬШЕЕ ЧИСЛО ДЕЛЕНИЙ СРЕДИ СТВОЛОВЫХ КЛЕТОК ХАРАКТЕРНО ДЛЯ
1) ткенеспецифических стволовых клеток
2) региональных стволовых клеток
3) истинных эмбриональных стволовых клеток
4) эмбриональных герминальных клеток
18. РЕГИОНАЛЬНЫЕ КЛЕТКИ, СПОСОБНЫЕ БЫТЬ ПЛЮРИПОТЕНТНЫМИ
1) стволовые клетки кожи
2) стволовые клетки нервной системы
3) гемопоэтические стволовые клетки
4) стволовые клетки миокарда
19. КЛЕТКИ, ОБЛАДАЮЩИЕ НАИБОЛЬШЕЙ ПОТЕНТНОСТЬЮ СРЕДИ РЕГИОНАЛЬНЫХ
1) стволовые клетки кожи
2) стволовые клетки нервной системы
3) гемопоэтические стволовые клетки
4) мезенхимные стволовые клетки
20.ЛЕГКО ВЫРАЩИВАЮТСЯ В КУЛЬТУРЕ
1) тканеспецифические стволовые клетки
2) региональные стволовые клетки
3) истинные эмбриональные стволовые клетки
4) эмбриональных герминальных клеток
21. ИЗОЛЯЦИЯ ТАКИХ КЛЕТОК ИЗ ТКАНЕЙ ДОВОЛЬНО ЗАТРУДНИТЕЛЬНА
1) прогениторных клеток
2) региональных стволовых клеток
3) истинных эмбриональных стволовых клеток
4) эмбриональных герминальных клеток
22. МЕТОДЫ ДЛЯ УВЕЛИЧЕНИЯ ЭТИХ КЛЕТОК В КУЛЬТУРЕ ПОКА НЕ РАЗРАБОТАНЫ
1) эмбриональных герминальных клеток
2) истинных эмбриональных стволовых клеток
3) региональных стволовых клеток
4) прогениторных клеток
23. МЕЖКЛЕТОЧНОЕ СОЕДИНЕНИЕ ЭПИТЕЛИОЦИТОВ КИШЕЧНИКА, ПРИ КОТОРОМ СЛОИ ДВУХ ПЛАЗМОЛЕММ СБЛИЖЕНЫ ДО СЛИЯНИЯ ИХ УЧАСТКОВ, НАЗЫВАЕТСЯ
1) плотным замыкающим
2) простым
3) щелевидным
4) десмосомой
5) полудесмосомой
24.В СОСТАВ КЛЕТОЧНОЙ МЕМБРАНЫ ИЗ НАЗВАННЫХ СОЕДИНЕНИЙ МОГУТ ВХОДИТЬ ВСЕ, КРОМЕ
1) фосфолипидов
2) холестерина
3) гликозоаминогликанов
4) белков-ферментов
5) белков-переносчиков
25.ПИЩЕВАРИТЕЛЬНОЙ ВАКУОЛЬЮ В ЖИВОТНОЙ КЛЕТКЕ НАЗЫВАЮТ
1) пиноцитозный пузырек
2) лизосому
3) фагосому
4) слившиеся фагосому с лизосомой
5) остаточное тельце
26.МЕЖКЛЕТОЧНЫЙ КОНТАКТ В ВИДЕ ПЛОЩАДКИ, ГДЕ СО СТОРОНЫ ЦИТОПЛАЗМЫ ИМЕЮТСЯ ДВЕ УТОЛЩЕННЫЕ ЗОНЫ – ПЛАСТИНКИ ПРИКРЕПЛЕНИЯ, С ОТХОДЯЩИМИ ОТ НИХ ЦИТОКЕРАТИНОВЫМИ ФИЛАМЕНТАМИ, НАЗЫВАЕТСЯ
1) простое соединение
2) плотное соединение
3) десмосома
4) нексус
5) синапс
27.МЕЖКЛЕТОЧНЫЙ КОНТАКТ, ПРИ КОТОРОМ В ПЛАЗМОЛЕММАХ ИМЕЮТСЯ ИОННЫЕ КАНАЛЬЦЫ, НАЗЫВАЕТСЯ
1) простое соединение
2) плотное соединение
3) десмосома
4) щелевидное соединение
5) синапс
28.ОБЩИМ ДЛЯ ВСЕХ КЛЕТОЧНЫХ МЕМБРАН ЯВЛЯЕТСЯ
1) липопротеидное строение
2) состав липидов
3) состав белков
4) одинаковый поверхностный электрический заряд
5) состав гликокаликса
29. В СОСТАВ ГЛИКОКАЛИКСА ВХОДЯТ
1) гликопротеиды
2) холестерин
3) гликолипиды
4) гликозоаминогликаны
30. БЕЛКОВЫЕ МОЛЕКУЛЫ В МЕМБРАНАХ МОГУТ
1) перемещаться в пределах липидного слоя
2) вращаться
3) изменять плоскость вращения
4) не способны к перемещению
6. Список использованной литературы:
1. Мушкамбаров Н.Н., Кузнецов С.Н. «Молекулярная биология». Учебное пособие для студентов медицинских вузов, Москва: Наука, 2003, 544с.
2. Фаллер Д.М., Шилдс Д. «Молекулярная биология клетки». Руководство для врачей. Пер. с англ. М.: БИНОМ – Пресс, 2003.-272с.
3. Гинтер Е.К. Медицинская генетика. М., Медицина,2003.
4. Генетика. Учебник для ВУЗов / Под ред. Академика РАМН В.И. Иванова. – М.: ИКЦ «Академкнига»,2006.-638 с.:ил.
Дополнительная:
1. Уилсон Дж., Хант Т. Молекулярная биология клетки. Сборник задач. Пер. с англ. –М.,Мир, 1994 -520 с.
2. Казымет П.К., Мироедова Э.П. Биология. Учебное пособие для студентов медицинских вузов. – Астана,2006,2007.
3. Медицинская биология и генетика/ Под.редакцией Куандыкова Е.У., Алматы,2004
35
© 2018, Акимбаев Айдын Канатбекович 769 20
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы
Полезное для учителя