Задания . Электролиты и неэлектролиты. Катионы и анионы
ТЕОРИЯ
1.Вещества с водой ведут себя по разному. ( см схему )
2.Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят, и по этому свойству вещества делят на
1) электролиты - вещества, расплавы или растворы которых проводят электрический ток, Т.К при растворении и расплавлении . на ионы распадаются.
Типичными электролитами являются кислоты, основания, соли.
!!!! см. Все электролиты в таблице растворимости.
2) неэлектролиты - вещества, расплавы или растворы которых не проводят электрический ток, Т.К при растворении и расплавлении, на ионы не распадаются. ( см схему ).
--------------------------------------------------------------------------------------------------------------
СХЕМА
вещество + Н2О
1. нерастворяются 2.растворяются 3. Идет химическая реакция
( SiO2, CuO, CaCO3, …) (сахар, NaCl, HCl, ..) (Na, P2O5, CaO, .. )
 2. Р А С Т В О Р Ы , расплавы В Е Щ Е С Т В
2. Р А С Т В О Р Ы , расплавы В Е Щ Е С Т В
Электролитов неэлектролитов
соли, основания, кислоты. Сахар, спирт, глюкозы….

 проводят электрический ток не проводят
проводят электрический ток не проводят
(наличие ионов) (отсутствие ионов)
3.Электролитическая диссоциация – распад при растворении в воде (или в расплаве) Э Л Е К Т Р О Л И Т А на И О Н Ы .
В растворе под действием молекул воды молекулы вещества распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. То же самое происходит в расплаве при высоких температурах.
| Правило | Пример |
| 1.Кислоты диссоциируют на ион водорода и ион кислотного остатка | HCl = H+ + Cl—. |
| 2.Основания диссоциируют на ион металла и гидроксид ион | NaOH = Na+ + OH–
|
| 3.Соли диссоциируют на ион металла и ион кислотного остатка | NaCl = Na+ + Cl– Na3PO4 = 3Na+ +PO43- |
| Соль аммония диссоциирует на ион аммония и ион кислотного остатка | NH4 NO3 = N H4 + + NO3 – |
4. Электролиты в зависимости от степени диссоциации делятся на две группы:
слабые – плохо распадаются на ионы;
сильные – хорошо растворимы, легко распадаются на ионы.
Степень электролитической диссоциации – отношение количества распавшихся на ионы молекул к общему количеству молекул вещества
1!!!! СМОТРЕТЬ ТАБЛИЦУ РАСТВОРИМОСТИ.
| Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%).
| Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%).
|
| выучить |
| К сильным электролитам относятся: 1) все растворимые соли; Р 2) сильные кислоты, например: H2SO4, HCl, HNO3; Р 3) основания Р, щелочи, например: NaOH, KOH. Ca(OH)2
| Средней силы электролиты. HF, H2SO3. H3PO4
| К слабым электролитам относятся: 1) слабые кислоты — H2S, H2CO3, HNO2; 2) водный раствор аммиака NH3 • H2O (NH4OH гидроксид аммония) 3) вода; 4) нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др. );
|
5.Ионы – это заряженные частицы (атомы или группы атомов).
Разделяют положительно заряженные ионы (катионы) и
отрицательно заряженные ионы (анионы).
К катионам относятся: ион водорода Н+, ион аммония NH4+, ионы металлов Na+, K+ , Fe2+, Al3+, катионы основных солей CuOH+, Аl(ОН)2+, FeOH2+ и т. д.
К анионам относятся: гидроксид-ион ОН—, ионы кислотных остатков Сl—, NO3—, SO42-, Cr2O72-, анионы кислых солей НСО3—, Н2РО4—, HPO42- и т. д.
!!!! Самые распространенные ионы можно найти в таблице растворимости
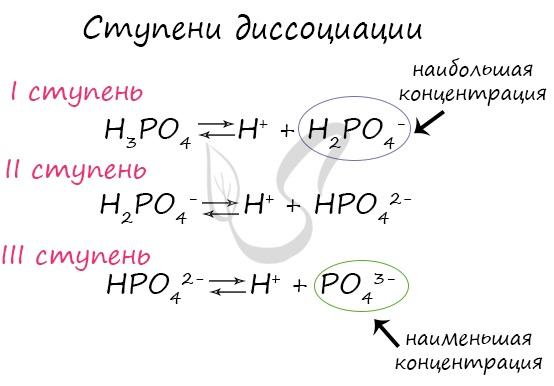
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH–
Mg(OH)+ ⇄ Mg2+ + OH–
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K+ + HCO3– (α=1)
HCO3– ⇄ H+ + CO32– (α
Mg(OH)Cl ⇄ MgOH+ + Cl– (α=1)
MgOH+ ⇄ Mg2+ + OH– (α
--------------------------------------------------------------------------------------------------------
Примеры заданий (!!!! см. Все электролиты в таблице растворимости.
это ваша официальная шпаргалка экзамене.
!!1 ХОД РЕШЕНИЯ по формуле вещества
находим в таблице растворимости это вещество
а) если оно там есть ---это электролит
б) если Р , это сильный электролит но есть искл. См слабые
в) см. какие ионы будет давать при диссоциации
2. подсчет ионов сколько (в моль): катионов, анионов, сумма всех ионов

Na3PO4 = 3Na+ + PO43-
1 моль 3 моль 1 моль
Катионы анионы
4 моль ионов
одновременное нахождения + и - ионов в растворе
а)возможность одновременного нахождения
если + ион и – ион при соединении дают вещество Р, растворимое в воде.
Б) невозможность одновременного нахождения
если + ион и – ион при соединении дают вещество СЛАБЫЙ ЭЛЕКТРОЛИТ (Н, НЕрастворимое в воде. Или газ ,,..)
-------------------------------------------------------------------------------------------------------
| ЗАДАНИЕ | ПРИМЕР | РЕШЕНИЕ |
| 1. найти элекролиты | К сильным электролитам не относятся 1) 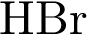 2) 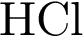 3) 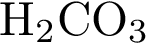 4) 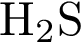 5) 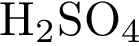
| Следует помнить какие кислоты относятся к сильным, а какие — к слабым. Из представленных кислот сероводород и угольная кислота относятся к слабым. Ответ: 34.
|
Найти вещество , дающее, при диссоциации определенный ион | Хлорид-ионы образуются при электролитической диссоциации 1) 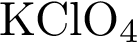 2) 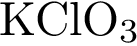 3) 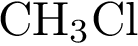 4) 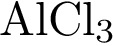 5) 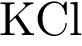
| Среди представленных веществ метилхлорид вообще не диссоциирует на ионы, а хлориды калия и алюминия при диссоциации образуют хлорид-анионы. Ответ: 45.
|
Подсчет ионов при диссоциации в моль. (общее , катионов, анионов) | Одинаковое число положительных и отрицательных ионов образуется при электролитической диссоциации 1) хлорида калия 2) хлорида бария 3) карбоната натрия 4) сульфата железа(II) 5) сульфата алюминия
| В молекулах хлорида калия и сульфата железа(II) один катион и один анион, поэтому при электролитической диссоциации образуется одинаковое число положительных и отрицательных ионов. Ответ: 14.
|
| При диссоциации 1 моль вещества образовалось 4 моль ионов. Формулы веществ: 1) 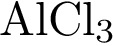 2) 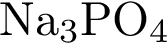 3) 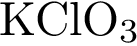 4)  5) 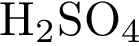
| В молекуле хлорида алюминия на три аниона приходится один катион (в сумме 4 иона), а в молекуле фосфата натрия на три катиона приходится один анион (в сумме 4 иона). Ответ: 12.
|
| 4.возможность одновременного нахождения ионов в растворе | Какие ионы могут одновременно находится в растворе 1) ион натрия и ион хлора 2) ион водоррда и карбонат ион 3) ион кальция и карбонат ион 4) ион водорода и нитрат ион | Нужно смотреть в таблицу растворимости, нужно, чтобы при соединении ионов + и -, образовывалось вещество СИЛЬНЫЙ ЭЛЕКТРОЛИТ (Р)
Ответ: 1,4
|






 2. Р А С Т В О Р Ы , расплавы В Е Щ Е С Т В
2. Р А С Т В О Р Ы , расплавы В Е Щ Е С Т В 
 проводят электрический ток не проводят
проводят электрический ток не проводят 


















