
«Электроотрицательность химических элементов»

Электроотрицательность (ЭО) – свойство атома данного элемента оттягивать на себя электроны от атомов других элементов в соединениях.

1 закономерность – чем меньше радиус атома, тем ярче проявляются
неметаллические свойства и наоборот.
2 закономерность – чем больше радиус атома,
тем легче он отдает электроны.
3 закономерность – чем меньше радиус атома, тем выше электроотрицательность.
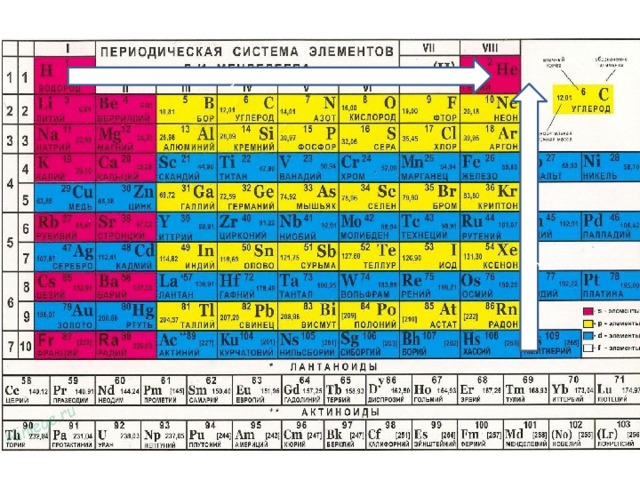
ЭО увеличивается
ЭО увеличивается

Н аиболее электроотрицательные химическ ие элемент ы в соединении :
Са СL 2 ,
К 2 O ,
N 2 ,
H 2 S,
Al 2 O 3 .


Химическая связь

Что было, если бы атомы не соединялись друг с другом?
Ничего
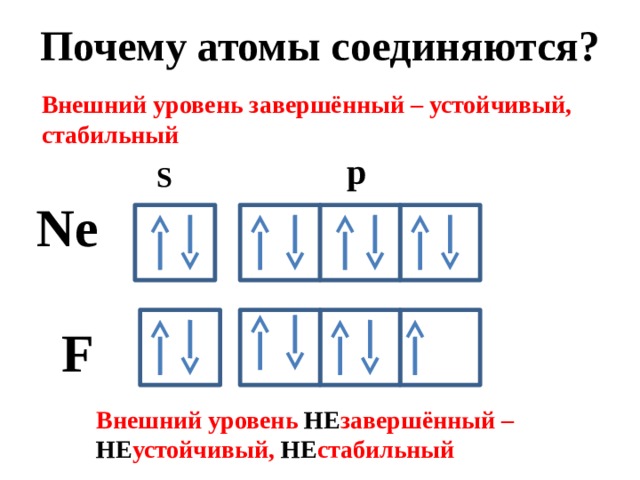
Почему атомы соединяются?
Как атомы соединяются?
Почему атомы соединяются?
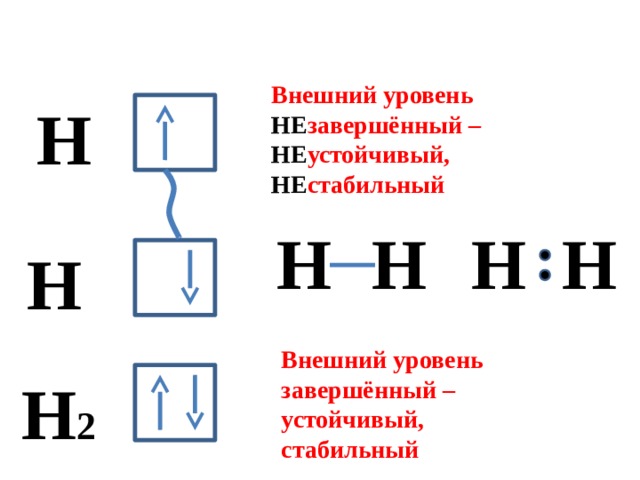
Внешний уровень завершённый – устойчивый, стабильный
p
S
Ne
F
Внешний уровень НЕ завершённый – НЕ устойчивый, НЕ стабильный

Соединяясь, атомы образуют завершённый внешний уровень – устойчивый, стабильный
Слайд 2
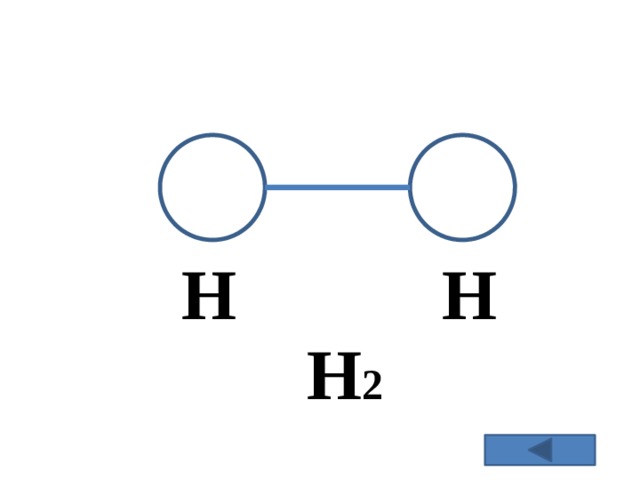
Н
Н
Н 2
Н
Н
Внешний уровень НЕ завершённый – НЕ устойчивый, НЕ стабильный
Н
Н
Н
Н
Н
Н
Внешний уровень завершённый – устойчивый, стабильный
Н 2
p
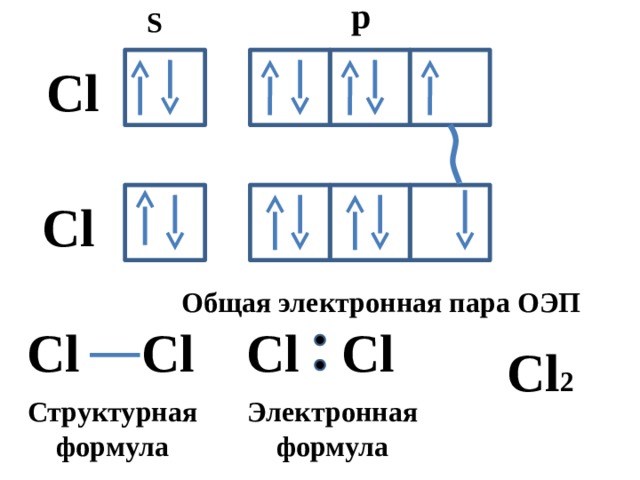
S
Cl
Cl
Общая электронная пара ОЭП
Cl
Cl
Cl
Cl
Cl 2
Структурная формула
Электроннаяформула
p
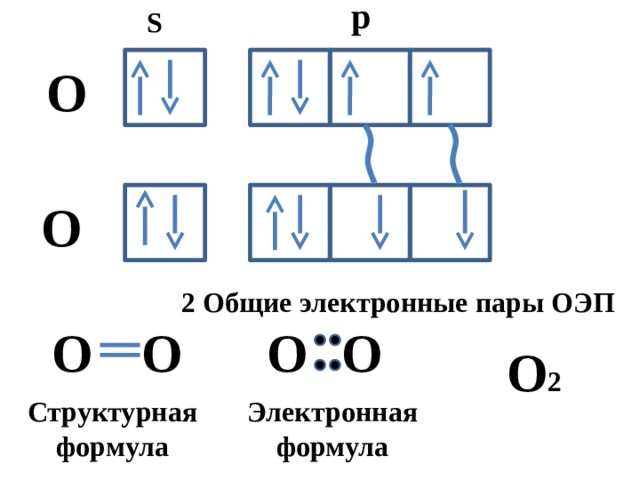
S
О
О
2 Общие электронные пары ОЭП
О
О
О
О
О 2
Структурная формула
Электроннаяформула
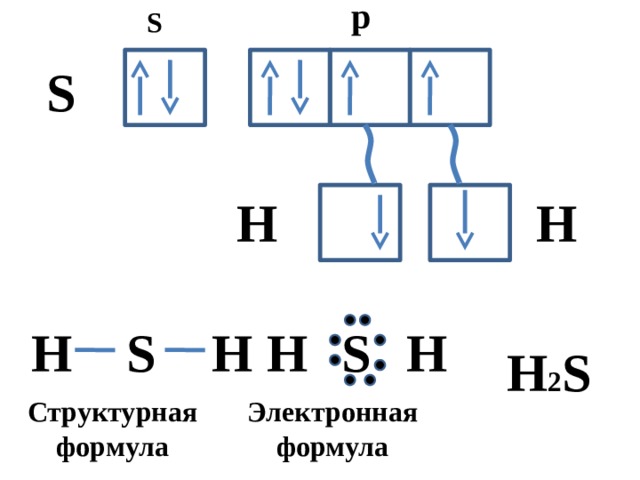
p
S
S
H
H
H
H
H
S
H
S
H 2 S
Электроннаяформула
Структурная формула
Ковалентная
Ионная
Типы химической связи
Металли-
ческая
Водородная
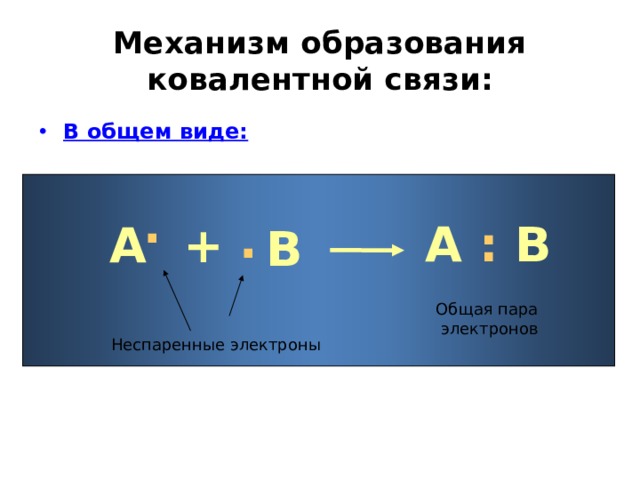
Механизм образования ковалентной связи:
.
.
А : В
А
+
В
Общая пара
электронов
Неспаренные электроны

Виды ковалентной связи
Неполярная
Полярная
- Образуется между атомами с одинаковой электроотрицательностью
- Образуется между атомами, которые незначительно отличаются по электроотрицательности
- Например: H 2 О НCl NН 3
- Общая электронная пара, образующая связь, смещается к атому более электроотрицательного элемента
- Например: H 2 Cl 2 O 2 N 2
- Общая электронная пара, образующая связь в равной степени принадлежит обоим атомам

Ковалентная связь
НеМе
H 2 S
Н 2
Cl 2
О 2
Полярная ковалентная связь
Неполярная ковалентная связь
ЭО
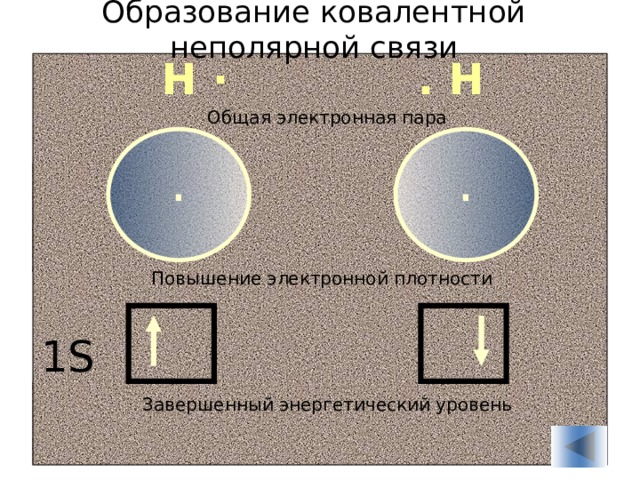
Образование ковалентной неполярной связи
. Н
Н ·
Общая электронная пара
.
.
Повышение электронной плотности
1S
Завершенный энергетический уровень
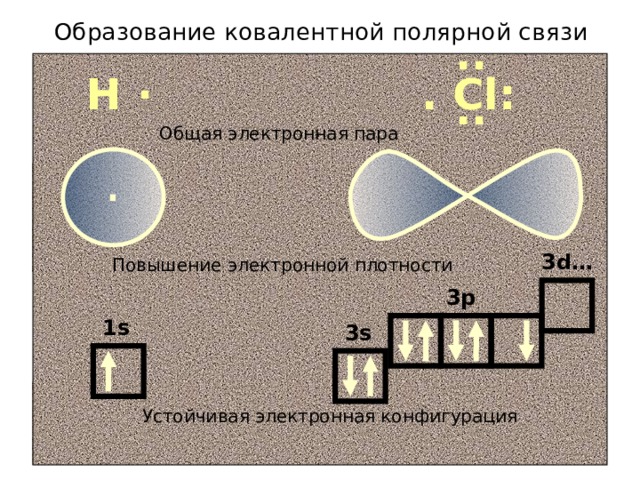
Образование ковалентной полярной связи
..
Н ·
. Сl:
..
Общая электронная пара
.
3d…
Повышение электронной плотности
3p
1s
3s
Устойчивая электронная конфигурация
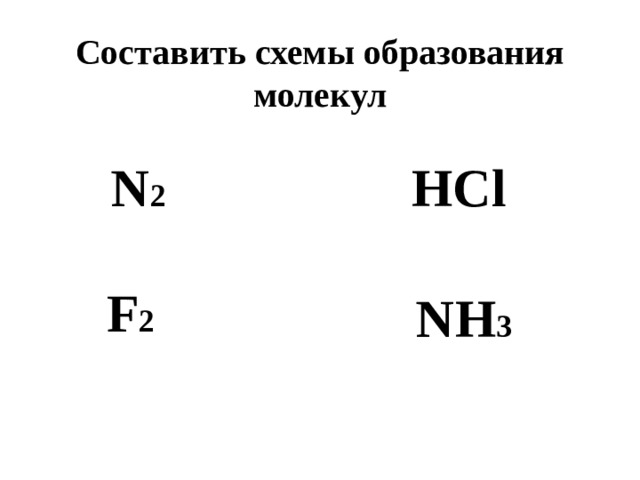
Составить схемы образования молекул
N 2
HCl
F 2
NH 3

Ионная связь
- Образуется между атомами типичных металлов и типичных неметаллов, т.е. между элементами, атомы которых резко отличаются по электроотрицательности
- Например: NaCl BaO K 3 N
- Связь образуется за счет электростатического притяжения разноименно заряженных ионов


Степень окисления

- Определить тип химической связи в молекулах:
Na, NaCl, Cl 2 , HCl

Степень окисления.
- Степень окисления - это условный заряд атомов, вычисленный из предположения, что вещество состоит только из ионов.
Правила для определения степени окисления.
Положительная
Отрицательная
Нулевая

Нулевая степень окисления.
- Степень окисления простых веществ и свободных атомов всегда равна нулю (0):
0
О 2
0
Cl 2
0
Fe

Отрицательная степень окисления
- Степень окисления фтора (F) всегда равна -1

Отрицательная степень окисления.
- У атома кислорода (О) степень окисления равна -2 , кроме соединений со фтором (+2)
+2 -1
ОF 2,
и в пероксидах (-1)
-1
Н 2 О 2

Положительная степень окисления.
- У металлов степень окисления всегда положительна и равна номеру группы (для металлов главных подгрупп).
- У металлов I группы С.О.= +1
- У металлов II группы С.О.= +2
- У металлов III группы С.О.= +3

Положительная степень окисления.
- У атома водорода степень окисления равна +1
+1 -2
Н 2 О,
Кроме соединений с металлами (-1) :
+1 -1
NaH
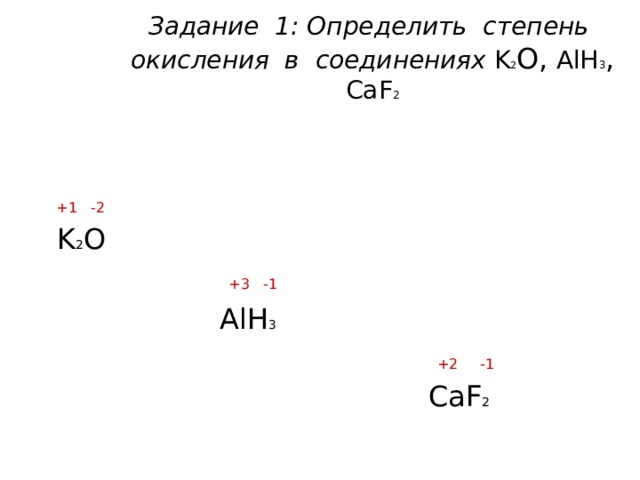
Задание 1: Определить степень окисления в соединениях K 2 О, AlH 3 , CaF 2
+1 -2
K 2 O
+3 -1
AlH 3
+2 -1
CaF 2

Суммарная степень окисления в молекуле всегда равна 0
+1 -2
Na 2 O
+3 -1
AlCl 3
+2 -1
BaH 2

- На первом месте всегда записывается элемент с положительной степенью окисления, а на втором - с отрицательной.

Составление формул соединений по степени окисления
оксид углерода (IV).
1) Записать символы химических элементов образующих соединение:
СО

2) Над атомами химических элементов в соединении проставить их степени окисления (в скобках указана переменная степень окисления элемента – она положительна):
+4 -2
СО
оксид углерода (IV).

Составление формул бинарных соединений по названию.
3) Найти наименьшее общее кратное между значениями степеней окисления:
+4 -2
СО
4

Составление формул бинарных соединений по названию.
- Определить индексы, разделив НОК на значения степеней окисления каждого элемента.
+4 -2
СО
СО 2 - оксид углерода (IV)
4
2
Индекс «1» не пишут

































































