Просмотр содержимого презентации
«Сабақтың тақырыбы Хлор»


ХЛОР
1. Хлордың ашылу тарихы
2. Периодтық жүйедегі орналасуы
3. Химиялық қасиеттері
4. Қолданылуы
5.Білімін тексеру
6 Қорытындылау

Хлордың ашылу тарихы
Хлор

Хлордың ашылу тарихы
1774 жылы Швед ғалымы К. Шееле хлорды алғаш рет алды. Ол бұл затты күрделі затқа санап, «флогистиндірілмеген» тұз қышқылы деп атады.
1807 жылы ағылшын химигі Гемфри Дэви дәл осы газды алды. Ол бұл элементті «хлорин» деп атады. Мағынасы «хлорос» - сары-жасыл деген мағынаны білдіреді.
1812 жылы Гей-Люссак газға хлор деген атау берді.
Карл Вильгельм Шееле
(1742 – 1786)
Д.И.Менделеевтің периодтық жүйесі
Периоды
Қатар
Элементтердің топтары
VI
V
IV
VIII
II
III
I
VII
H
He
1
2
1
I
1.00797
4,003
Гелий
Водород
N
O
Li
Ne
C
Be
В
F
4
7
1 0
9
6
3
8
5
2
II
12,011
15 .996
10 .811
14.0 067
20,18
18.9984
6,9 39
9 ,012
Кислород
Литий
Бор
Углерод
Азот
Неон
фтор
Вериллий
Mg
Al
Cl
S
Ar
Na
Si
P
11
1 5
1 2
1 4
1 6
13
1 8
1 7
3
III
39,948
30,9738
28,086
32,064
35,453
22,9898
26,9815
24,312
Натрий
Кремний
Фосфор
Магний
Аргон
Хлор
Сера
Алюминий
Fe
Mn
Ca
Cr
Co
S с
V
Ni
Ti
K
28
27
21
25
19
26
24
2 3
20
22
IV
4
40,08
55.847
39.102
54.938
58.933
51.996
58.71
44.956
50.942
47.90
Никель
Марганец
Хром
Титан
Калий
Кальций
Скандий
Ванадий
Железо
Кобальт
Ga
Kr
As
Zn
Br
Cu
Se
Ge
29
34
30
36
33
35
31
32
5
78.96
79.904
83,8
74.9216
72.59
65 . 37
63.54 6
69.72
Цинк
Галлий
Медь
Мышьяк
Бром
Криптон
Селен
Германий
Rh
Y
Pd
Nb
Ru
Mo
Zr
Rb
Sr
T с
37
41
46
44
45
38
40
42
4 3
39
V
6
91.224
92.906
106.4
85.47
99
88.9059
101.07
95.94
87.62
102.905
Родий
Стронций
Технеций
Рутений
Рубидий
Молибден
Цирконий
Ниобий
Иттрий
Палладий
Sn
Te
In
I
Ag
Xe
Sb
Cd
53
47
50
51
48
49
54
52
7
126.904
131,3
127.60
114 .82
107.868
112.41
121.75
118.71
Иод
Олово
Сурьма
Теллур
Индий
Ксенон
Серебро
Кадмий
Ta
Pt
W
Os
Ir
Re
Cs
Hf
La
Ba
57
76
78
75
74
56
77
73
72
55
VI
8
178.49
186.2
190.2
138.81
195.09
180.9479
192.2
137.34
183.85
132.905
Барий
Иридий
Рений
Цезий
Гафний
Тантал
Лантан
Вольфрам
Осмий
Платина
Bi
Au
Pb
Po
Hg
At
Rn
Tl
81
8 6
82
84
80
83
85
79
9
[22 2 ]
210
208.98
207.2
204.383
208.982
196.966
200.59
Ртуть
Золото
Астат
Таллий
Полоний
Радон
Свинец
Висмут
Db
Fr
Bh
Ac
Mt
Rf
Ra
Sg
Hs
107
87
88
106
109
105
104
108
89
VII
10
[ 265 ]
[ 261 ]
[ 226 ]
[ 262 ]
227.028
[ 266 ]
[ 223 ]
[ 263 ]
[ 262 ]
Актиний
Радий
Сиборгий
Резерфордий
Франций
Хассий
Борий
Мейтнерий
Дубний
![Хлордың сипаттамасы Периоды Қатары Элементтер топтары VI VII V IV VIII II III I I 1 Хлор / Chlorum (Cl) Заттың сыртқы сипаты Электрондық конфигурациясы Өткір иісті сары-жасыл түсті газ. улы Электртерістігі (Полинг бойынша) [С l ] 3s 2 3p 5 Тотығу дәрежесі 3.16 Тығыздығы 7, 6, 5, 4, 3, 1, −1 Балқу температурасы (−33.6 °C-та) 1,56 г/см ³ Қайнау температурасы 172.2 К 238.6 К 2 II III 3 4 IV 5 6 V 7 VI 8 9 10 VII](https://fsd.multiurok.ru/html/2017/11/23/s_5a1660b122a8f/img_s751880_0_5.jpg)
Хлордың сипаттамасы
Периоды
Қатары
Элементтер топтары
VI
VII
V
IV
VIII
II
III
I
I
1
Хлор / Chlorum (Cl)
Заттың сыртқы сипаты
Электрондық конфигурациясы
Өткір иісті сары-жасыл түсті газ. улы
Электртерістігі
(Полинг бойынша)
[С l ] 3s 2 3p 5
Тотығу дәрежесі
3.16
Тығыздығы
7, 6, 5, 4, 3, 1, −1
Балқу температурасы
(−33.6 °C-та)
1,56 г/см ³
Қайнау температурасы
172.2 К
238.6 К
2
II
III
3
4
IV
5
6
V
7
VI
8
9
10
VII
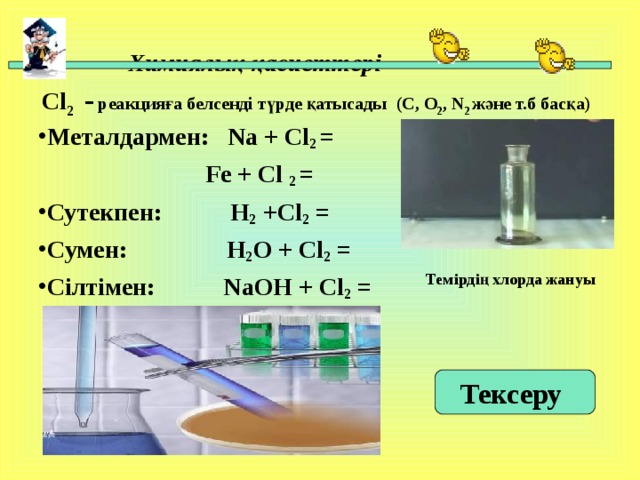
Химиялық қасиеттері Cl 2 - реакцияға белсенді түрде қатысады ( C , O 2 , N 2 және т.б басқа)
Fe + Cl 2 =
- Сутекпен: H 2 +Cl 2 =
- C умен: H 2 O + Cl 2 =
- Сілтімен: NaOH + Cl 2 =
Темірдің хлорда жануы
Тексеру
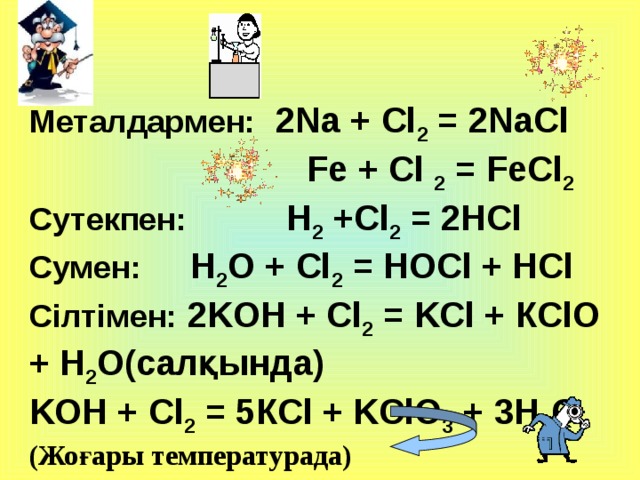
Металдармен: 2Na + Cl 2 = 2NaCl
Fe + Cl 2 = FeCl 2
Сутекпен: H 2 +Cl 2 = 2HCl
C умен: H 2 O + Cl 2 = HOCl + HCl
Сілтімен: 2 K OH + Cl 2 = K Cl + КClO + H 2 O(салқында)
K OH + Cl 2 = 5К Cl + KClO 3 + 3H 2 O
(Жоғары температурада)

С l
Ол сілекейде, қарын сөлінде,
өтте және лимфада болады.
Биологиялық
маңызы
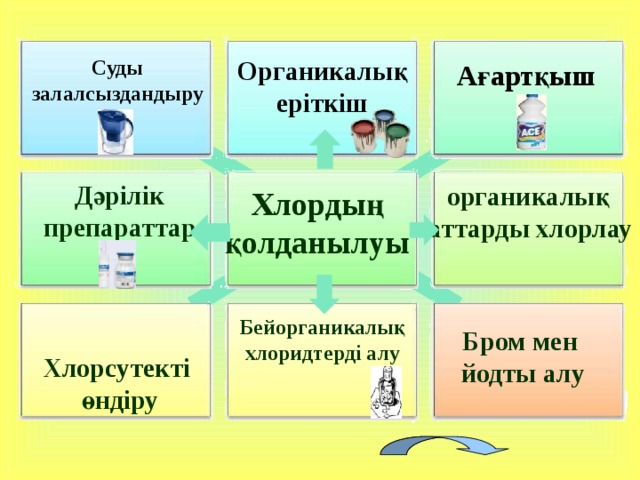
Суды залалсыздандыру
Органикалық еріткіш
Ағартқыш
Дәрілік
препараттар
органикалық заттарды хлорлау
Хлордың
қолданылуы
Бейорганикалық
хлоридтерді алу
Хлорсутекті
өндіру
Бром мен
йодты алу

Хлордың организмдегі ролі:
- Асқазанда тұз қышқылын өндіреді.
- Қан, лимфа, ұлпалардың жұмысын реттеуге қатысады.
- Зат алмасу процесіне қатысады, оранизмнің су балансын сақтайды.
- Дененің иілгіштігін;;
- Тәбеттің болуы;
- Бауыр жұмысын жақсартады;
- Организмнен көмірқышқыл газын шығаруға септігін тигізеді;
- Эритроциттердің құрамын қалыптастырады;
- Организмнен шлак пен токсиндерді шығарады.

- Организмге хлор жетіспегенде пайда болады:
- Әлсіздік,
- Тәбеттің жоқтығы;
- Ұйқышылдық;
- Ұмытшақтық,
- Бұлшықеттің әлсіздігі,
- Ауыздың құрғауы,
- Дәм сезбеу.
- Ауыр жағдайда шаш пен тіс түседі
- Егер орга низ мде хлор артып кетсе:
- Көз жасаурайды,
- Құрғақ жөтел,
- Кеуденің ауыруы,
- Бас ауруы,
- Температураның көтерілуі,
- Өкпенің ісуі. .

Бүгінгі сабақта мен . . . үйрендім.
Бүгінгі сабақта мен . . . білдім.
Бүгінгі сабақтан кейін мен қоршаған ортаға . . . .










![Хлордың сипаттамасы Периоды Қатары Элементтер топтары VI VII V IV VIII II III I I 1 Хлор / Chlorum (Cl) Заттың сыртқы сипаты Электрондық конфигурациясы Өткір иісті сары-жасыл түсті газ. улы Электртерістігі (Полинг бойынша) [С l ] 3s 2 3p 5 Тотығу дәрежесі 3.16 Тығыздығы 7, 6, 5, 4, 3, 1, −1 Балқу температурасы (−33.6 °C-та) 1,56 г/см ³ Қайнау температурасы 172.2 К 238.6 К 2 II III 3 4 IV 5 6 V 7 VI 8 9 10 VII](https://fsd.multiurok.ru/html/2017/11/23/s_5a1660b122a8f/img_s751880_0_5.jpg)
























