Тема «Аммиак»
Цель: формирование знаний учащихся об аммиаке, а на их основе предметных навыков и умений, с использованием самостоятельной работы учащихся под руководством учителя.
На уроке будут решаться следующие дидактические задачи:
Образовательные: познакомить учащихся с физическими свойствами аммиака, его строением, химическими свойствами. Вспомнить области применения аммиака.
Продолжать формировать и развивать надпредметные умения и навыки: работа с компьютером, умение грамотно доказывать истинность своих суждений, объяснять понятия. Продолжать обучать учащихся умению самостоятельно овладевать знаниями.
Развивающие: развивать умения: выделять главное, сравнивать, обобщать. Продолжать развитие речи, т.е. усложнение и обогащение предметного языка. Продолжать развивать познавательный интерес и интеллектуальные способности в процессе самостоятельного приобретения химических знаний. Развивать сенсорную сферу учащихся: точность и тонкость в различии цветов, звуков речи.
Воспитательные: реализовывать научно - материалистическое обучение учащихся. Воспитание нравственных (вежливость, взаимопомощь), трудовых, эстетических качеств личности. Дисциплинированность, самостоятельность.
| Этапы урока | Деятельность учителя | Деятельность учащихся, результат деятельности учащихся |
| 1.Организационный этап | Приветствие учащихся. | Приветствие учителя. |
| Организация внимания. | Внимание учащихся. |
| Создание благоприятной психологической атмосферы. | |
| Проверка готовности учащихся к уроку. | Учащиеся готовы к уроку |
| 2. Подготовка учащихся к активному сознательному усвоению новых знаний
| Стадия вызова (слайд №1). Попросила сегодня в аптеке нашатырный спирт. Когда домой пришла, обнаружила, что на пузырьке написано не Нашатырный спирт, а Аммиак для наружного применения и ингаляций 10%. В составе - Аммиак водный концентрированный и очищенная вода. Почему же в составе отсутствует спирт? Ничего не понимаю. В общем, чего это я такое в аптеке купила? Аноним На какие вопросы мы должны ответить, чтобы помочь анониму разобраться в его сомнениях? | Учащиеся задаются вопросами: Что называется нашатырным спиртом? Почему называется спиртом, если его нет в составе? Что общего между нашатырным спиртом и нашатырем?
|
| Сообщение темы урока (слайд № 2) и план работы. | Записывают в тетрадь тему урока. |
|
|
|
| 2. Работа с текстом (V, +, ?) Посредине ливийской пустыни стоял храм, посвященный богу Амону Ра. В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир» (Позднее это слово превратилось в "нашатырь" - так назвали хлорид аммония NH4Cl), его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак». В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт». В 1673 году английский физик и химик Роберт Бойль (1627-1691) наблюдал, как дымится палочка, смоченная соляной кислотой, над горящим навозом. "Дым" был результатом образования мельчайших кристалликов хлорида аммония при реакции, выделяющегося из навоза аммиака с хлороводородом.
Почему спирт?
Существовали названия, связанные с различными характеристиками веществ. При этом характеристики брались случайно. Так, летучие жидкости называли спиртами (от лат. спиритус - дух): соляной спирт - соляная кислота; нашатырный спирт - водный аммиак; купоросный спирт - серная кислота. В старину пожилые светские дамы, опасаясь обморока в духоте, всегда имели при себе флакончики с «нюхательной солью» – нашатырем. В водной среде (например, под действием поглощенной из воздуха влаги) хлорид аммония подвергается гидролизу, поэтому он всегда, немного пахнет аммиаком. Вдыхание аммиака вызывает возбуждение дыхательных центров. В небольшом количестве аммиак – это средство первой помощи, помогающее вывести человека из обморочного состояния, однако, большое количество аммиака может вызвать остановку дыхания. Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и проведем опыт Бойля.
| Учащиеся читают текст и на полях отмечают знаками V - знал, + - узнал новое, ? – есть вопросы.
Анализ текста. |
| |
|
|
|
|
|
|
|
| 3.Усвоение новых знаний | Организует самостоятельную работу учащихся с учебником (§ 29 стр.141): Найдите в параграфе и запишите в тетрадь физические свойства аммиака, что такое нашатырный спирт и аммиачная вода.
Найдите в параграфе способы получения аммиака и закончите схему (слайд № 4). Проверка схемы ( слайд №5). | Самостоятельно работают с учебником: 1.Находят в параграфе способы получения аммиака и заканчивают схему в тетради. Проверяют записанную в тетради схему по слайду (№ 5) |
| | 2. | 2. Записывают в тетрадь физические свойства аммиака, определение нашатырного спирта, аммиачной воды. |
|
| А теперь проверьте свои знания по физическим свойствам аммиака: открывает слайд № 6. Докажите, что аммиак легче воздуха. | |
| Получение аммиака в лаборатории и изучение его свойств. Повторение техники безопасности (слайд 6) правила работы со спиртовкой, правильное определение запахов. Инструктирует о получении аммиака в лаборатории. В лаборатории аммиак получают нагреванием смеси гидроксида кальция с хлоридом аммония. Для определения выделяющегося аммиака нам понадобится конц. соляная кислота. При их взаимодействии выделяется белый дым. Итак, соберите установку для получения аммиака и его распознавание смоченной в конц. кислоте стеклянной палочкой. Если вы наблюдаете, сильное образование дыма, то можете приступать к растворению газа в воде, предварительно добавив в воду фенолфталеин. Почему ф/ф окрасил раствор в малиновый цвет? С каким классом веществ будет взаимодействовать щелочь?
Разлейте полученную смесь в две пробирки. В первую добавьте кислоты до нейтрализации раствора. А вторую пробирку нагрейте на спиртовке. Что наблюдаете? Объясните свои наблюдения и запишите химические уравнения реакций. | Учащиеся по рисункам на слайде, озвучивают правила ТБ.
Собирают установку и демонстрируют её преподавателю. Затем получают аммиак и собирают его в пробирке с водой. Записывают схему установки и химические уравнения реакций.
Проводят опыты, и записывают химические уравнения реакций.
|
| 4. Закрепление новых знаний | Восстановление текста. Физические свойства аммиака: ......... Аммиак ... воздуха, поэтому сухая пробирка – приемник находится дном... .
Mr(NH3) = ...
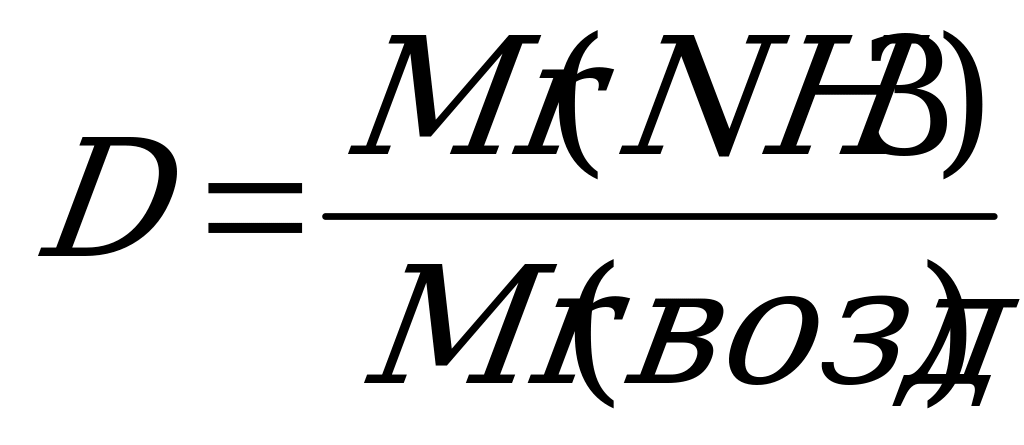 = ... = ... Аммиак ... растворим в воде . Продукт взаимодействия аммиака с водой называется ... . Относится к классу ... . Механизм образования химической связи в катионе ... . Тип реакции ... . Почему исчезла первоначальная окраска раствора? Название продукта взаимодействия гидроксида аммония с соляной кислотой ... . К какому классу относится продукт реакции? ... Тип реакции ... | Взаимоконтроль. |
| 5. Информация о дом. задании и инструктаж по его выполнению. |
| |
Тест для закрепления новых знаний по теме: «Аммиак» 1 вариант 1.Из каких веществ получают аммиак в промышленности:
А. N2 и H2 Б. NH4CL и Ca(OH)2 В. HCl и N2 Г. (NH4)SO4
2. Что такое аммиачная вода:
А. 18 – 25 % раствор аммиака
Б. 3-10 % раствор аммиака
В. 50 % раствор аммиака
3. Укажите верное утверждение:
А. Аммиак – твёрдое вещество, плохо растворимое в воде.
Б. Аммиак – бесцветный газ, без запаха, хорошо растворим в воде.
В. Аммиак - бесцветный газ, с характерным запахом, хорошо растворим в воде.
Г. Аммиак - бесцветный газ, без запаха, плохо растворим в воде.
4. Какую валентность проявляет азот в аммиаке?
А. 4 Б.3 В. 2
5. При окислении аммиака в присутствии катализатора образуются:
А. NО и H2O Б. N2 и H2O В. N2 и H2
2вариант 1.Из каких веществ получают аммиак в лаборатории:
А. N2 и H2 Б. HCl и N2 В. NH4CL и Ca(OH)2 Г. (NH4)SO4
2. Что такое аммиачная вода:
А. 18 – 25 % раствор аммиака
Б. 50 % раствор аммиака
В. 3 -10 % раствор аммиака
3. Укажите верное утверждение:
А. Аммиак – твёрдое вещество, плохо растворимое в воде.
Б. Аммиак – бесцветный газ, без запаха, хорошо растворим в воде.
В. Аммиак - бесцветный газ, с характерным запахом, хорошо растворим в воде.
Г. Аммиак - бесцветный газ, без запаха, плохо растворим в воде.
4. Какую степень окисления проявляет азот в аммиаке и катионе аммония?
А. - 4 Б. +3 В. -2 Г.-3
5. При окислении аммиака без катализатора образуются:
А. N2 и H2O Б. NО и H2O В. N2 и H2

























