Урок 162
Тема: Кальций, его получение, физические и химические свойства. Важнейшие соединения кальция, их значение и применение. Кальций в природе, его биологическая роль.
Цель: формирование понятия о кальции и его соединениях входящих в состав природных вод, осадочных пород, познакомиться с практическим применением соединений кальция.
Задачи:
Образовательная:
- Рассмотреть кальций как химический элемент и как простое вещество, его свойства, образуемые соединения. Показать зависимость физических свойств кальция от наличия в нём металлической связи и особенностей кристаллического строения; на основе строения атома выявить закономерности химических свойств металла.
Развивающая:
- Продолжить формировать умения давать характеристику химическому элементу по ПСХЭ, проводить эксперимент, составлять уравнения химических реакций характеризующие химические свойства простого вещества – кальция и его соединений.
- Развитие навыков самостоятельной работы, коммуникативных способностей учащихся, находить причинно-следственные связи, аргументировать ответ, делать выводы на основе имеющихся теоретических знаний и проделанных опытов.
Воспитательная:
- Воспитывать интерес к химии как науке, через примеры связанные жизнью. Воспитание у школьников интереса к местному промышленному производству.
Тип: изучение нового материала
Планируемые результаты:
Предметных:
−− сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
−− владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
−− сформированность собственной позиции по отношению к химической информации, получаемой из разных источников;
Метапредметных:
−− использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
−− использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностных:
−− чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
−− готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
−− умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности.
Методы и формы проведения занятия: объяснительно-иллюстративный, фронтальная беседа по теме, учебная лекция, фронтальная и самостоятельная работы по схеме.
Методическое обеспечение: рабочая и учебная программа, конспект занятия, учебник, электронный учебник.
Литература: Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2014.
Ход занятия:
Ход занятия:
I.Организационный момент:
-
Приветствие студентов и отчет старосты об отсутствующих.
-
Проверка готовности аудитории к занятию.
II.Актуализация опорных знаний и Мотивация учебной деятельности:
1.Объявление темы и цели занятия.
2.Мотивация.
III. Изучение нового учебного материала:
СОЕДИНЕНИЯ КАЛЬЦИЯ
Перечислим наиболее часто используемые соединения кальция.
Оксид кальция СаО – негашёная известь. При взаимодействии с водой происходит гашение извести, при этом выделяется много тепла:
СаО + H2O = Са(ОН)2
Гидроксид кальция Са(ОН)2 – гашёная известь. Раствор гидроксида кальция – известковая вода. Известковая вода поглощает углекислый газ, происходит помутнение вследствие образования нерастворимого карбоната кальция:
Са(ОН)2 + СO2 = СаСO3↓ + H2O
При пропускании избытка углекислого газа помутнение исчезает, образуется растворимый в воде гидрокарбонат кальция:
СаСO3 + H2O + СO2 = Са(НСO3)2
Сульфат кальция двухводный CaSO4 • 2Н2О – гипс, а другой кристаллогидрат сульфата кальция – 2CaSO4 • H2O – алебастр. Гипс и алебастр используются в строительстве, медицине и для изготовления декоративных изделий.
Карбонат кальция СаСО3 – это мел, мрамор, известняк, кальцит (исландский шпат).
Ортофосфат кальция Са3(РO4)2 – фосфорит, фосфоритная мука. Используется как фосфорное удобрение.
Чистый безводный хлорид кальция СаCl2 чрезвычайно гигроскопичен, поэтому широко применяется в лаборатории как осушитель в виде гранул. В медицине используется 10%-й раствор хлорида кальция. Ионы Са2+ способствуют хорошей сворачиваемости крови.
Карбид кальция СаС2 используется для получения ацетилена:
СаС2 + 2H2O = Са(ОН)2 + C2H2↑
Его получают в электропечах при нагревании с углём: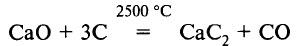
СОЕДИНЕНИЯ КАЛЬЦИЯ И МАГНИЯ
Соединения кальция и магния широко распространены в природе. Наличие ионов Са2+ и Mg2+ в природных водах обусловливает особые свойства воды, которые называют её жёсткостью. В жёсткой воде не мылится мыло (вследствие образования нерастворимых солей кальция и магния – стеаратов кальция и магния), при нагревании жёсткой воды образуется накипь и т. д.
Временная жёсткость воды обусловлена присутствием в качестве катионов – ионов кальция и магния, а в качестве анионов – гидрокарбонат-ионов. Такую жёсткость воды можно устранить даже кипячением: 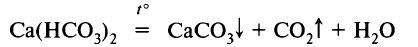
Так ионы кальция оказываются связанными с карбонат-ионами в осадке – карбонате кальция. Концентрация ионов кальция в растворе заметно уменьшается, вода становится мягкой.
Другой способ перевода ионов кальция в осадок – добавление к жёсткой воде известковой воды, в этом случае кислая соль переходит в среднюю:
Са(НСО3)2 + Са(ОН)2 = 2CaCO3↓ + 2H2O
Можно умягчать воду с помощью реакций ионного обмена. При взаимодействии жёсткой воды с раствором соды образуется осадок карбоната кальция:
Са(НСO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3
Постоянная жёсткость воды обусловлена наличием ионов кальция и магния – в качестве катионов и дигидрофосфат-ионов, хлорид-ионов, нитрат-ионов и др. – в качестве анионов. С таким видом жёсткости воды можно справиться только благодаря реакциям ионного обмена. Надо подобрать такие реакции ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок. Например:
3MgCl2 + 2Na3PO4 = Mg3(PO4)2↓ + 6NaCl
IV. Обобщение и систематизация знаний:
Задание 1. Составьте уравнения реакций для осуществления следующих превращений:
Ca - CaO - Ca(OH)2 - CaCO3 - CaO - CaCl2 - Ca3(PO4)2
Уравнение последней реакции запишите не только в молекулярном, но и в ионном виде.
Задание 2. Дайте характеристику КАЛЬЦИЮ по плану:
1. Положение в ПСХЭ
2. Строение атома
3. Физические свойства
4. Получение
5. Химические свойства (запишите УХР кальция с кислородом, серой, соляной кислотой, водой, водородом, хлором)
6. Применение кальция.
V. Домашнее задание:
1. учить конспект,
2. Используя дополнительные источники и учебник, заполните таблицу «Соединения кальция»
| Название вещества | Химическая формула | Физические свойства | Практическое значение |
| Гашёная известь | | | |
| Негашёная известь | | | |
| Известковое молоко | | | |
| Известковая вода | | | |
| Гипс природный | | | |
| Жжёный гипс | | | |
VI. Подведение итогов. Выставление оценок


























