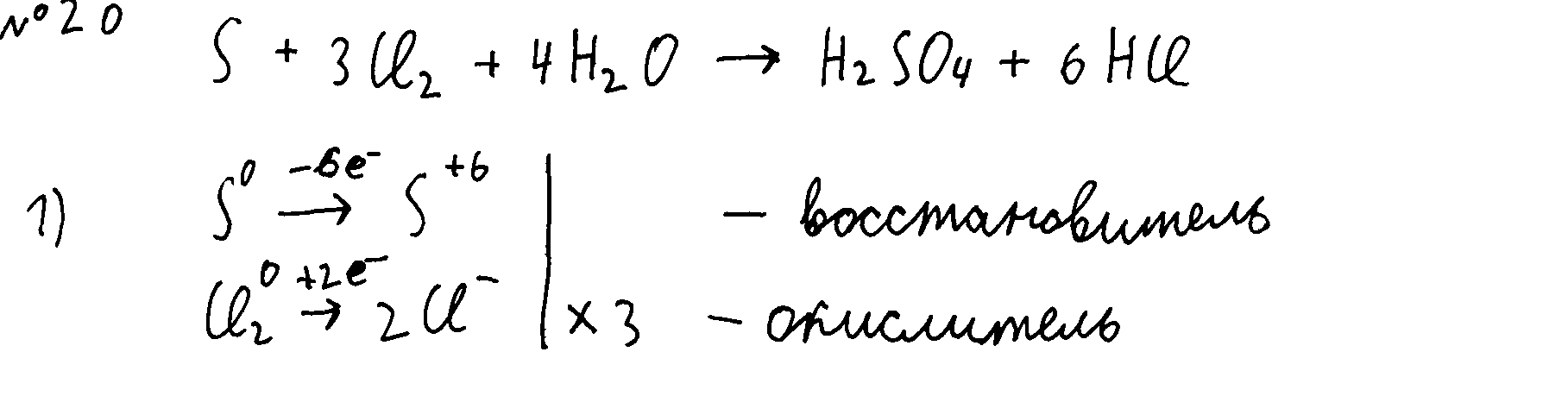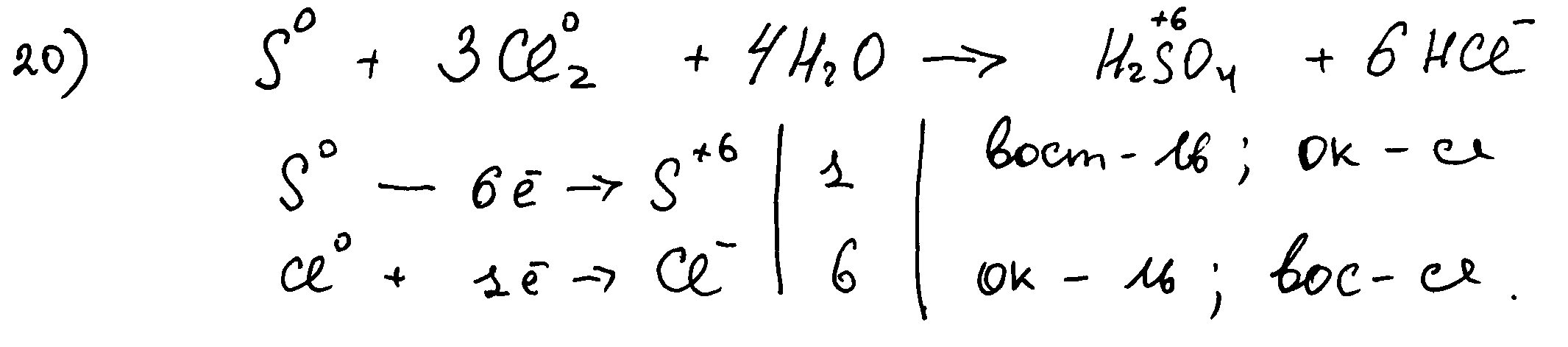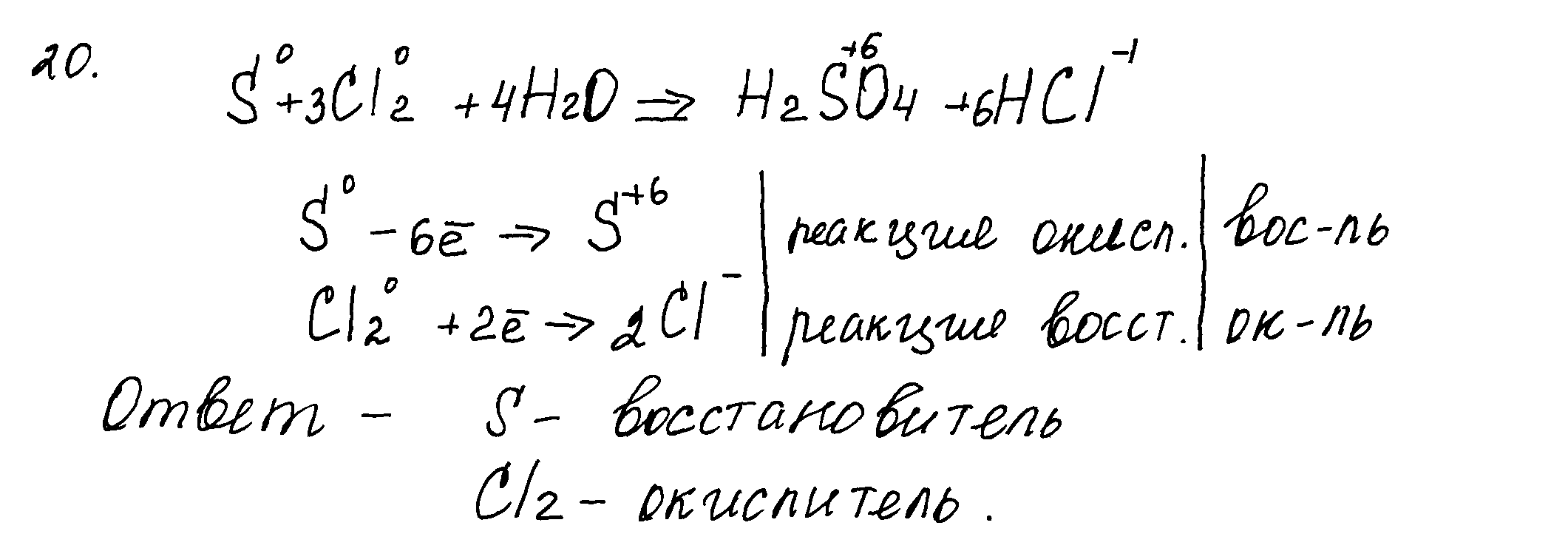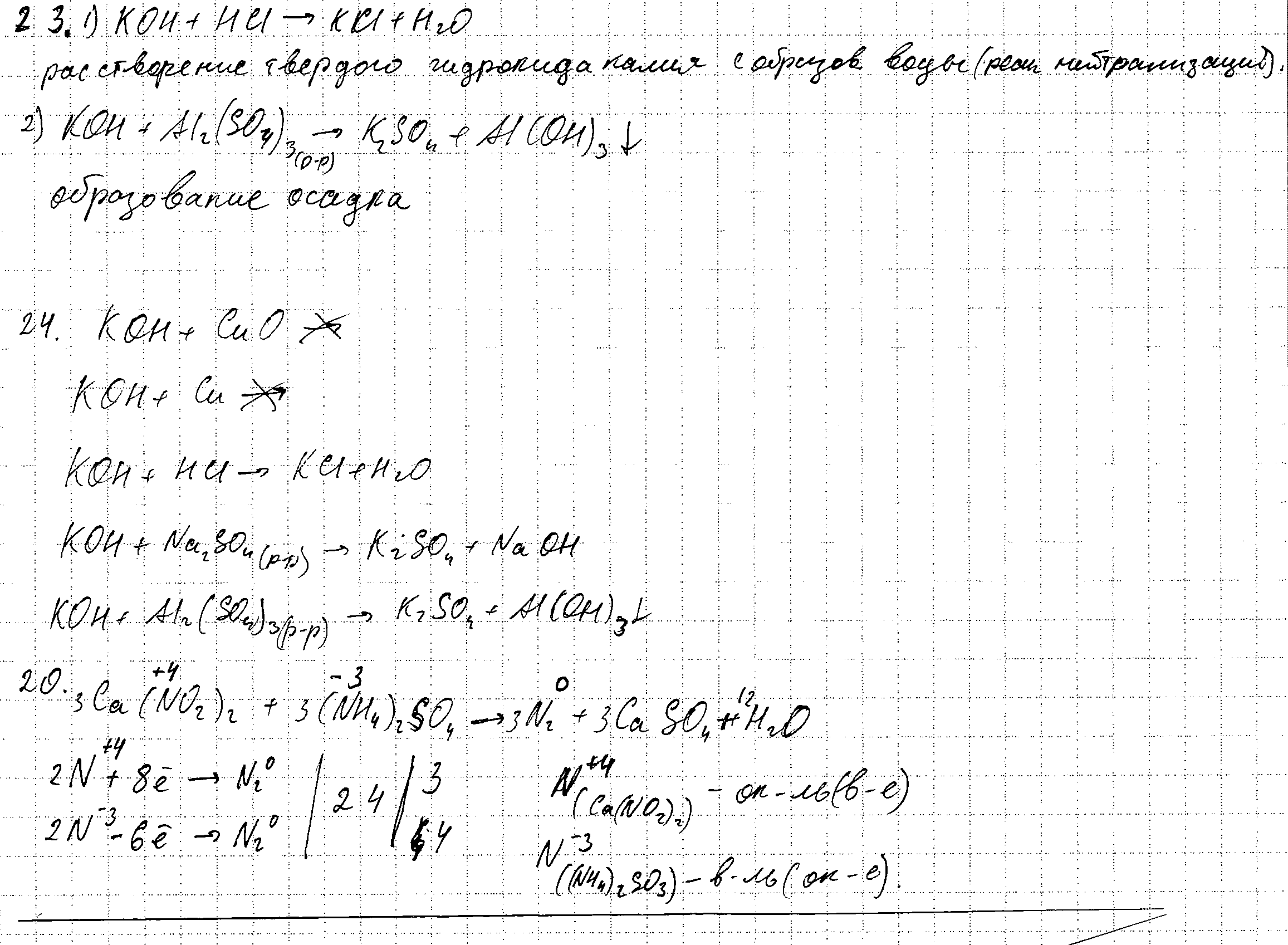Просмотр содержимого документа
«"Критерии оценивания открытых заданий ОГЭ по химии"»
Домашняя работа слушателя курсов по подготовке экспертов территориальных подкомиссий предметных комиссий
Рогозинниковой ЖН, МАОУ «СОШ № 57», Новоуральск
Сроки проведения курсов: 08.02 – 12.02.21
3. Материалы для практических занятий по оцениванию выполнения заданий
3.1. Оценивание экзаменационных работ учащихся (линии заданий)
Задание 20
Используя метод электронного баланса, составьте уравнение реакции
S + Cl2 + H2O → H2SO4 + HCl
Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) Составлен электронный баланс: | 3 1 | Cl20 + 2ē → 2Cl-1 S0 – 6ē → S+6 | 2) Указано, что сера в степени окисления 0 является восстановителем, а хлор в степени окисления 0 (или Cl2) – окислителем; 3) Составлено уравнение реакции: S + 3Cl2 + 4H2O = H2SO4 + 6HCl |
|
| Ответ правильный и полный, содержит все названные выше элементы | 3 |
| В ответе допущена ошибка только в одном из элементов | 2 |
| В ответе допущены ошибки в двух элементах | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Примеры решения задания 20 для оценивания
20-1
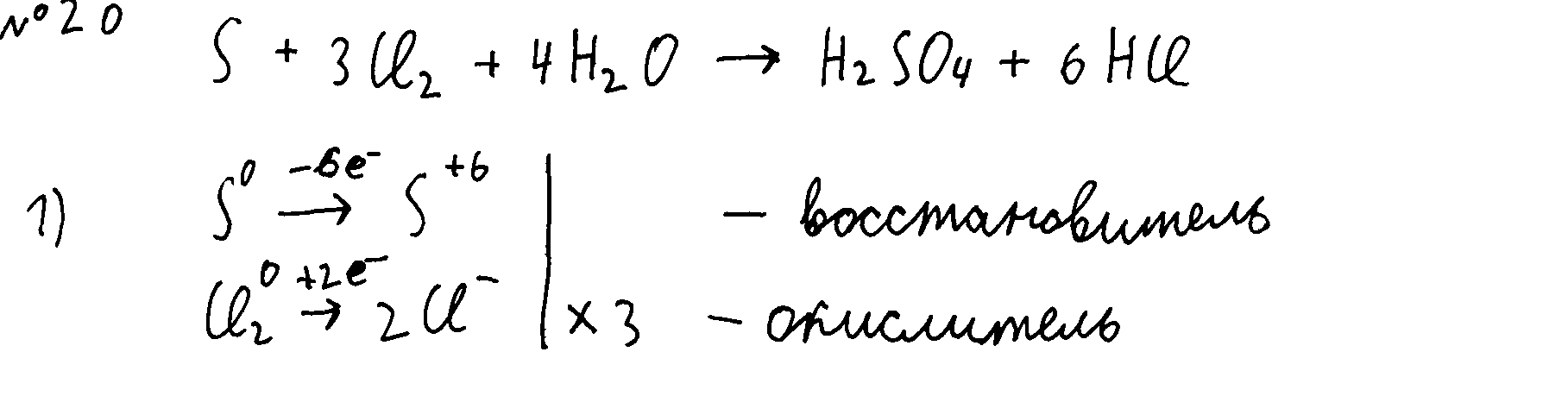
20-2
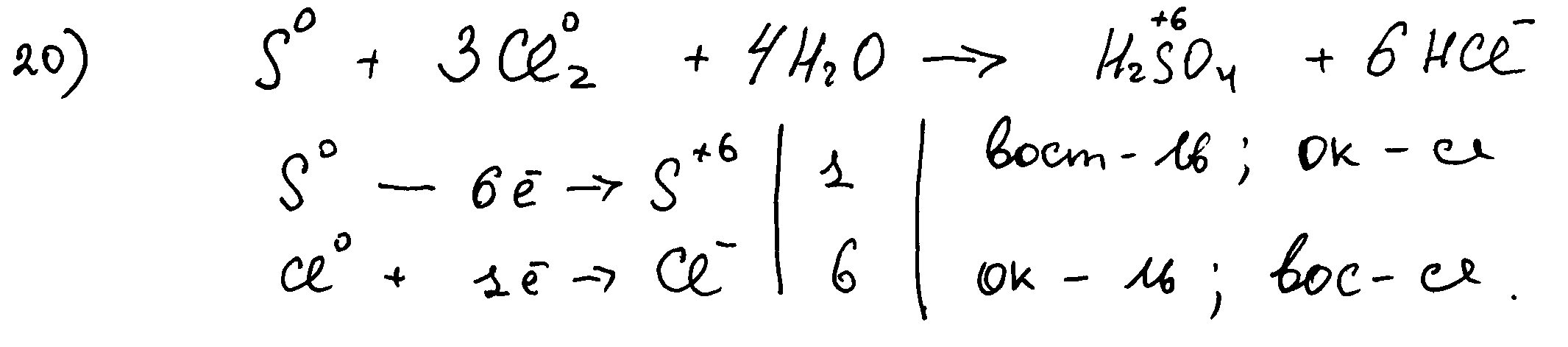
20-3
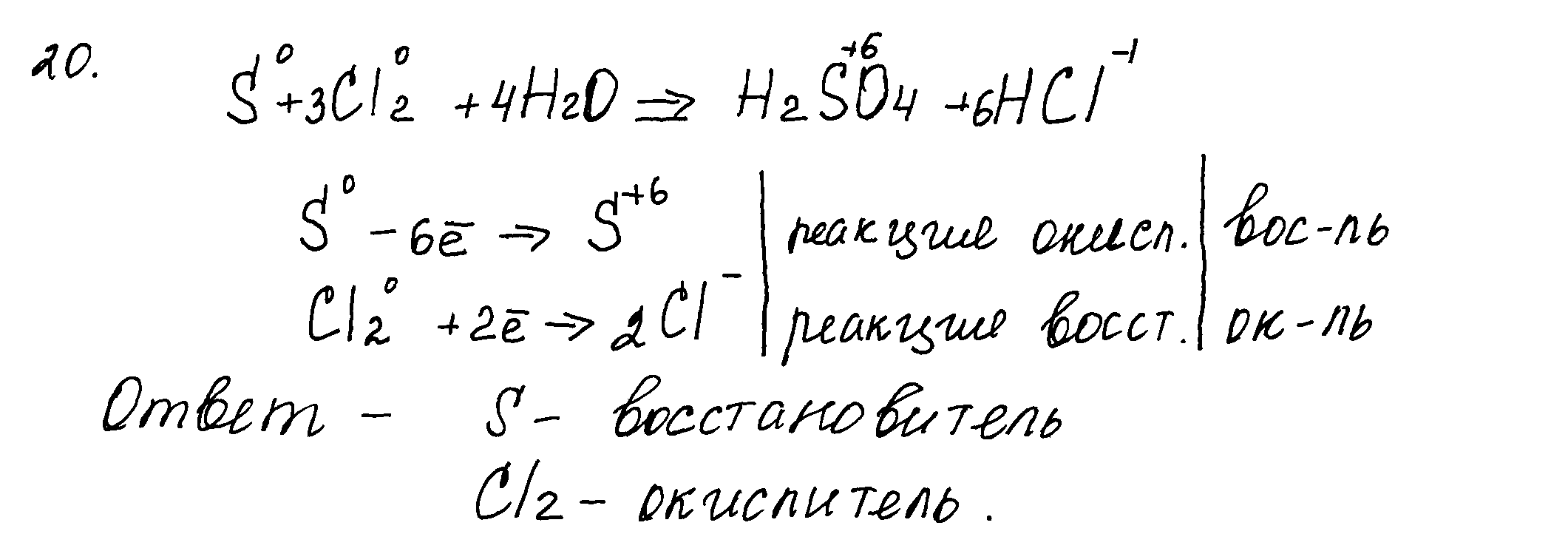
20-4

20-5

| №задания | Пример 1 | Пример 2 | Пример 3 | Пример 4 | Пример5 |
| 20 задание | 0 | 2 | 3 | 2 | 1 |
| 21 задние | 3 | 1 | 0 | 3 | 1 |
| 22 задание | 1 | 0 | 3 | 4 | 5 |
| 23 задание | 0 | 1 | 2 | 2 | 2 |
3.2. Оценивание вариантов экзаменационных работ
Критерии оценивания выполнения заданий экзаменационного варианта
20
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Ca(NO2)2 + (NH4)2SO4 → N2 + CaSO4+ H2O
Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) Составлен электронный баланс: | 1 1 | 2N+3 + 6ē → N20 2N–3 – 6ē → N20 | 2) Указано, что азот в степени окисления –3 ((NH4)2SO4) является восстановителем, а азот в степени окисления +3 (или Ca(NO2)2) – окислителем. 3) Составлено уравнение реакции: Ca(NO2)2 + (NH4)2SO4 = 2N2 + CaSO4+ 4H2O |
|
| Ответ правильный и полный, содержит все названные выше элементы | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
21
Дана схема превращений:
Zn(OH)2 → ZnSO4 → X → ZnO
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Написаны уравнения реакций, соответствующие схеме превращений: 1) Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O 2) ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4 3) Zn(OH)2 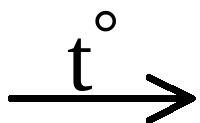 ZnO + H2O ZnO + H2O Составлено сокращённое ионное уравнение первого превращения: 4) Zn(OH)2 + 2H+ = Zn2+ + 2H2O |
|
| Правильно записаны четыре уравнения реакций | 4 |
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
22
В результате взаимодействия растворов нитрата серебра и хлорида калия, взятого в избытке, выпал осадок массой 2,87 г. Вычислите массу исходного раствора нитрата серебра с массовой долей 17%, взятого для реакции.
В ответе запишите уравнение реакции, о которой идёт речь в условии задачи,
и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) Составлено уравнение реакции: AgNO3 + KCl = AgCl + KNO3 2) Рассчитанo количество вещества хлорида серебра: n(AgCl) = m(AgCl)/M(AgCl) = 2,87 : 143,5 = 0,02 моль 3) Определены количество вещества и масса раствора нитрата серебра: по уравнению реакции n(AgNO3) = n(AgCl) = 0,02 моль m(AgNO3) = n(AgNO3) · M(AgNO3)/ω = 0,02 · 170 : 0,17 = 20 г |
|
| Ответ правильный и полный, содержит следующие элементы: – правильно записано уравнение реакции, соответствующее условию задания; – правильно произведены вычисления, в которых используются физические величины, заданные в условии задания; – в соответствии с условием задания определена искомая физическая величина | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Дан раствор гидроксида калия, а также набор следующих реактивов: оксид меди(II), медь, соляная кислота, растворы сульфата натрия и сульфата алюминия.
23
Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства гидроксида калия, и укажите признаки их протекания.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: Составлены уравнения двух реакций, характеризующих химические свойства гидроксида калия: 1) 6KOH + Al2(SO4)3 = 3K2SO4 + 2Al(OH)3 2) HCl + KOH = H2O + KCl Указаны признаки протекания реакций 3) Для первой реакции – выпадение белого осадка. 4) Для второй реакции – видимые признаки реакции отсутствуют, или при использовании фенолфталеина с раствором щёлочи – обесцвечивание раствора (исчезновение малиновой окраски раствора) |
|
| Ответ правильный и полный, содержит все названные элементы | 4 |
| Правильно записаны три элемента ответа | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
24
Проведите химические реакции между гидроксидом калия и выбранными веществами, соблюдайте правила техники безопасности, приведённые
в инструкции к заданию.
Работы учащихся для оценивания экспертами
Работа 1.

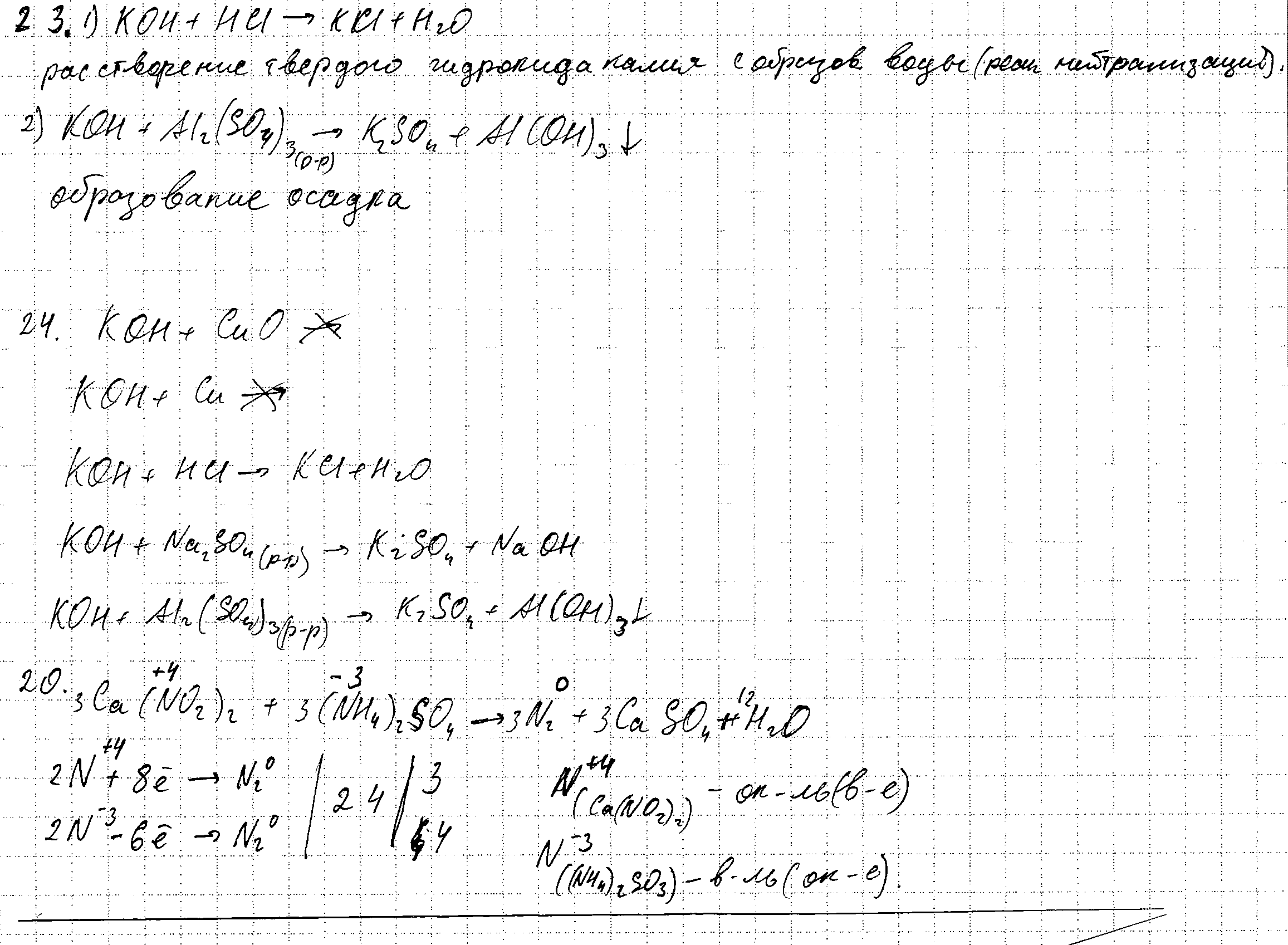
| № | 20 | 21 | 22 | 23 |
| Работа 1 | 0 | 1 | 2 | 2 |
| Работа 2 | 1 | 1 | 3 | 4 |
| Работа 3 | 0 | 0 | х | 3 |
| Работа 4 | 1 | 3 | 2 | 1 |
| Работа 5 | 3 | 4 | 3 | 3 |