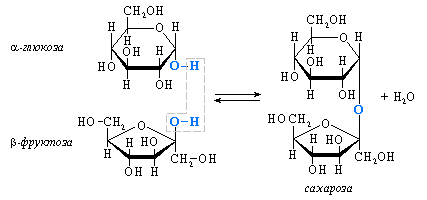
| Формула С12Н22О11
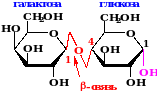
В молекуле лактозы остатки ẞ-D- галактопиранозы и α–D–глюкопиранозы связаны между собой ẞ -1,4- гликозидной связью, образованной за счет взаимодействия полуацетального гидроксила галактозы и спиртового гидроксила глюгозы. Поэтому лактоза – восстанавливающий дисахарид, так как содержит полуацетальный гидроксил. При гидролизе лактоза распадается на глюкозу и галактозу.
С12Н22О11+H2O → С6Н12О6 + С6Н12О6 Лактоза Галактоза Глюкоза Лактоза - молочный сахар, резервный дисахарид. Содержится в молоке (4-5%) и ее получают в сыроваренной промышленности из молочной сыворотки после отделения творога. Сбраживается лишь особыми лактозными дрожжами, содержащимися в кефире и кумысе. Именно этот углевод придает молоку сладкий вкус. Значение лактозы очень велико, т.к. она является важным питательным веществом, особенно для растущих организмов человека и млекопитающих животных. В отличие от сахарозы, лактоза является восстанавливающим дисахаридом. Она реагирует с аммиачным раствором оксида серебра и реактивом Фелинга, при нагревании окисляясь в лактобионовую кислоту. Реакции окисления лактозы:
С12Н22О11 + Ag2O → С12Н22О12 + 2Ag лактобионовая кислота С12Н22О11 + 2Cu(OH)2 → С12Н22О12 + Cu2O + 2H2O
Кислотный или ферментативный гидролиз лактозы приводит к получению D –галактозы и D-глюкозы. С12Н22О11 + Н2O → С6Н12О6 + С6Н12О6
Лактоза, как и все углеводы, проявляет свойства многоатомных спиртов С12Н22О11 + Cu(OH)2 → CuC12H20O11 + 2Н2О Лактонат меди (II)
Применяют лактозу при производстве продуктов детского питания, диабетических продуктов, для получения золотисто-коричневой корочки хлебобулочных изделий, при изготовлении жареного хрустящего картофеля и глазури. Лактозу используют при производстве заменителей молока, при производстве мороженого и лекарственных препаратов.
-
Мальтоза. Строение, свойства, применение Формула С12Н22О11
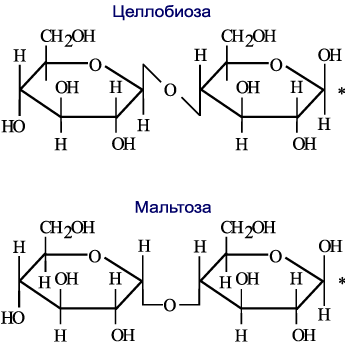
В молекуле мальтозы остатки двух молекул α–D–глюкопиранозы связаны между собой α -1,4- гликозидной связью, образованной за счет взаимодействия полуацетального гидроксила одной и спиртового гидроксила другой молекулы глюгозы. Поэтому мальтоза – восстанавливающий дисахарид, так как содержит полуацетальный гидроксил.
При гидролизе распадается на две молекулы глюкозы. Образуется в животном организме при расщеплении крахмала и гликогена ферментами амилазы, находится в проросших зернах (солод, ячмень и др.), отсюда и название - от латинского названия солода - maltum. Второе название - солодовый сахар. Наличие в молекуле мальтозы гликозидного гидроксила определяет ее восстановительные свойства подобно лактозе. При окислении реактивом Толленса мальтоза превращается в монокарбоновую мальтобионовую кислоту. С12Н22О11 + 2Cu(OH)2 → С12Н22О12 + Cu2O + 2H2O мальтобионовая кислота Глюкозу мальтоза дает при кислотном или ферментативном гидролизе. С12Н22О11 + Н2O → 2 С6Н12О6
Как многоатомный спирт мальтоза образует простые и сложные эфиры, а также растворимые в воде комплексы с гидроксидами металлов. Применяется мальтоза в пищевой промышленности: при изготовлении продуктов детского питания, питательных сред в микробиологии, при производстве пива. Мальтоза, сахароза и лактоза гидролизуются на две молекулы гексоз, поэтому являются дисахаридами. Имеют один и тот же состав, значит являются изомерами. Широко распространены в природе и активно применяются человеком. |