
Практическая работа № 2. Получение и свойства соединений металлов
Муниципальное бюджетное учреждение города Иркутска СОШ № 16
Мелещенко Надежда Григорьевна

- Научиться применять теоретические знания при проведении эксперимента на примере получения соединений металлов
Цель урока:

- - Получить соединения металлов экспериментальным путем;
- - закрепить навыки записи реакций ионного обмена;
- - вспомнить химические свойства и некоторые способы получения основных классов неорганических соединений;
- - продолжить развивать умение рассуждать, логически мыслить, наблюдать, объяснять, анализировать, сопоставлять и делать выводы. проводить эксперимент;
- учиться аккуратно и бережно относиться к оборудованию реактивам, помнить о правилах ТБ.
Задачи:

- Опишите происходящие с веществами изменения.
- Напишите уравнения соответствующих реакций.
- Рассмотрите первое уравнение с точки зрения окисления - восстановления, второе запишите в молекулярной и ионной формах.
- Объясните изменения, происходящие с конечным продуктом последней реакции.
- Запишите соответствующее уравнение реакции.
Осуществите следующие превращения: Fe → FeCI 2 → Fe(OH) 2 → Fe(OH) 3

- Формирование навыков на основе применения их в стандартных условиях.
- Откроем учебники и посмотрим, какие опыты мы будем проводить ( изучение инструкции проведения опытов).
- Определяя план действий.
- Какая перед нами стоит задача?
- Какие необходимы приборы и материалы для проведения опытов?
- Какие правила техники безопасности мы должны соблюдать при выполнении работы?

Реакция соляной кислоты с железом

Получение гидроксида железа II и изучение его свойств

Что делали.
Что наблюдали.
В пробирку с железными опилками добавляется раствор соляной кислоты.
Уравнения реакций. Вывод.
Добавим к полученному хлориду железа (II) щелочи.
Оставим осадок на несколько минут.
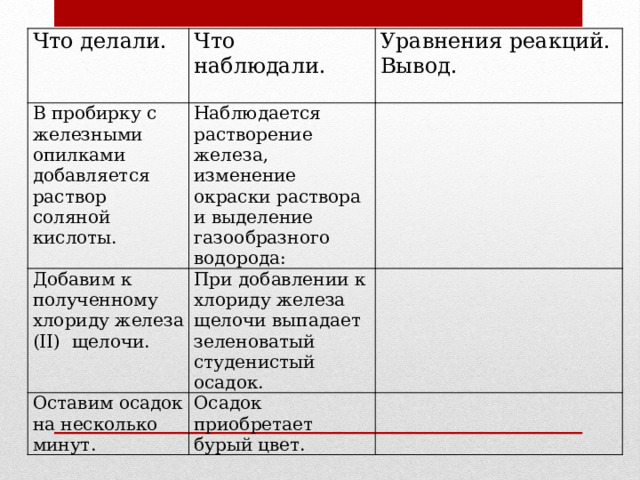
Что делали.
Что наблюдали.
В пробирку с железными опилками добавляется раствор соляной кислоты.
Уравнения реакций. Вывод.
Наблюдается растворение железа, изменение окраски раствора и выделение газообразного водорода:
Добавим к полученному хлориду железа (II) щелочи.
При добавлении к хлориду железа щелочи выпадает зеленоватый студенистый осадок.
Оставим осадок на несколько минут.
Осадок приобретает бурый цвет.
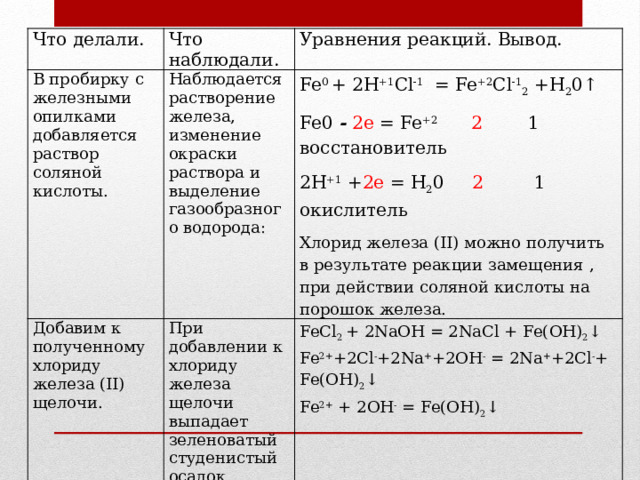
Что делали.
Что наблюдали.
В пробирку с железными опилками добавляется раствор соляной кислоты.
Наблюдается растворение железа, изменение окраски раствора и выделение газообразного водорода:
Уравнения реакций. Вывод.
Добавим к полученному хлориду железа (II) щелочи.
Fe 0 + 2Н +1 Сl -1 = Fe +2 Cl -1 2 +Н 2 0↑
При добавлении к хлориду железа щелочи выпадает зеленоватый студенистый осадок.
Оставим осадок на несколько минут.
Fe0 - 2е = Fe +2 2 1 восстановитель
FeCl 2 + 2NaOH = 2NaCl + Fe(OH) 2 ↓
Осадок приобретает бурый цвет.
2Н +1 + 2е = Н 2 0 2 1 окислитель
Fe 2+ +2Сl - +2Na + +2ОH - = 2Na + +2Сl - + Fe(OH) 2 ↓
На воздухе гидроксид железа (II) превращается в гидроксид железа(III).
Хлорид железа (II) можно получить в результате реакции замещения , при действии соляной кислоты на порошок железа.
Fe 2+ + 2ОH - = Fe(ОH) 2 ↓
4Fe(OH) 2 + 2Н 2 О + О 2 = 4Fe(OH) 3

- Помните! Какие реакции называются качественными?
- Вам могут помочь в выполнении заданий таблицы: таблица растворимости и
- таблица, показывающая качественные реакции на катионы и анионы.
СаСI 2
Задание 2 ( 8 минут) Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.
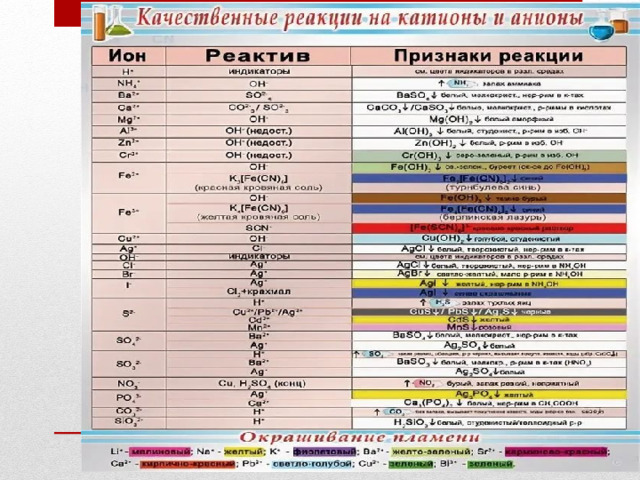

СаСI 2

Определение ионов кальция

Качественная реакция на хлорид - ионы
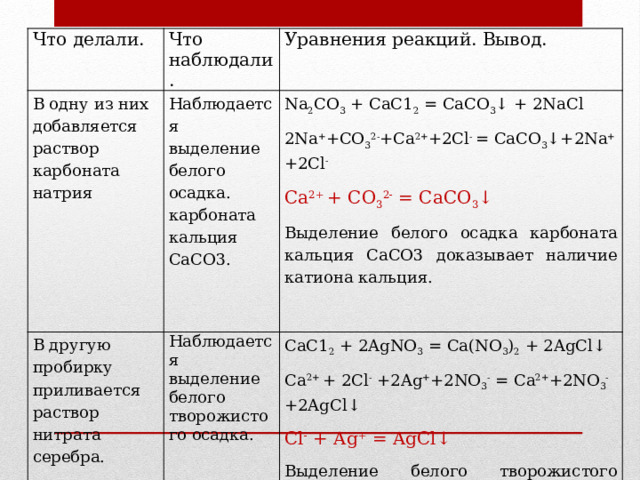
Что делали.
В одну из них добавляется раствор карбоната натрия
Что наблюдали.
Уравнения реакций. Вывод.
Наблюдается выделение белого осадка. карбоната кальция СаСО3.
В другую пробирку приливается раствор нитрата серебра.
Na 2 CО 3 + СаС1 2 = CaCО 3 ↓ + 2NaCl
Наблюдается выделение белого творожистого осадка.
2Na + +СО 3 2- +Са 2+ +2Сl - = СаСО 3 ↓+2Na + +2Сl -
СаС1 2 + 2AgNО 3 = Ca(NО 3 ) 2 + 2AgCl↓
Са 2+ + СО 3 2- = CaCО 3 ↓
Са 2+ + 2Сl - +2Ag + +2NО 3 - = Ca 2+ +2NО 3 - +2AgCl↓
Выделение белого осадка карбоната кальция СаСО3 доказывает наличие катиона кальция.
Сl - + Ag + = AgCl↓
Выделение белого творожистого осадка – это качественная реакция на хлорид-анион .

Задание 3 (8 минут) Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в молекулярной и ионной формах, а реакции замещения рассмотрите с точки зрения окисления-восстановления.
Чтобы осуществить эти превращения надо знать химические свойства веществ.
Помните!
Что соли получаются соли:
- при взаимодействии металла с неметаллом;
- оксида металла с кислотой,;
- основания с кислотой;
- соли с кислотой;
- основания с солью ;
- соли с металлом).
Проделайте соответствующие заданию реакции. Каждый способ получения должен проходить в одну стадию. При необходимости воспользуйтесь нагреванием. Твердые вещества берите в небольших количествах.

Взаимодействие серной кислоты с железом

Взаимодействие сульфата меди с железом

Получение гидроксида железа II и изучение его свойств

Что делали.
1 . В пробирку с железными опилками приливается разбавленный раствор H 2 SО 4
Что наблюдали.
Уравнения реакций. Вывод.
Наблюдается растворение железа, окрашивание раствора и выделение водорода.
2 . В пробирку с раствором медного купороса добавляется железо.
Fe° + H 2 +1 S0 4 =Fe +2 S0 4 + H 2 °↑
3 . В пробирку с гидроксидом железа добавляется H 2 SО 4 .
Наблюдается изменение окраски, из голубого раствор становится светло-зеленым. Порошок становится красным.
Fe 0 - 2е = Fe +2 2 1 восстановитель
Происходит изменение окраски раствора – становится слегка зеленоватым.
- Cu +2 SO 4 + Fe 0 = Fe +2 SO 4 + Cu 0
- Fe 0 - 2е = Fe +2 восстановитель
- Cu +2 +2е = Cu 0 окислитель
- В результате реакции образуется сульфат железа и медь.
2Н +1 +2е = Н 2 0 2 1 окислитель
- Fe(ОН) 2 + H 2 SО 4 = FeSО 4 + H 2 О
- В результате реакции образуется сульфат железа.
- Возможен вариант получения сульфата железа(II) действием на карбонат железа(II) серной кислоты.
В результате реакции образуется сульфат железа.

- Оформить в чистой тетради практические работы, стр.125 задания 2,3,4
Домашнее задание

- Форма отчета о проделанном опыте.
- 1.Название опыта, номер заданиями.
- 2. Цель опыта.
- 3. Порядок выполнения.
- 4. Результаты наблюдений.
- 5. Уравнения реакций .
- 6. Выводы.
Приложения:

- Экспериментальная задача. В математике действует правило — «от перемены мест слагаемых сумма не изменяется». Справедливо ли оно для химии? Проверьте это на примере следующего опыта. Получите гидроксид алюминия по реакции обмена. Для этого вы можете использовать реакцию, уравнение которой AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
- Проведите эту реакцию в двух вариантах, используя в каждом варианте одинаковые объемы исходных веществ: сначала к раствору одного из исходных веществ (реагенту) прибавляйте по каплям раствор другого реагента, затем поменяйте последовательность введения в реакцию реагентов. Наблюдайте, в каком случае выпадет осадок, а в каком — нет. Объясните результаты и запишите уравнения проведенных реакций в молекулярной форме.

- План эксперимента.
- 1.Взять две одинаковые пробирки.
- 2. В первую пробирку налить раствор хлорида алюминия.
- 3. Во вторую пробирку налить такой же объем гидроксида натрия.
- 4. В первую пробирку добавить несколько капель гидроксида натрия.
- 5. Во вторую пробирку добавить столько же капель хлорида алюминия.
- 6. Наблюдать, какие изменения произойдут в пробирках.
- 7. Найти объяснения изменениям и оформить результаты наблюдений.)

- В пробирку с раствором хлорида алюминия добавляют по каплям раствор щелочи:
- А1С13 + 3NaOH(недостаток) = 3NaCl + Al(OH)3↓
- Наблюдают образование белого осадка гидроксида алюминия. Если же добавить еще гидроксид натрия, то образовавшийся гидроксид алюминия провзаимодействует с ним с образованием алюмината натрия и осадок растворится.
- В другую пробирку с раствором щелочи добавляют раствор хлорида алюминия. В данном случае, щелочь присутствует в избытке, поэтому А1(ОН)3 вначале не образуется, идет образование алюмината натрия:
- А1С13 + 4NaOH (избыток) = NaA1О2 + 3NaCl + 2Н2О
- Алюминат натрия растворим, осадка не образуется.
- Отсюда можно сделать вывод, что гидроксид алюминия можно получить только первым способом. Объясняется это амфотерными свойствами гидроксида алюминия.
Описание опыта:

- 4. Заключительная часть (3минуты)
- Учитель : ( предлагает сдать тетради, напоминает, как будет оцениваться работа) . Оценка за работу будет выставляться с учетом правильности выполнения практической части работы и отчетов по ее выполнению.
- ( дается краткая информация по результатам наблюдений за действиями учащихся, указываются ошибки, собираются тетради, учащиеся убирают рабочее место, сдают халаты) .
Описание опыта:

https :// youtu.be/XL8HZPv3xbo
https :// youtu.be/hLBSwoHS23s
https:// youtu.be/mFEDx-agDZo
https :// youtu.be/1k5HFUWmaik
https://youtu.be/Zbupp_8IDcM
https:// youtu.be/hLBSwoHS23s
Учебник химии Габиелян О.С. 9 класс.Просвещение Дрофа.
Литература и интернет ресурсы:






















































