Просмотр содержимого документа
«Презентация "Химический элемент "Сера"" к уроку химии, 9 класс.»

Химический элемент «Сера»
Выполнила учитель химии
Рябова Наталья Валерьевна
МБОУ «Школа №52»

Содержание:
- История открытия. Происхождение названия
- Строение и свойства атомов
- Нахождение серы в природе
- Биологическая роль
- Источники поступления серы в организм
- Физические свойства
- Аллотропные модификации серы
- Химические свойства
- Применение серы
- Важнейшие соединения
- Информационные ресурсы

«В древней магии присутствую при рождении огня, называют серой издавна меня»

История открытия. Происхождение названия
- Сера использовалась до Рождества Христова, а значит известна человеку с древнейших времен. Свойства серы древние ученые считали "принципом горючести" и как составную часть различных руд. Еще Теофил (около XI в.) описал обжиг медной руды. А у арабских алхимиков сера считалась обязательной частью всех металлов. Элементарная природа серы была установлена Лавуазье при проведении опытов по сжиганию серы.
- Русское название элемента обычно производят от санскритского «сира» — светло-желтый.
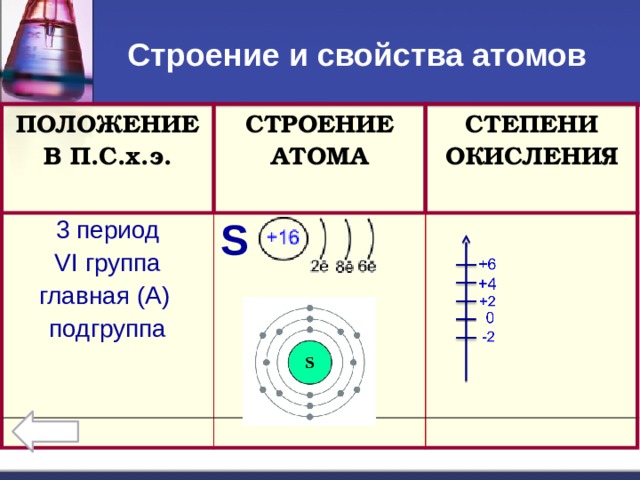
Строение и свойства атомов
ПОЛОЖЕНИЕ В П.С.х.э.
СТРОЕНИЕ АТОМА
3 период
S
СТЕПЕНИ ОКИСЛЕНИЯ
VI группа
главная (А)
подгруппа

Нахождение серы в природе
Биологическая роль
Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Источники поступления серы в организм
Источники серы

Физические свойства
- Твёрдое кристаллическое вещество желтого цвета, без запаха.
- Как и все неметаллы плохо проводит теплоту и не проводит электрический ток.
- Сера в природе практически не растворяется.
- Температура плавления 120 0 С.
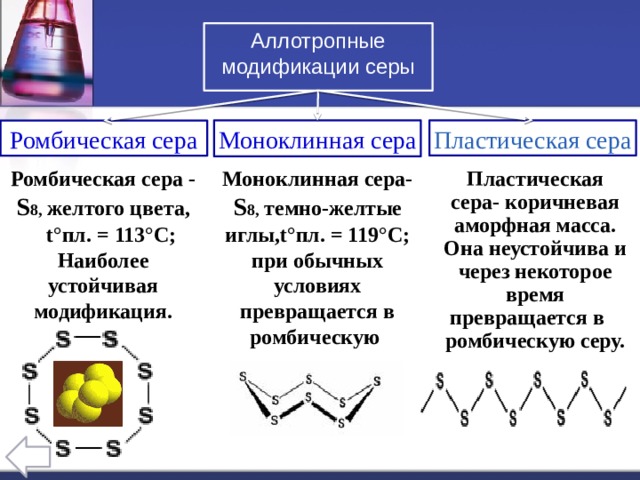
Аллотропные модификации серы
Моноклинная сера
Ромбическая сера
Ромбическая сера - S 8, желтого цвета,
Моноклинная сера- S 8, темно-желтые иглы,t°пл. = 119°C; при обычных условиях превращается в ромбическую
Пластическая сера- коричневая аморфная масса.
Она неустойчива и через некоторое время превращается в ромбическую серу.
t°пл. = 113°C; Наиболее устойчивая модификация.

Химические свойства
Особенностью серы является взаимодействие с простыми веществами
Сера реагирует:
- с металлами, образуя сульфиды
Hg + S → HgS
- с неметаллами (водородом, кислородом, фтором…)
- H 2 + S → H 2 S сероводород
2) S + O 2 → SO 2 оксид серы IV

Серу применяют
В медицине
Содержится в красителях
В производстве
серной кислоты
В производстве резины
В сельском хозяйстве
В производстве
взрывчатых
веществ

Важнейшие соединения
Соединения Серы
оксиды серы
серная кислота
SO 2 - газ Применение: 1. используется для производства серной кислоты 2. в качестве консерванта 3. используется для отбеливания соломы, шелка и шерсти.
SO 3 - твёрдое вещество Применение: 1. используют в основном в производстве серной кислоты
H 2 SO 4 - кислота Применение: 1. в производстве минеральных удобрений 2. для получения различных минеральных кислот и солей 3. в нефтяной промышленности Рис. 1 Доля расхода серной кислоты
Информационные ресурсы
- http:// school-collection.edu.ru
- http://ru.wikipedia.org/wiki/% D1%E5%F0%E0
- http:// blackmineral.hut1.ru/Minerals_9.html





































