Просмотр содержимого документа
«Презентация на тему: "Электролитическая диссоциация"»

Электролитическая диссоциация
Первая половина XIX века М. Фарадей
Вещества
Электролиты
Неэлектролиты
(вещества, водные растворы которых
(вещества, водные растворы которых
проводят электрический ток)
не проводят электрический ток

С. Арениус, 1887 г. Теория электролитической диссоциации
- электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
- под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы - к аноду (положительному электроду);
- электролитическая диссоциация является обратимым процессом - параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.

1891 г. И. Каблуков
- внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом)

Химическая теория растворов Д.И. Менделеева
- Химическое взаимодействие растворенного вещества с водой. Образование гидратов.
- Диссоциация на ионы
- Образование гидратированных ионов (связанных с водой)
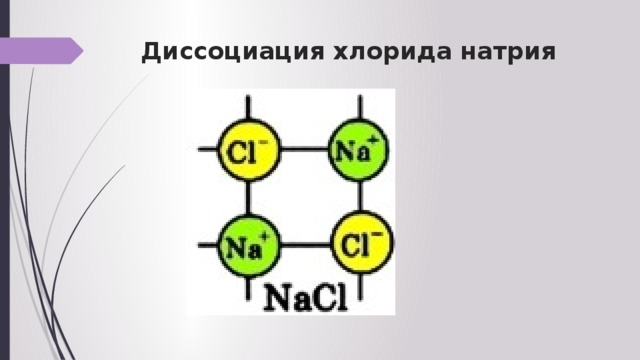
Диссоциация хлорида натрия
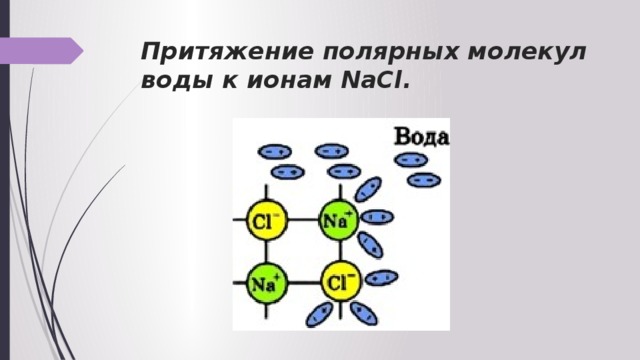
Притяжение полярных молекул воды к ионам NaCl.
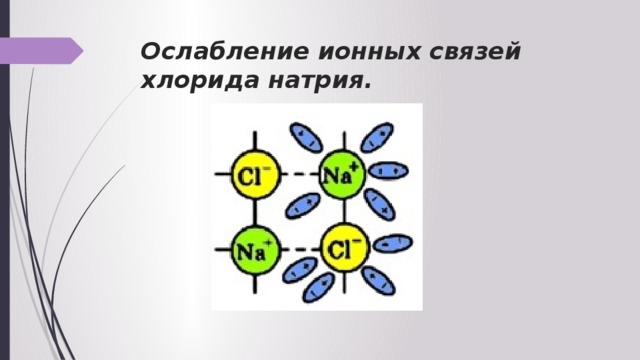
Ослабление ионных связей хлорида натрия.
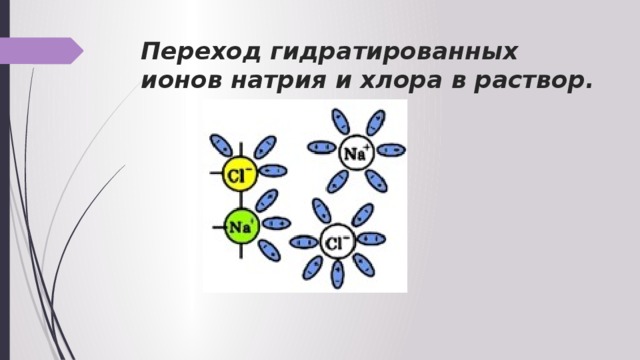
Переход гидратированных ионов натрия и хлора в раствор.
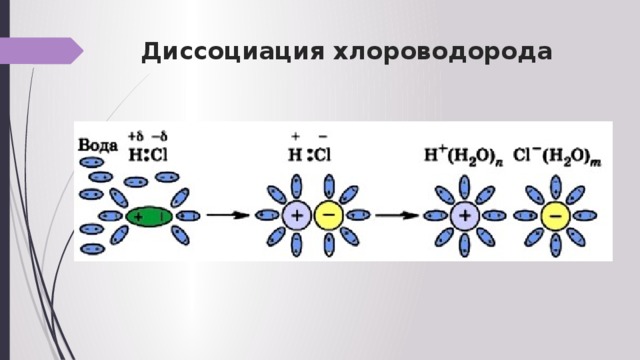
Диссоциация хлороводорода

Различия свойств гидратированных и негидратированных ионов
Элемент
Гидратированные
медь
Негидратированные
синяя окраска
натрий
-
Бесцветны
хлор
Взаимодействует с водой (атомы)
Бесцветны, без запаха
Желто-зеленая окраска, удушливый запах

Количественная характеристика диссоциации
- Степень электролитической диссоциации – это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул
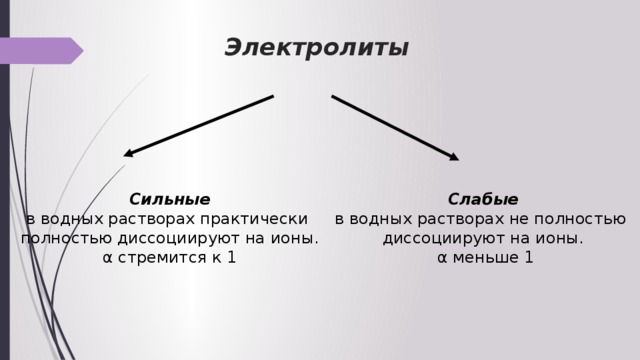
Электролиты
Сильные
Слабые
в водных растворах практически
в водных растворах не полностью
полностью диссоциируют на ионы.
диссоциируют на ионы.
α стремится к 1
α меньше 1

Константа диссоциации
- Константа равновесия, характеризующая процесс диссоциации слабого электролита

Диссоциация электролитов

Домашнее задание
- Параграф 15,
- с.163 № 3, 4
- с.163 №5 необязательное*








































