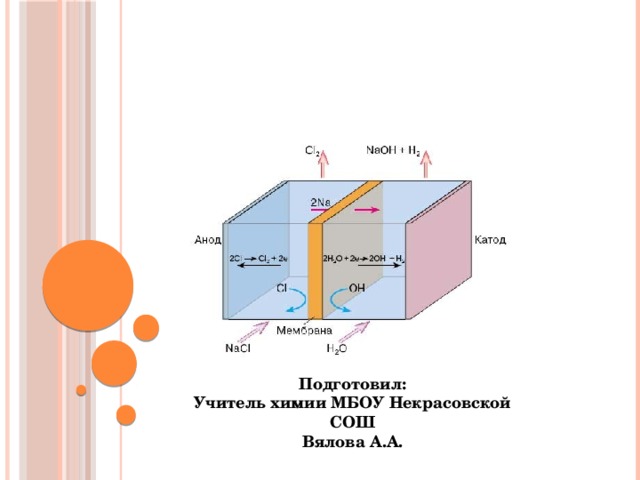
Электролиз расплавов и растворов
Подготовил:
Учитель химии МБОУ Некрасовской СОШ
Вялова А.А.
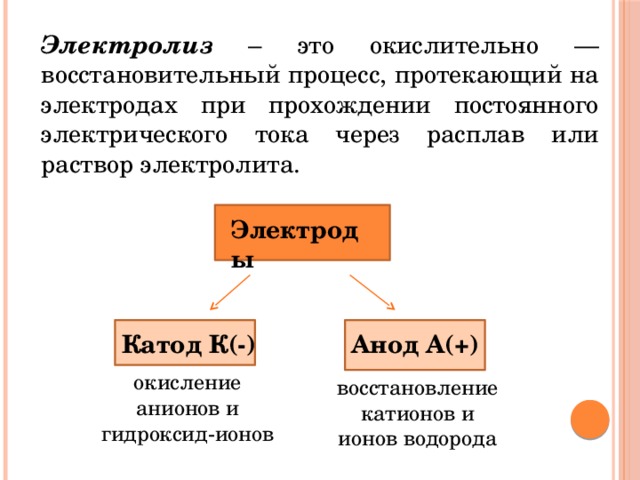
Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Электроды
Катод К(-)
Анод А(+)
окисление анионов и гидроксид-ионов
восстановление катионов и
ионов водорода
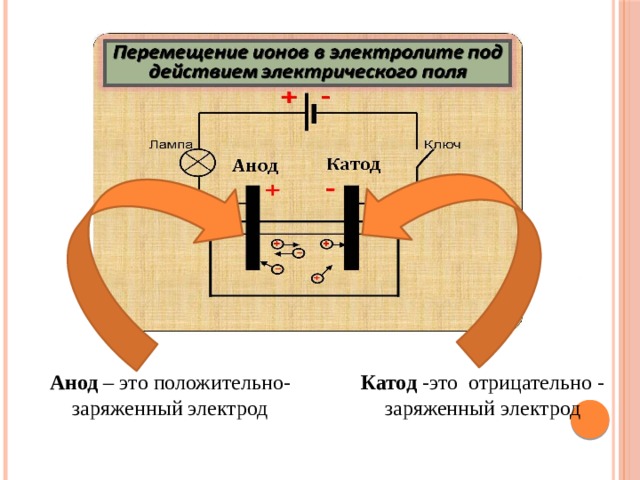
Катод -это отрицательно - заряженный электрод
Анод – это положительно- заряженный электрод
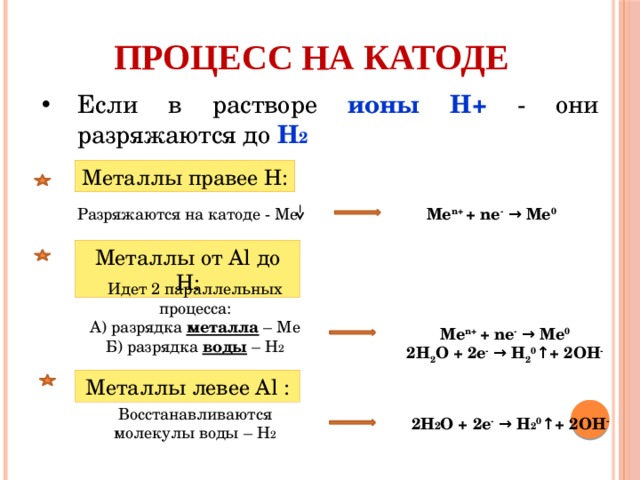
Процесс на катоде
- Если в растворе ионы Н+ - они разряжаются до Н 2
Металлы правее Н:
Разряжаются на катоде - Ме
Me n+ + ne - → Me 0
Металлы от Al до Н:
Идет 2 параллельных процесса:
А) разрядка металла – Мe
Б) разрядка воды – Н 2
Me n+ + ne - → Me 0
2H 2 O + 2e - → H 2 0 ↑+ 2OH -
Металлы левее Al :
Восстанавливаются молекулы воды – Н 2
2H 2 O + 2e - → H 2 0 ↑+ 2OH -

Процесс на аноде
если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона;
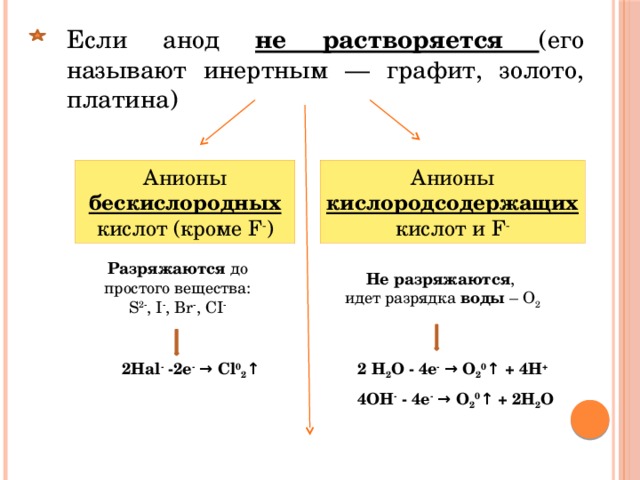
Если анод не растворяется (его называют инертным — графит, золото, платина)
Анионы бескислородных кислот (кроме F - )
Анионы кислородсодержащих кислот и F -
Разряжаются до простого вещества: S 2- , I - , Br - , СI -
Не разряжаются ,
идет разрядка воды – О 2
2 H 2 O - 4e - → О 2 0 ↑ + 4H +
2Hal - -2e - → Cl 0 2 ↑
4ОН - - 4e - → О 2 0 ↑ + 2Н 2 О
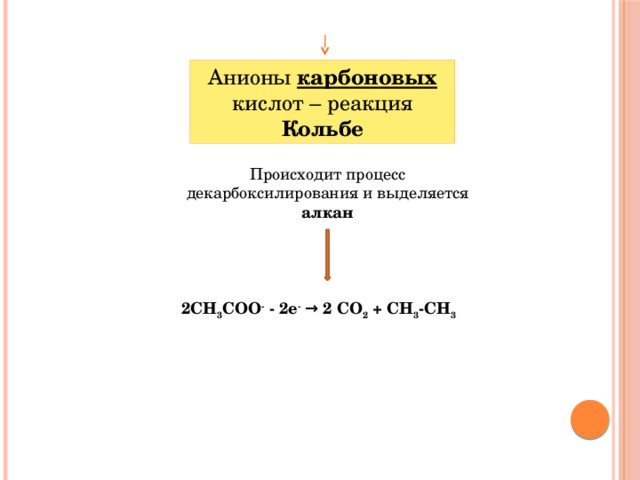
Анионы карбоновых кислот – реакция Кольбе
Происходит процесс декарбоксилирования и выделяется алкан
2СН 3 СОО - - 2е - → 2 СО 2 + СН 3 -СН 3

1. Анод нерастворимый (например, графитовый)
Пример №1.
Суммарное уравнение :
Учитывая присутствие ионов Na в растворе:

Пример №2.
Суммарное ионное уравнение:
Суммарное молекулярное уравнение :

2. Анод растворимый (например, медный)
Если анод растворимый, то металл анода будет окисляться:
Катионы Cu 2+ в ряду напряжений стоят после (Н + ), поэтому они и будут восстанавливаться на катоде.

Задания на электролиз
Проверь себя…

Задание 1
Установите соответствие между формулой соли и продуктом,
образующимся на катоде при электролизе её водного раствора:
к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется:
ФОРМУЛА СОЛИ
А) CuCl 2
Б) AgNO 3
ПРОДУКТ НА КАТОДЕ
1) водород
В) K 2 S
Г) NaBr
2) кислород
3) металл
4) галоген
5) сера
6) азот
1) хлор
2) литий
3) кислород
4) водород
Ответ: 3311

Задание 2
Установите соответствие между формулой соли и продуктом,
который образуется на инертном аноде в результате электролиза
её водного раствора: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой .
При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется:
ФОРМУЛА СОЛИ
A) Na 2 SO 4
ПРОДУКТ НА АНОДЕ
Б) Ca(NO 3 ) 2
B) ZnBr 2
1) SO 2
Г) CuCl 2
2) O 2
3) NO 2
4) Br 2
5) Cl 2
6) H 2
1) хлор
2) литий
3) кислород
Ответ: 2245
4) водород

Задание 3
Установите соответствие между формулой соли и продуктом,
образующимся на катоде при электролизе её водного раствора:
к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) RbCl
Б) K 2 CO 3
ПРОДУКТ НА КАТОДЕ
В) BaBr 2
1) хлороводород
Г) Cu(NO 3 ) 2
2) оксид азота(IV)
3) кислород
4) хлор
5) бром
6) углекислый газ
Ответ: 4353

Задание 4
Установите соответствие между формулой соли и продуктом,
образующимся на катоде при электролизе её водного раствора:
к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
Ca(NO 3 ) 2
CuSO 4
ФОРМУЛА СОЛИ
А)
Б)
ПРОДУКТ НА КАТОДЕ
1) серебро
В) Al 2 (SO 4 ) 3
2) алюминий
Г) AgNO 3
3) медь
4) кальций
5) водород
6) кислород
Ответ: 5351
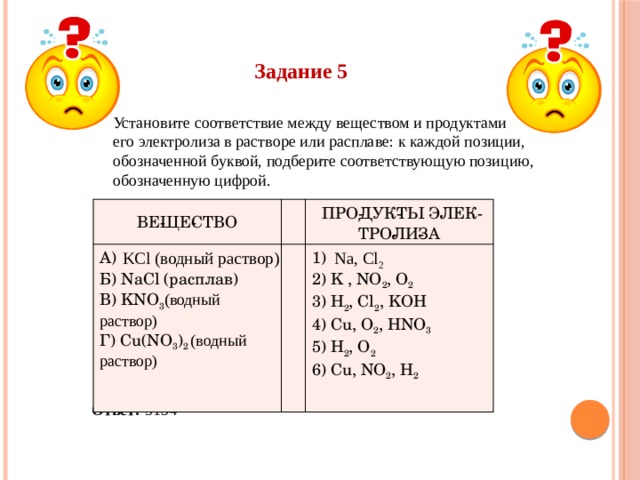
Задание 5
Установите соответствие между веществом и продуктами
его электролиза в растворе или расплаве: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
KCl (водный раствор) Na, Cl 2
ВЕЩЕСТВО
А)
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
Б) NaCl (расплав)
В) KNO 3 (водный раствор)
1)
2) K , NO 2 , O 2
Г) Cu(NO 3 ) 2 (водный раствор)
3) H 2 , Cl 2 , KOH
4) Cu, O 2 , HNO 3
5) H 2 , O 2
6) Cu, NO 2 , H 2
Ответ: 3154

Задание 6
Вычислите объём в литрах газа, выделяющегося на аноде при электролизе водного раствора гидроксида кальция с инертными электродами, если на катоде выделился газ объемом 67,2 л (при н.у.).
1) 16,8; 2) 11,2; 3) 33,6; 4) 5,6.
Решение:
Электролиз водного раствора гидроксида кальция с инертными электродами:
Катодный процесс К(-) будет: 2Н + + 2е — → Н 2 ;
Анодный процесс A(+) будет: 2H 2 O — 4 е — → O 2 + 4Н + ;
Процесс электролиза сводится к разложению воды:
2H 2 O(электролиз) → 2H 2 ↑ + O 2 ↑.
n(H 2 ) = 67,2/22,4 = 3 моль;
n(O 2 ) = n(H 2 )/2 = 3/2 = 1,5 моль;
V(O 2 ) = 22,4 ⃰1,5 = 33,6 л.

Задание 7
Какая масса (в граммах) гидроксида лития образуется в растворе при электролизе водного раствора хлорида лития с инертными электродами с инертными электродами, если на аноде выделяется 10,08 л газа (н.у.)?
1) 24; 2) 46; 3) 19; 4) 21,6.
Решение:
Электролиз водного раствора хлорида лития с инертными электродами:
Катодный процесс К(-) будет: 2Н + + 2е — → Н 2 ;
Анодный процесс A(+) будет: 2Cl — — 2е — → Cl 2 ;
Cуммарный процесс электролиза:
2LiCl + 2H 2 O (электролиз) → H 2 ↑ + Cl 2 ↑ + 2LiOH.
n(Cl 2 ) = 10,08/22,4 = 0,45 моль;
n(LiOH) = 2n(Cl 2 ) = 0,45 ⃰0,45 = 0,9 моль;
М(LiOH) = 24 г/моль;
m(LiOH) = 24 ⃰0,9 = 21,6 г.

Задание 8
Какая масса газа выделится на аноде (в граммах) при полном электролизе 320 г 10 %-го водного раствора сульфата меди?
1) 3,2; 2) 12,8; 3) 19,2; 4) 25,6.
Решение:
Электролиз водного раствора сульфата меди с инертными электродами:
Катодный процесс К(-) будет: Cu 2+ + 2е — → Cu;
Анодный процесс A(+) будет: 2H 2 O — 4 е — → O 2 + 4Н + ;
Cуммарный процесс электролиза:
2CuSO 4 + 2H 2 O (электролиз) → 2Cu + O 2 ↑ + 2H 2 SO 4 .
m(CuSO 4 ) = 320 ⃰10/100 = 32 г;
М(CuSO 4 ) = 160 г/моль;
n(CuSO 4 ) = 32/160 = 0,2 моль;
n(O 2 ) = n(CuSO 4 )/2 = 0,1 моль;
М(O 2 ) = 32 г/моль;
m(O 2 ) = 0,1 ⃰32 = 3,2 г.












































