Просмотр содержимого документа
«Презентация по теме "Оксиды"»

Кроссворд
- 1) 78 % воздуха состоят из молекул этого Х.Э.
- 2) Х.Э входящий в состав сплавов, имеющий в ядре атома 28 протонов и 31 нейтронов
- 3) Электронная конфигурация
- 1S 2 2S 2 2p 6 3S 2 3p 4
- 4)Этот Х.Э. cоздаёт защитный слой для покрытия других металлов от коррозии
- 5) Самое распространенное вещество на Земле
- 6) Русское название хим. элемента № 33 As
Ключевое слово:
Бинарное соединение.
1
2
3
4
5
6

Бинарные соединения : ОКСИДЫ

Цели и задачи:
- дать понятие класса «Оксиды»
- научиться называть и классифицировать оксиды,
- познакомиться с представителями класса «Оксиды»,
- определить значение оксидов, их применение
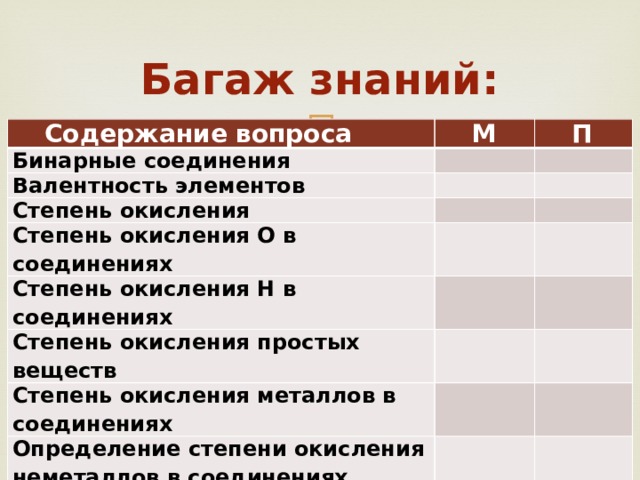
Багаж знаний:
Содержание вопроса
М
Бинарные соединения
П
Валентность элементов
Степень окисления
Степень окисления О в соединениях
Степень окисления Н в соединениях
Степень окисления простых веществ
Степень окисления металлов в соединениях
Определение степени окисления неметаллов в соединениях (алгоритм)

Практические умения
- Р.Т. - с.76 № 1 ( I – 1 и 2;
II – 3 и 4;
III – 5 и 6;
IV – 7 и 8)

Проверим степень окисления:
1) S F 6
3) N 2 O 5
Na 3 N
Li Br
2) Cu Cl 2
4) Mn O 2
P Cl 3
H 2 S
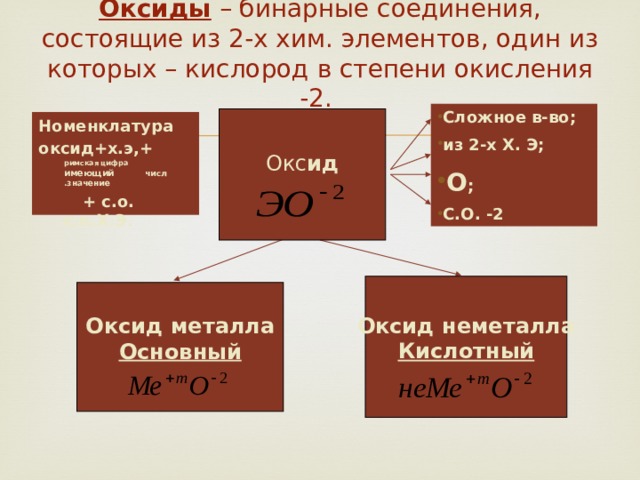
Оксиды – бинарные соединения, состоящие из 2-х хим. элементов, один из которых – кислород в степени окисления -2.
- Сложное в-во;
- из 2-х Х. Э;
- О ;
- С.О. -2
Окс ид
Номенклатура
оксид+х.э,+ римская цифра имеющий числ .значение
+ с.о. с.о.Х.Э .
Оксид неметалла
Кислотный
Оксид металла
Основный

«Жидкие оксиды»

Применение тяжелой воды
- Тяжелая вода – оксид дейтерия D 2 O - применяется в ядерных реакторах для их охлаждения, т.к. является теплоносителем и замедлителем быстрых нейтронов.

«Газообразные оксиды» УГЛЕКИСЛЫЙ ГАЗ

Применение оксидов углерода
Диоксид углерода, углекислый газ (СО 2 ), применяется для тушения огня, ликвидации объёмных пожаров, охлаждения реактивных двигателей.
Монооксид углерода,
угарный газ (СО),
является отравляющим
веществом общядовитого
действия, применяется
как химическое оружие.
Связывая гемоглобин,
лишает кровь возможнос-
ти переносить кислород,
что приводит к смерти от
удушья.

«Твердые оксиды»

Применение оксида кремния
Широко используется в радиотехнике, для создания солнечных батарей, детекторов частиц в приборах радиационного контроля, для производства стекла (бинокли, перископы, дальномеры, оптические прицелы).

Дополнительное задание
- В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу:
- В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу:
** оксид углерода (II)
** оксид серы (IV)
** оксид азота (III)
** оксид азота (IV).

NО
CO
CO 2
NO 2
SO 2
H 2 O
SiO 2
Fe 2 O 3
Al 2 O 3

Остановка «Экспериментальная»
Лабораторная работа
« Знакомство с образцами оксидов.
Получение углекислого газа »
Ход работы:
- Инструктаж по ПТБ.
- Образцы оксидов (заполнение таблицы)
- Получение углекислого газа (эксперимент)

Проверь себя:
- Р.Т. – с.79 № 3 (1 ряд – по названию оксида составить формулу оксида;
2 ряд – по формуле назвать оксид )
- Р.Т. – с.80 № 1 ( 1 ряд – выписать формулы оксидов металлов;
2 ряд – выписать формулы оксидов неметалов)
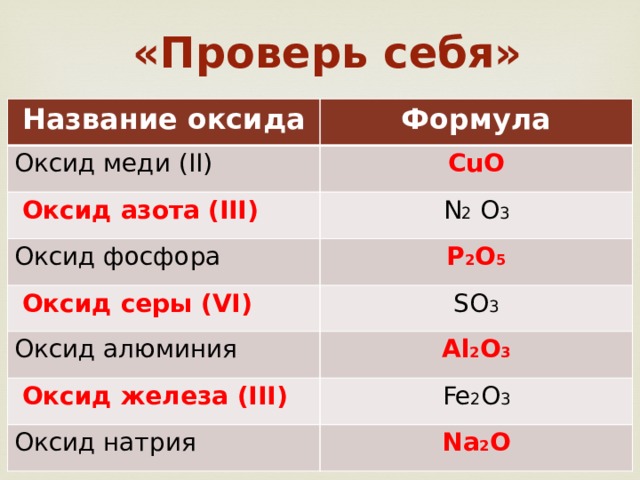
«Проверь себя»
Название оксида
Формула
Оксид меди (II)
CuO
Оксид азота (III)
N 2 O 3
Оксид фосфора
P 2 O 5
Оксид серы (VI)
SO 3
Оксид алюминия
Al 2 O 3
Оксид железа (III)
Fe 2 O 3
Оксид натрия
Na 2 O
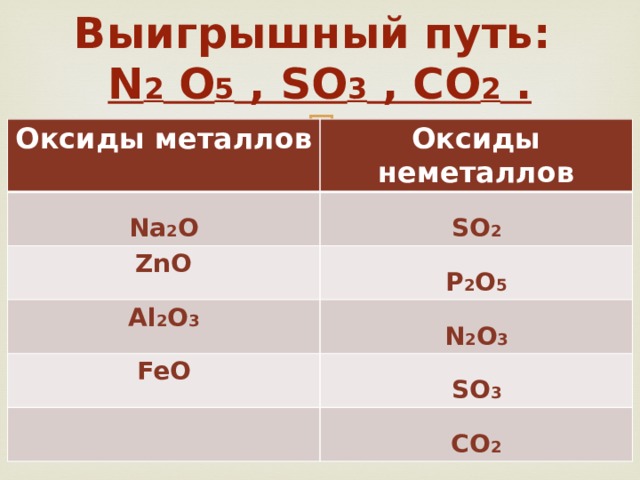
Выигрышный путь: N 2 O 5 , SO 3 , CO 2 .
Оксиды металлов
Оксиды неметаллов
Na 2 O
ZnO
SO 2
Al 2 O 3
P 2 O 5
FeO
N 2 O 3
SO 3
CO 2

Крестики-нолики
Покажите выигрышный путь, который составляют формулы:
а)оксидов
HCl
NaOH
O 2
Al 2 O 3
FeO
CO 2
H 2 O 2
H 2 SO 4
NaBr
в)оксидов неметаллов
б)оксидов металлов
SO 3
Li 2 O
Cl 2 O 7
NO 2
CuO
Fe 2 O 3
NO
SiO
P 2 O 5
CO
BaO
N 2 O 3
K 2 O
CO 2
FeO
ZnO
MgO
H 2 O

Тест
ВОПРОС 1. В земной коре-литосфере находятся:
оксид алюминия
а) Al 2 O 3 b) Al 3 O 2 c) AlО

Вопрос 2. В земной коре-литосфере находятся :
Оксид кремния (IV)
a) SiO; b) Si 2 O; c) SiO 2

Вопрос 3. В земной коре-литосфере находятся:
Оксид железа(III):
a) FeO; b) Fe 2 O 3 ; c) Fe 3 O 2

Вопрос 4
Водная оболочка Земли - гидросфера-это оксид водорода:
a) H 2 O ; b) H 2 O 2 ; c) OH

Вопрос 5
- В воздухе есть оксид углерода(IV)
a) CO; b) CO 2 ; c) CO 4

Домашнее задание
*** §19 (читать)
*** Р.Т. с.80 № 2, с.81 № 3, 4.
*** Творческое задание – приготовить сообщение «Оксиды и военно-морское дело»

Итоги занятия:
Цели и задачи:
- дать понятие класса «Оксиды»
- научиться называть и классифицировать оксиды,
- познакомиться с представителями класса «Оксиды»,
- определить значение оксидов, их применение




















































