
Кичиханова Эльнара Исламовна
Учитель физики МБОУ «Бутовская СОШ № 1»







Уравнение состояния идеального газа

Цели урока:
- познакомиться с уравнением состояния идеального газа;
- записать это уравнение в классическом виде;
- рассмотреть следствия, вытекающие из уравнения состояния идеального газа;
- научиться использовать полученные уравнения при решении задач.

Модель «Идеальный газ»
1. В любом макроскопическом объеме газа число молекул очень велико.
2. Размеры молекул пренебрежительно малы по сравнению с расстояниями между ними.
3. Между молекулами существуют силы взаимодействия- силы притяжения и силы отталкивания.
4. Все соударения молекул являются абсолютно упругими.
5. Молекулы взаимодействуют друг с другом или со стенкой сосуда только в момент соударения.
6. Значительная средняя потенциальная энергия взаимодействия препятствует изменению среднего расстояния между ними.
7. Молекулы находятся в непрерывном хаотическом движении.
8. К движению отдельной молекулы применимы законы механики Ньютона.
9. Частицы колеблются около положений равновесия, взаимодействуя с ближайшими соседями.

В о с с т а н о в и
формулу

Проверьте знание формул!
1
2
3
4
5
1. Число частиц в любом теле
2. Зависимость внутренней энергии идеального газа от температуры
3. Средняя кинетическая энергия поступательного движения одной частицы
4. Тепловая скорость движения молекулы
5. Средняя кинетическая энергия молекулы с массой m 0

Уравнение состояния вещества
Уравнение, выражающее связь между макроскопическими параметрами состояния вещества (p,V и Т), называется уравнением состояния этого вещества.

Уравнение состояния
идеального газа

Универсальная газовая
постоянная - R
N A k = R
R=8,31 Дж / (моль·К)
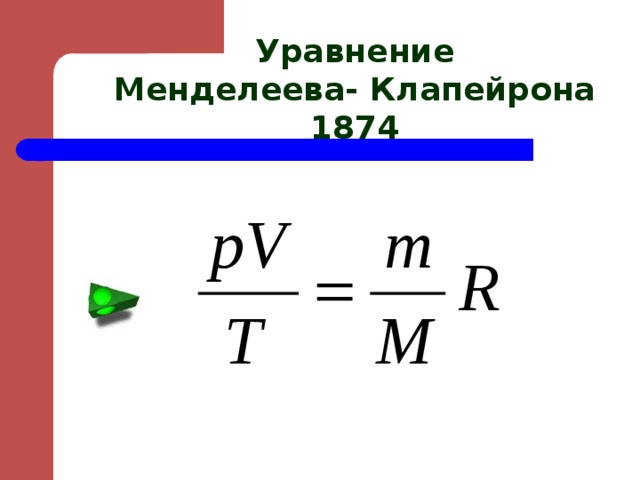
Уравнение
Менделеева- Клапейрона
1874

Дмитрий Иванович Менделеев (1834 – 1907)
Крупнейший химик мира, физик, педагог

Закон Авогадро 1811
При одинаковых
температурах и давлениях в равных объемах любых идеальных газов
содержится
одинаковое число молекул.

Закон Дальтона 1801
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
p = p 1 + … + p n
Парциальным называют давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.

Объединенный газовый закон 1824
Отношение произведения давления и объема идеального газа к его абсолютной температуре есть величина постоянная для данной массы данного газа.
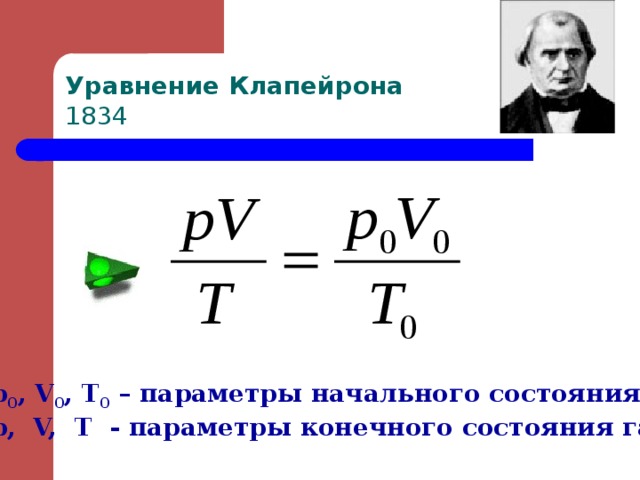
Уравнение Клапейрона 1834
p 0 , V 0 , T 0 – параметры начального состояния газа,
p, V, T - параметры конечного состояния газа

Во всем мне хочется дойти до самой сути…

Обратите внимание:
- Уравнение Менделеева - Клапейрона связывает между собой 5 физических величин, характеризующих состояние газа, - p, V, T, m, M – и позволяет по заданным четырем найти пятую величину.
- Уравнение Менделеева - Клапейрона и все его следствия с большой точностью можно применить к газам, находящимся в условиях, близких к нормальным (t = 0 0 C, p = 1,013 . 10 5 Па), а также к разреженным газам.
- Если плотность газа велика, а следовательно, взаимодействием молекул пренебречь нельзя, то модель идеального газа оказывается непригодной.
- Проверьте, все ли величины выражены в СИ:
(1 л = 10 -3 м 3 ; 1 мм рт. ст. = 133 Па;
0 0 С = 273 К; нормальное атмосферное давление:
1,013 . 10 5 Па).

Р е ш и т ь з а д а ч у:
Сколько гелия потребуется для наполнения воздушного шара емкостью 500 м 3 при нормальном атмосферном давлении и температуре 300 К ?

Д а н о: Р е ш е н и е.
V = 500 м 3
p = 10 5 Па
Т = 300 К
М = 4 . 10 -3 Дж/(моль . К)
m - ?
83 кг
Ответ: m = 83 кг

Р е ш и т ь з а д а ч у:
Какова плотность
сжатого воздуха при 0 0 С в камере шины автомобиля «Волга»? Давление 0,17 МПа.

Р е ш е н и е
Р е ш е н и е з а д а ч и:
, где
2,17 кг/м 3

Домашнее задание:
- § 68
- Ответить на вопросы § 68
- (на вопрос 2 – письменно)
- Упр. 13 (5) ,
- +Упр. 13 (6).
























































