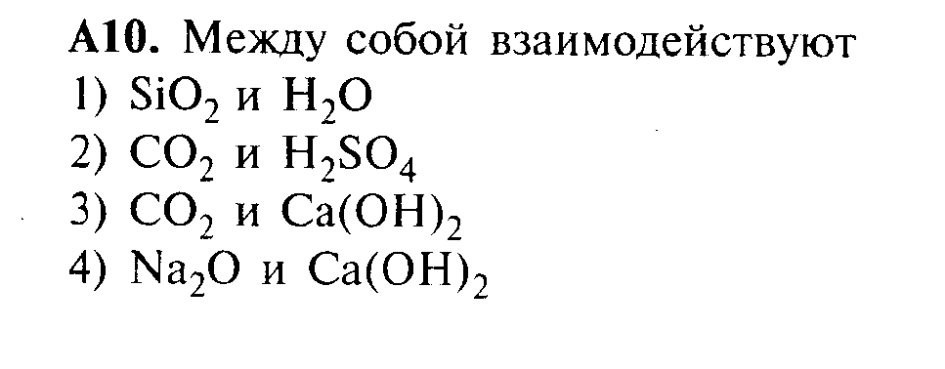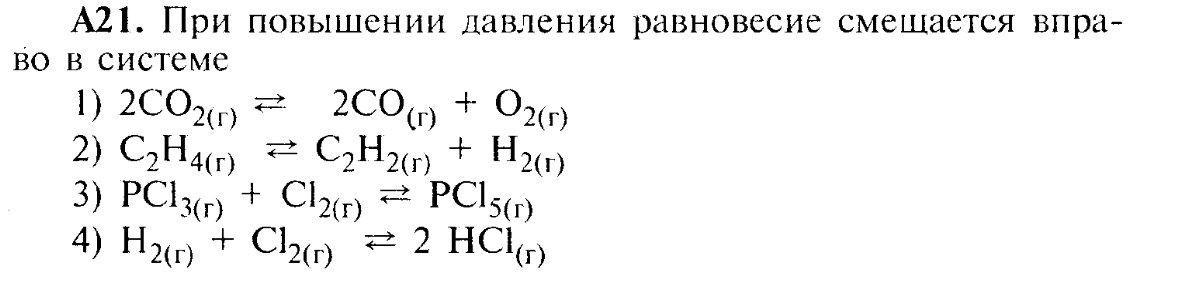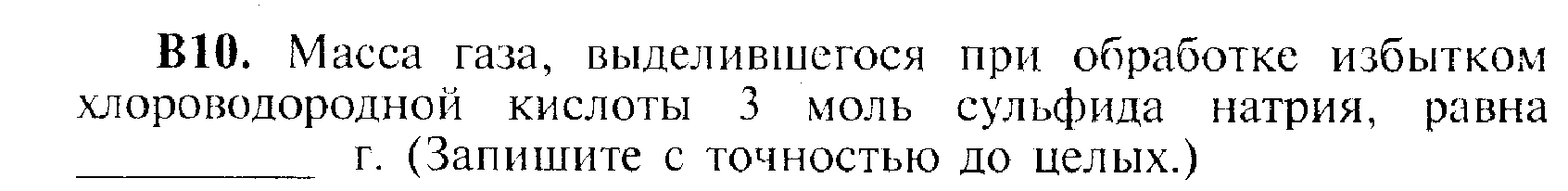УЧЕБНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
по ___________химии______________
предмет
Класс _______11________
Учитель ___Соловьева_Гулия_Хамзовна____
Количество часов:
Всего _34_ час.; в неделю __1__ час.
Плановых контрольных уроков _4_, практических работ_3_ ;
Планирование составлено на основе __ Программы курса химии для 8-11 классов общеобразовательных учреждений, Допущено Министерством образования и науки Российской Федерации, 5-е издание, стереотипное Дрофа, Москва-2008 г.___
Учебник__Учебник «Химия. 11 класс. Учебник для общеобр. учреждений» // Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, 2008__
Дополнительная литература
Хомченко И. Г. Сборник задач и упражнений по химии для средней школы.-2-е изд., испр. и доп.-М.:РИА « Новая волна»: Издатель Умеренков, 2014.-214с.
Варавва Н.Э. Химия в схемах и таблицах/ Н.Э. Варавва.-М.:Эксмо,2013.-208с.-(Наглядно и доступно)
Грибанова О.В. Общая и неорганическая химия: опорные конспекты, контрольные и тестовые задания/ О.В.Грибанова.-Ростов н-Д: Феникс, 2014.-189,[1]с.-(Абитуриент).
Егоров А.С. Химия: современный курс для подготовки к ЕГЭ / А.С.Егоров.- Изд.13-е. Ростов н/Д: Феникс, 2013.-699с.-(Абитуриент).
Радецкий, А. М. Дидактический материал химия 10-11 / А. М. Радецкий // М.: просвещение, 2011.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа по химии составлена на основе:
Федеральный закон «Об образовании в Российской Федерации» от 29.12.2012г. № 273-ФЗ.
Закона Республики Татарстан от 22.07.2013 № 68-ЗРТ «Об образовании»;
Приказ Министерства образования и науки РФ от 19.12.2012г. № 1067 «Об утверждении федеральных перечней учебников, рекомендованных (допущенных) к использованию в образовательном процессе в образовательных учреждениях, реализующих образовательные программы общего образования и имеющих государственную аккредитацию на 2013/2014 учебный год»;
Приказ Министерства образования и науки РФ от 31.03.2014г. № 253 «Об утверждении федеральных перечней учебников, рекомендованных (допущенных) к использованию в образовательном процессе в образовательных учреждениях, реализующих образовательные программы общего образования и имеющих государственную аккредитацию»;
Устава МБОУ «Школа №71»;
Учебного плана МБОУ «Школа №71» на текущий учебный год с учётом регионального компонента;
Основной образовательной программы среднего (полного) общего образования МБОУ «Школа №71»;
Положения о порядке разработки рабочей программы по учебному предмету в соответствии ГОС.
Программа по химии составлена на основе федерального компонента государственного стандарта среднего (полного) общего образования на базовом уровне. Программа конкретизирует содержание предметных тем образовательного стандарта, дает распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов учебного предмета с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся.
Программа разработана на основе примерной программы по химии среднего (полного) общего образования (базовый уровень)и авторской программы Г.Е.Рудзитиса и Ф.Г.Фельдмана«Программа курса химии для 8 – 11 классов общеобразовательных учреждений», допущенной Департаментом общего среднего образования Министерства образования Российской Федерации к учебнику авторов Г.Е.Рудзитиса и Ф.Г.Фельдмана «Химия 10 класс»
Учебный предмет изучается в 11 классе и рассчитан на 34 часа. В случае совпадений учебных занятий с праздничными и выходными днями допускается интеграция и уплотнение материала.
Для реализации программы имеется учебно-методическая и справочная литература, учебники, электронные учебные пособия и энциклопедии, раздаточный материал для проведения контрольных и самостоятельных работ, комплект плакатов, УМК под редакцией Г.Е. Рудзитиса.
Изучение химии на базовом уровне среднего (полного) общего образования направлено на достижение следующих целей:
- освоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятиях, законах и теориях;
- овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
- развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
- воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
В системе естественнонаучного образования химия как учебный предмет занимает важное место в познании законов природы, формировании научной картины мира, создании основы химических знаний, необходимых для повседневной жизни, навыков здорового и безопасного для человека и окружающей его среды образа жизни, а также в воспитании экологической культуры.
При оформлении рабочейпрограммыбыли использованы следующие условные обозначения:
УИНЗ – урок изучения новых знаний
УЗЗ – урок закрепления знаний
КУ – комбинированный урок
УОИСЗ – урок обобщения и систематизации знаний
УК – урок контроля
Содержание программы
Повторение основных вопросов курса химии 10 класса (3 часа)
Классификация и химические свойства органических соединений. Решение задач на нахождение массовой доли, количества вещества.
Важнейшие химические понятия и законы (1 час)
Химический элемент. Изотопы. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях, закон постоянства состава.
Периодический закон и периодическая система химических элементов Д. И. Менделеева с точки зрения учения о строении атомов(1 час)
Особенности размещения электронов в атомах малых и больших периодов. s-, p-, d-, f- электроны. Положение в периодической системе водорода, лантаноидов, актиноидов и искусственно полученных элементов. Валентность и валентные возможности атомов.
Строение вещества (5 часов)
Основные виды химической связи. Пространственное строение молекул неорганических и органических веществ. Типы кристаллических решеток и свойства веществ. Причины многообразия веществ. Дисперсные системы.
Демонстрации: таблицы, модели «Химическая связь» и«Строение неорганическихвеществ», модели кристаллическихрешеток.
Химические реакции (11 часов)
Классификация химических реакций. Скорость химических реакций. Катализ. Химическое равновесие и условия его смещения. Общие представления о промышленных способах получения химических веществ. Производство серной кислоты контактным способом. Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. Степень и константа диссоциации. Реакции ионного обмена. Гидролиз органических и неорганических соединений.
Демонстрации: реакции экзо- и эндотермические;к/фильм «Химические реакции неорганических веществ», влияние на скорость химической реакции: а)концентрации, б) поверхности их соприкосновения, в) температуры; г) катализатора. Влияние температуры на смещение химического равновесия при окислении оксида азота (П) в оксид азота (IV) кислородом. Каталитическое разложение пероксида водорода в присутствии ионов меди или каталазы. Электропроводность твёрдых, жидких веществ, растворов с различными видами связи, химических реакций гидролиза солей разных типов.
Металлы (6 часов)
Общие способыполучения металлов. Электролиз. Коррозия металлов и ее предупреждение. Обзор металлических элементов А-групп. Общий обзор металлических элементов Б-групп. Медь. Цинк. Титан. Хром. Железо, никель, платина. Сплавы металлов. Оксиды и гидроксиды металлов.
Демонстрации: образцы металлов, видеодемонстрации электролиза, химических свойств металлов.
Неметаллы (6 часов)
Обзор неметаллов. Оксиды неметаллов и кислородсодержащие кислоты. Водородные соединения неметаллов. Генетическая связь неорганических и органических веществ. Химия и жизнь. Химия и здоровье. Лекарства, ферменты, витамины, гормоны, минеральные воды. Проблемы, связанные с применением лекарственных препаратов. Химия и пища. Калорийность жиров, белков и углеводов. Химия в повседневной жизни. Моющие и чистящие средства. Правила безопасной работы со средствами бытовой химии. Химические вещества как строительные и поделочные материалы, используемые в полиграфии, живописи, скульптуре, архитектуре. Химическое загрязнение окружающей среды и его последствия. Бытовая химическая грамотность.
Демонстрации:образцы неметаллов, соединений неметаллов, видеофрагменты о химических свойствах неметаллов.
Требования к уровню подготовки учеников
Краткая характеристика сформированных результатов освоения образовательной программы, которыми должны владеть обучающиеся на начало года
знать/понимать:
- важнейшие химические понятия: валентность, степень окисления, гомологи, изомеры.
- основные теории химии: химической связи; теорию строения органических веществ Бутлерова.
уметь:
- называть изученные вещества по "тривиальной" или международной номенклатуре;
- определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, принадлежность веществ к различным классам органических соединений;
- характеризовать: основные классы органических веществ
- объяснять: природу химической связи
- выполнять химический эксперимент по распознаванию важнейших органических веществ;
- проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета);
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту и на производстве;
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
- приготовления растворов заданной концентрации в быту и на производстве;
- критической оценки достоверности химической информации, поступающей из разных источников.
В результате обучения в 11 классе ученик будет
знать / понимать
важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
уметь
называть изученные вещества по «тривиальной» или международной номенклатуре;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
-объяснения химических явлений, происходящих в природе, быту и на производстве;
-определения возможности протекания химических превращений в различных условиях и оценки их последствий;
-экологически грамотного поведения в окружающей среде;
-оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
-безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
-приготовления растворов заданной концентрации в быту и на производстве;
-критической оценки достоверности химической информации, поступающей из разных источников.
Критерии оценивания
Для проверки знаний, соответствующих третьему уровню, и умения применять их в учебной практике используется рефлективный вид заданий, выполнение которых опирается на репродуктивные знания, но требует глубокого осмысления, владения логическими приемами умственной деятельности (анализ, синтез, обобщение, конкретизация, сравнение, абстрагирование, классификация)
Оценка "5" ставится в случае:
1. Знания, понимания, глубины усвоения обучающимся всего объёма программного материала.
2. Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применяет полученные знания в незнакомой ситуации.
3. Отсутствие ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранение отдельных неточностей с помощью дополнительных вопросов учителя, соблюдение культуры письменной и устной речи, правил оформления письменных работ.
Оценка "4":
1. Знание всего изученного программного материала.
2. Умений выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
3. Незначительные (негрубые) ошибки и недочёты при воспроизведении изученного материала, соблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка "3" (уровень представлений, сочетающихся с элементами научных понятий):
1. Знание и усвоение материала на уровне минимальных требований программы, затруднение при самостоятельном воспроизведении, необходимость незначительной помощи преподавателя.
2. Умение работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
3. Наличие грубой ошибки, нескольких негрубых при воспроизведении изученного материала, незначительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка "2":
1. Знание и усвоение материала на уровне ниже минимальных требований программы, отдельные представления об изученном материале.
2. Отсутствие умений работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
3. Наличие нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка "1":
Ставится за полное незнание изученного материала, отсутствие элементарных умений и навыков.
Устный ответ.
Оценка "5" ставится, если ученик:
1) Показывает глубокое и полное знание и понимание всего объёма программного материала; полное понимание сущности рассматриваемых понятий, явлений и закономерностей, теорий, взаимосвязей;
2) Умеет составить полный и правильный ответ на основе изученного материала; выделять главные положения, самостоятельно подтверждать ответ конкретными примерами, фактами; самостоятельно и аргументировано делать анализ, обобщения, выводы. Устанавливать межпредметные (на основе ранее приобретенных знаний) и внутрипредметные связи, творчески применять полученные знания в незнакомой ситуации. Последовательно, чётко, связно, обоснованно и безошибочно излагать учебный материал; давать ответ в логической последовательности с использованием принятой терминологии; делать собственные выводы; формулировать точное определение и истолкование основных понятий, законов, теорий; при ответе не повторять дословно текст учебника; излагать материал литературным языком; правильно и обстоятельно отвечать на дополнительные вопросы учителя. Самостоятельно и рационально использовать наглядные пособия, справочные материалы, учебник, дополнительную литературу, первоисточники; применять систему условных обозначений при ведении записей, сопровождающих ответ; использование для доказательства выводов из наблюдений и опытов;
3) Самостоятельно, уверенно и безошибочно применяет полученные знания в решении проблем на творческом уровне; допускает не более одного недочёта, который легко исправляет по требованию учителя; имеет необходимые навыки работы с приборами, чертежами, схемами и графиками, сопутствующими ответу; записи, сопровождающие ответ, соответствуют требованиям.
Оценка "4" ставится, если ученик:
1) Показывает знания всего изученного программного материала. Даёт полный и правильный ответ на основе изученных теорий; незначительные ошибки и недочёты при воспроизведении изученного материала, определения понятий дал неполные, небольшие неточности при использовании научных терминов или в выводах и обобщениях из наблюдений и опытов; материал излагает в определенной логической последовательности, при этом допускает одну негрубую ошибку или не более двух недочетов и может их исправить самостоятельно при требовании или при небольшой помощи преподавателя; в основном усвоил учебный материал; подтверждает ответ конкретными примерами; правильно отвечает на дополнительные вопросы учителя.
2) Умеет самостоятельно выделять главные положения в изученном материале; на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи. Применять полученные знания на практике в видоизменённой ситуации, соблюдать основные правила культуры устной речи и сопровождающей письменной, использовать научные термины;
3) Не обладает достаточным навыком работы со справочной литературой, учебником, первоисточниками (правильно ориентируется, но работает медленно). Допускает негрубые нарушения правил оформления письменных работ.
Оценка "3" ставится, если ученик:
1. усвоил основное содержание учебного материала, имеет пробелы в усвоении материала, не препятствующие дальнейшему усвоению программного материала;
2. материал излагает несистематизированно, фрагментарно, не всегда последовательно;
3. показывает недостаточнуюсформированность отдельных знаний и умений; выводы и обобщения аргументирует слабо, допускает в них ошибки.
4. допустил ошибки и неточности в использовании научной терминологии, определения понятий дал недостаточно четкие;
5. не использовал в качестве доказательства выводы и обобщения из наблюдений, фактов, опытов или допустил ошибки при их изложении;
6. испытывает затруднения в применении знаний, необходимых для решения задач различных типов, при объяснении конкретных явлений на основе теорий и законов, или в подтверждении конкретных примеров практического применения теорий;
7. отвечает неполно на вопросы учителя (упуская и основное), или воспроизводит содержание текста учебника, но недостаточно понимает отдельные положения, имеющие важное значение в этом тексте;
8) обнаруживает недостаточное понимание отдельных положений при воспроизведении текста учебника (записей, первоисточников) или отвечает неполно на вопросы учителя, допуская одну-две грубые ошибки.
Оценка "2" ставится, если ученик:
1. не усвоил и не раскрыл основное содержание материала;
2. не делает выводов и обобщений.
3. не знает и не понимает значительную или основную часть программного материала в пределах поставленных вопросов;
4. или имеет слабо сформированные и неполные знания и не умеет применять их к решению конкретных вопросов и задач по образцу;
5) или при ответе (на один вопрос) допускает более двух грубых ошибок, которые не может исправить даже при помощи учителя.
Оценка "1" ставится, если ученик:
1) не может ответить ни на один из поставленных вопросов;
2) полностью не усвоил материал.
Примечание.
По окончанию устного ответа учащегося педагогом даётся краткий анализ ответа, объявляется мотивированная оценка. Возможно привлечение других учащихся для анализа ответа, самоанализ, предложение оценки.
Оценка самостоятельных письменных и контрольных работ.
Оценка "5" ставится, если ученик:
1. выполнил работу без ошибок и недочетов;
2) допустил не более одного недочета.
Оценка "4" ставится, если ученик выполнил работу полностью, но допустил в ней:
1. не более одной негрубой ошибки и одного недочета;
2. или не более двух недочетов.
Оценка "3" ставится, если ученик правильно выполнил не менее половины работы или допустил:
1. не более двух грубых ошибок;
2. или не более одной грубой и одной негрубой ошибки и одного недочета;
3. или не более двух-трех негрубых ошибок;
4. или одной негрубой ошибки и трех недочетов;
5) или при отсутствии ошибок, но при наличии четырех-пяти недочетов.
Оценка "2" ставится, если ученик:
1. допустил число ошибок и недочетов превосходящее норму, при которой может быть выставлена оценка "3";
2. или если правильно выполнил менее половины работы.
Оценка "1" ставится, если ученик:
1. не приступал к выполнению работы;
2. или правильно выполнил не более 10 % всех заданий.
Примечание.
1) Учитель имеет право поставить ученику оценку выше той, которая предусмотрена нормами, если учеником оригинально выполнена работа.
2) Оценки с анализом доводятся до сведения учащихся, как правило, на последующем уроке, предусматривается работа над ошибками, устранение пробелов.
Оценка выполнения практических (лабораторных) работ, опытов по предметам.
Оценка "5" ставится, если ученик:
1) правильно определил цель опыта;
2) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;
3) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
4) научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы;
5) правильно выполнил анализ погрешностей (9-11 классы).
6) проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
7) эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Оценка "4" ставится, если ученик выполнил требования к оценке "5", но:
1. опыт проводил в условиях, не обеспечивающих достаточной точности измерений;
2. или было допущено два-три недочета;
3. или не более одной негрубой ошибки и одного недочета,
4. или эксперимент проведен не полностью;
5. или в описании наблюдений из опыта допустил неточности, выводы сделал неполные.
Оценка "3" ставится, если ученик:
1. правильно определил цель опыта; работу выполняет правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы;
2. или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов;
3. опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, анализе погрешностей и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения; или не выполнен совсем или выполнен неверно
4. допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Оценка "2" ставится, если ученик:
1. не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов;
2. или опыты, измерения, вычисления, наблюдения производились неправильно;
3. или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3";
4. допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию учителя.
Оценка "1" ставится, если ученик:
1. полностью не сумел начать и оформить опыт; не выполняет работу; показывает отсутствие экспериментальных умений; не соблюдал или грубо нарушал требования безопасности труда.
Оценка умений проводить наблюдения.
Оценка "5" ставится, если ученик:
1. правильно по заданию учителя провел наблюдение;
2. выделил существенные признаки у наблюдаемого объекта (процесса);
3. логично, научно грамотно оформил результаты наблюдений и выводы.
Оценка "4" ставится, если ученик:
1. правильно по заданию учителя провел наблюдение;
2. при выделении существенных признаков у наблюдаемого объекта (процесса) назвал второстепенные;
3) допустил небрежность в оформлении наблюдений и выводов.
Оценка "3" ставится, если ученик:
1. допустил неточности и 1-2 ошибки в проведении наблюдений по заданию учителя;
2. при выделении существенных признаков у наблюдаемого объекта (процесса) выделил лишь некоторые;
3) допустил 1-2 ошибки в оформлении наблюдений и выводов.
Оценка "2" ставится, если ученик:
1. допустил 3 - 4 ошибки в проведении наблюдений по заданию учителя;
2. неправильно выделил признаки наблюдаемого объекта (процесса);
3. опустил 3 - 4 ошибки в оформлении наблюдений и выводов.
Оценка "1" ставится, если ученик:
Не владеет умением проводить наблюдение.
Учебно-методический комплект:
Рудзитис, Г.Е. Химия: учебник для 11 класса общеобразовательных учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман // М.: Просвещение, 2009.
Примерная программа среднего (полного) общего образования по химии (базовый уровень).
Обеспечение учащихся:
Рудзитис, Г.Е. Химия: учебник для 11 класса общеобразовательных учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман // М.: Просвещение, 2009.
Библиотека научно- популярных изданий для получения дополнительной информации по предмету (в кабинете и в школьной библиотеке).
Материально- техническое обеспечение:
Наглядные пособия: серии таблиц по органической химии и неорганической химии, коллекции, модели молекул, наборы моделей атомов для составления моделей молекул, комплект кристаллических решеток.
Приборы, наборы посуды, лабораторных принадлежностей для химического эксперимента, наборы реактивов. Наличие лабораторного оборудования и реактивов позволяет формировать культуру безопасного обращения с веществами, выполнять эксперимент по распознаванию важнейших органических веществ, проводить экспериментальные работы исследовательского характера.
Входная контрольная работа
1 вариант
Часть А.
1. К какому гомологическому ряду относится вещество состава С7Н8?
а) алканы
б) алкены
в) алкины
г) арены
2. Реакции какого типа характерны для алканов?
а) присоединения
б) замещения
в) полимеризации
г) гидратации
3 . Какое название соответствует веществу СН3 – СН – СН2 – СН3
. Какое название соответствует веществу СН3 – СН – СН2 – СН3
СН3
а) бутан б) 2-метилбутан в) 2-метилпропан г) 3-метилбутан
4. Сколько σ -связей в молекуле этена?
а) 2 б) 3 в) 4 г) 5
5. Несколько функциональных групп -ОН содержат молекулы:
а) глицерина и глюкозы б) фенола и пропанолав) сахарозы и формальдегида г) фенола и формальдегида
6. В состав белков входят остатки:
а) α-аминокислот б) β-аминокислот в) γ-аминокислот г) δ-аминокислот
7. Продуктами окисления предельных одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
8. Для аминов характерны свойства:
а) кислот б) оснований в) амфотерных соединений
9. Из остатков молекул α – глюкозы состоят молекулы:
а) фруктозы б) крахмала в) сахарозы г) целлюлозы
10. Установите тип реакции: nC6H12O6 → (C6H10O5)n + nH2O
а) полимеризация б) присоединения в) поликонденсации г) изомеризации
11. Карбоксильная группа содержится в молекуле:
а) метанола б) ацетальдегида в) уксусной кислоты г) глицерина
Часть Б
1. Установите формулу органического вещества, в котором С - 53,5%, Н – 15,6%, N – 31,1% и относительная плотность по водороду 22,5
2. Для вещества СН2= СН-СН=СН2 составьте структурные формулы одного изомера и одного ближайшего гомолога, назовите все вещества.
2 вариант
Часть А.
1. Какая общая формула соответствует классу алканов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
2. Тип реакции взаимодействия этена с бромом:
а) присоединения б) замещения в) гидрирования г) гидратации
3 . Вещество СН3 – СН – СН = СН2 называется
. Вещество СН3 – СН – СН = СН2 называется
СН3
а)2-метилбутан б) 3-метилбутен-2в) 3-метилбутин-1 г) 3-метилбутен-1
4. Сколько π-связей в молекуле бутадиена-1,3:
а) 1 б) 2 в) 3 г) 4
5. Функциональная группа -ОН характерна для класса:
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
6. Химическая связь, образующая первичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
7. В реакцию «серебряного зеркала» вступают:
а) альдегиды б) фенолы в) спирты г) одноатомные спирты
8 . Какое название у вещества СН3 – СН – СН2 – СООН
. Какое название у вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминобутановая кислота б) 2-аминобутановая кислотав) α-аминомасляная кислота в) 4- аминомасляная кислота
9. Только σ – связи имеются в молекуле:
а) этанола б) этаналя в) этена г) этина
10. Сложный эфир можно получить реакцией:
а) гидрирования б) гидратации в) этерификации г) дегидратации
11. Какой газ составляет основу природного газа?
а) метан б) этан в) пропан г) бутан
Часть Б
Выведите молекулярную формулу углеводорода, массовая доля углерода в котором рана 75% , водорода 25%, относительная плотность вещества по кислороду равна 0,5.
2. Для вещества, формула которого СН2 = СН – СН2 – СН3 , структурные формулы одного изомера и одного ближайшего гомолога, назовите все вещества.
Контрольная работа №1
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа:
(2 балла). Формула вещества с ковалентной полярной связью:
А) Cl2. Б) KCl. В) NH3 Г) O2.
(2 балла). Вещество, между молекулами которого существует водородная связь: А) Этанол. Б) Метан. В) Водород. Г) Бензол.
(2 балла). Число общих электронных пар в молекуле водорода: А) Одна. Б) Две. В) Три. Г) Четыре.
(2 балла). Полярность химической связи увеличивается в ряду соединений, формулы которых:
А) NH3, HI, O2 Б) CH4, H2O, HF. В) PH3, H2S, H2 Г) HCl, CH4, Cl2.
(2 балла). Кристаллическая решётка хлорида магния:
А) Атомная. Б) Ионная. В) Металлическая. Г) Молекулярная.
6. (2 балла). Вещество, формула которого СUSO4 , называется:
А) сульфит меди (II); Б) сульфат меди (I); В) сульфат меди (II)
Г) сульфид кальция.
ЧАСТЬ Б. Задания со свободным ответом:
7. (5 баллов). Рассчитайте массовые доли каждого из элементов в веществе: фосфат калия;
(6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава С4Н6 . Назовите эти вещества.
(3 балла). Составьте электронную формулу катиона железа (II):Fe2+
(5 баллов). В 180 г 15%-го раствора гидроксида натрия растворили еще 20 г щелочи. Рассчитайте массовую долю щелочи в полученном растворе.
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Формула вещества с ионной связью:
А) НCl. Б) KBr. В) P4 Г) CH3 OH.
(2 балла). Вещество c металлической связью:
А) Оксид калия. Б) Медь. В) Кремний. Г) Гидроксид магния.
(2 балла). Число общих электронных пар в молекуле азота: А) Одна. Б) Две. В) Три. Г) Четыре.
(2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А) Cl2, H2S, CO2 Б) HCl, HBr, HI. В) NH3, PH3, SO2
Г) BHCl3, NH3, HF.
(2 балла). Кристаллическая решётка оксида кремния (IV):
А) Атомная. Б) Ионная. В) Металлическая. Г) Молекулярная.
6. (2 балла). Вещество, формула которого: CaSO4 , называется:
А) сульфит кальция; Б) сульфид кальция; В) сульфат кальция;
Г) гидросульфат кальция.
ЧАСТЬ Б. Задания со свободным ответом
7. (5 баллов). Рассчитайте массовые доли каждого из элементов в веществе: сульфат кальция;
(6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава С4Н8O2. Назовите эти вещества.
(3 балла). Составьте электронную формулу катиона меди (II): Cu2+
10. (5 баллов). Слили два раствора серной кислоты: 240 г 30%-го и 180 г 5%-го.
Рассчитайте массовую долю кислоты в полученном растворе.
Контрольная работа №2
Вариант1
1. К химическим реакциям не относится:
а) растворение оксида кальция и воде; б) ржавление железа:
в) превращение поды в пар при нагревании; г) потемнение серебряной ложечки.
2. К физическим процессам не будетотноситься получение:
а) кислорода фракционной перегонкой жидкого воздуха;
б) дистиллированной воды;
в) бензина крекингом нефтепродуктов;
г) нефтепродуктов из нефти в ректификационной колонне.
3. Соотнесите:
реагирующие вещества:
1)уксусная кислота и карбонат натрия;
фенол и натрий;
оксид кальция и оксид кремния (IV);
4) гидроксид железа (III) - при нагревании;
тип реакции:
а) разложение; б) соединение; в) замещение; г) обмен.
4. Сокращенному ионному уравнению реакции
Ва2+ + CO32- = ВаСО3 соответствует взаимодействие между:
а) оксидом бария и угольной кислотой; б) хлоридом бария и карбонатом натрия;
в) гидроксидом бария и карбонатом кальция; г) барием и карбонатом калия.
5. Окислительно-восстановительной не являетсяреакция:
а) между хлором и этиленом; б) разложения пероксида водорода;
в) термического разложения карбоната кальция; г) этанола с подкисленным раствором бихромата калия.
6. Соотнесите:
тип реакции: 1) гомогенная; 2)гетерогенная;
пример реакции:
а) цинк с разбавленной серной кислотой; б) пропан с хлором;
в) оксид углерода (П) с кислородом; г) этилен с раствором перманганата калия.
7. Раздел химии, изучающий скорость протекания химических реакций, называется:
а) химической термодинамикой; б) химической кинетикой;
в) электрохимией; г) стереохимией.
8. Единица измерения скорости химической реакции
а) моль/(л*с); б) (кмоль* м3) / ч; в) (моль*с)/мл; г) (л*с) / моль.
9.Вычислите среднюю скорость реакции этерификации
HCOOH + С3Н7ОН ------ НСOОС3Н7 + Н2O
при 700С, если за 20 мин концентрация муравьиной кислоты уменьшилась с 2,4 моль/л до 1,6 моль/л: а) 0,04 моль/(л*мин); б) 0,8 моль/(л * мин);
в) 0,06 моль/(л * мин); г) 0,27 моль/(л * мин).
10.По термохимическому уравнению
Fe3O4(Т) + 4СO(г) -------- 3Fe(т) +4CO2(г) - 44 кДж
определите, в каком направлении смещается равновесие при уменьшении температуры реакции:
а) смещается влево; б) смещается вправо;
в) смещается в сторону образования исходных веществ; г) не смещается.
11. В реакции
СН3СООН(ж) + СН3ОН(ж) ------ СН3СООСН3(ж)- Н20(ж)
для смещения равновесия в сторону образования сложного эфира необходимо:
а) увеличить давление; б) уменьшить концентрацию метанола;
в) увеличить концентрацию метилацетата; г) удалить из реакционной системы воду.
Вариант 2
1.Соотносите: тип процесса:
1) химический процесс; 2)физический процесс;
примеры:
а) взрыв метана в шахте; б) растворение сахара в воде;
в) образование конденсата на холодном предмете; г) смешение азота и оксида углерода (IV);
д) образование озона при грозовом разряде; е) изменение окраски индикатора в кислой среде.
2. Соотнесите
тип реакции: названия реагирующих веществ:
разложение; а) оксид углерода (II) и кислород;
соединение; б) нитрат калия ----- при нагревании;
замещение; в) анилин и бром (водн.);
4) обмен; г) уксусная кислота и оксид кальция.
3. Взаимодействие оксида калия с водой относится к реакциям:
а) соединения; б) разложения;
в) замещения; г) обмена.
4. Реакцией нейтрализации можно назвать взаимодействие:
а) уксусной кислоты с хлором в присутствии катализатора;
б) муравьиной кислоты с аммиачным раствором оксида серебра;
в) хлорангидрида уксусной кислоты с этиловым спиртом;
г) уксусной кислоты с гидроксидом калия.
5. Сокращенному ионному уравнению 2Н + СО32- = CO2 + Н2O
соответствует взаимодействие между: а) серной кислотой и карбонатом кальция;
б) соляной кислотой и карбонатом натрия;
в) азотной и угольной кислотами;
г) уксусной кислотой и карбонатом калия.
6. К гетерогенным реакциям относится:
а) взаимодействие растворов гидроксида натрия и азотной кислоты;
б) синтез хлороводорода из хлора и водорода;
в) каталитическое гидрирование жидких жиров;
г) реакция этерификации изоамилового спирта уксусной кислотой.
7. Скоростью гомогенной химической реакции называется:
а) изменение концентрации одного из веществ в единицу времени;
б) отношение изменения концентрации продукта к изменению концентрации исходного вещества;
в) время, за которое реакция полностью завершится;
г) отношении числа моль прореагировавшего вещества к промежутку времени, за которое это изменение произошло.
8.Кинетическое уравнение реакции CO(г) +2H2 ----- CH3OH(г) имеет вид:
а) V=CCO *C2H2 б) V=kCCO*C2H2
в) V=kCCO +C2H2 г)V=kCCO*CH2
9. Константа скорости химической реакции не зависит:
а) от природы реагирующих веществ; б) от концентрации реагирующих веществ;
в) от температуры; г) от наличия катализатора.
10.В реакции СО(г ) + H2O(г| ----- СO2(г) + Н2(г) + Qдля смещения равновесия вправо необходимо:
а) увеличить давление; б) уменьшить давление,
в) увеличить температуру; г) уменьшить температуру.
11.С помощью какого воздействия на равновесную систему
2SO2(г) + O2(г) ------ 2CO3(г) +Q можно максимально сместить равновесие вправо?
а) Уменьшить температуру, уменьшить давление;
б) увеличить температуру, увеличить давление;
г) увеличить температуру, уменьшить давление.
в) уменьшить температуру, увеличить давление;
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ
11 класс
ВАРИАНТ 1
ЧАСТЬ I
А1. Электронную конфигурацию ns2np6 в основном состоянии имеет атом
1.Mg
2.Ne
3. K
4. B

А7.Электронная конфигурация ls22s22p63s23p1 соответствует атому
1. кремния
2. алюминия
3. углерода
4. бора
А8. Атом элемента, высший оксид которого ЭО2, имеет электронную формулу внешнего электронного слоя
1. 2s22p3
2. 4s24p4
3. 3s23p2
4. 3s23p5
А9. Элемент с электронной конфигурацией внешнего уровня 3s23p5 образует водородное соединение состава
1. H4Э
2. H2Э
3. H3Э
4.HЭ
А10. Одинаковую электронную конфигурацию имеют атом бериллия и частица
1. Ca2+
2. O2-
3. Mg0
4. N3+


ЧАСТЬII



C 1. Определите сумму коэффициентов в уравнении окислительно-восстановительной реакции, схема которой:
KMnO4 +HI = KI + MnI2 +I2 + …
на основе составленного электронного баланса.
ВАРИАНТ 2
ЧАСТЬ I
А1. Электронная конфигурация ls22s22p5 соответствует атому
1. неона
2. аргона
3. фтора
4. Алюминия
А2. Элемент с электронной конфигурацией внешнего уровня 3s23p3 образует водородное соединение состава
1. H2Э
2.HЭ
3. H4Э
4. H3Э

А8. Одинаковую электронную конфигурацию имеют атом гелия и частица
1. O2-
2. N3+
3. Be2+
4. Ca2+
А9. Атом элемента, высший оксид которого Э2О5, имеет электронную формулу внешнего электронного слоя
1. 3s13p0
2. 2s22p3
3. 3s23p5
4. 4s24p4
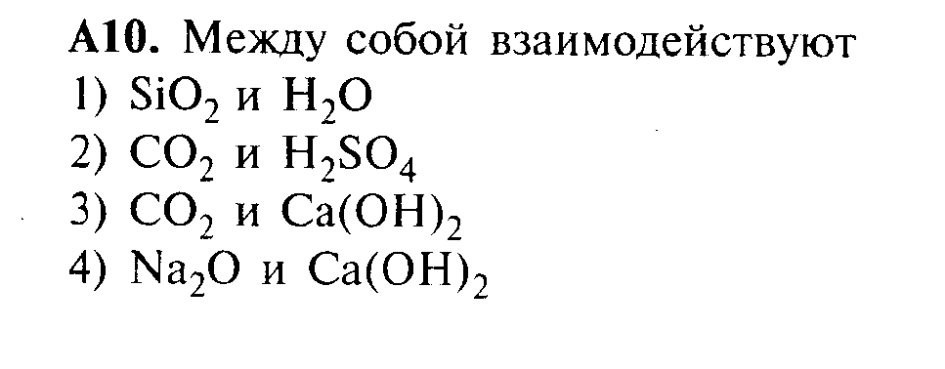

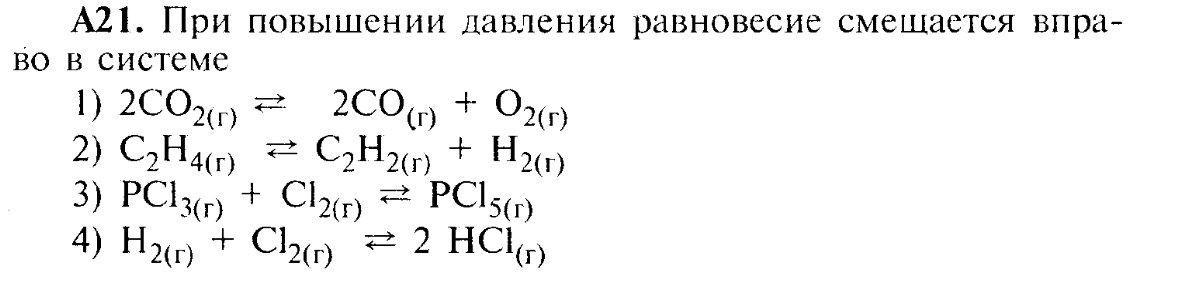
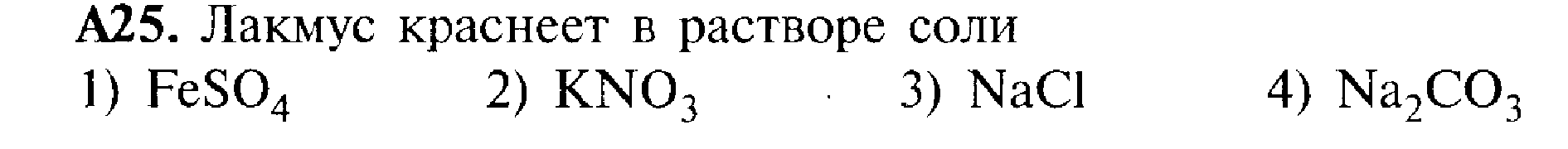
ЧАСТЬII

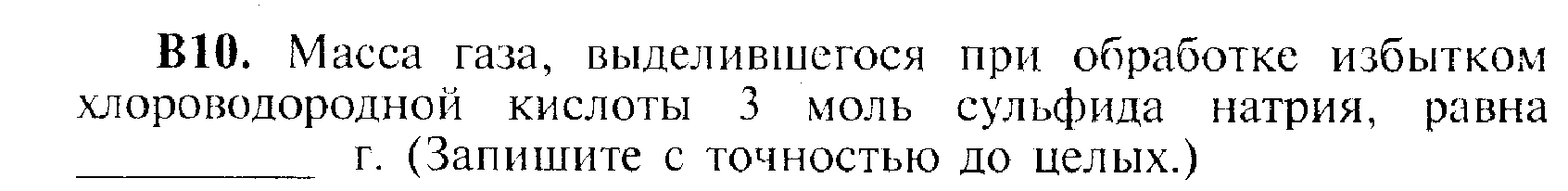
C 1. Определите сумму коэффициентов в уравнении окислительно-восстановительной реакции, схема которой:
HNO3 + Al = Al(NO3)3 + NH4NO3 +…
на основе составленного электронного баланса.
Календарно-тематическое планирование
| № | Тема урока | Кол-во часов | Тип урока | Характеристика деятельности учащихся или виды учебной деятельности | Виды контроля, измерители | Планируемые результаты освоения материала | Дата проведения |
| План | Факт |
| Повторение основных вопросов курса химии 10 класса (3 часа) |
| 1 | Классификация и химические свойства органических соединений | 1
| КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Умение отличать органические соединения от неорганических, знать химические свойствв | 1.09 |
|
| 2-3 | Решение задач на нахождение массовой доли, количества вещества. | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Уметь решать задачи на массовую долю, количество вещества | 8.09 15.09 |
|
| 4 | Входная контрольная работа | 1 | УК | Применение знаний, умений и навыков | Итоговый | Уметь применять знания, умения и навыки | 22.09 |
|
| Важнейшие химические понятия и законы (1 час) |
| 5 | Химический элемент. Изотопы. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях, закон постоянства состава | 1
| Урок усвоения новых знаний | Общеучебная познавательная деятельность | Предварительный
| Знание понятия изотоп. Умение различать простые вещества и химические элементы. Знание закона сохранения массы веществ и закона постоянства состава веществ | 29.09 |
|
| Периодический закон и периодическая система химических элементов Д. И. Менделеева с точки зрения учения о строении атома (1 час) |
| 6 | Особенности размещения электронов в атомах малых и больших периодов. s-, p-, d-, f- электроны Положение в периодической системе водорода, лантаноидов, актиноидов и искусственно полученных элементов. Валентность и валентные возможности атомов | 1 | КУ | Общеучебная познавательная деятельность | Текущий, устный опрос | Знание особенностей размещения электронов в атомах. Умение различать s-, p-, d-, f- элементы. Знание положения в периодической системе водорода, лантаноидов, актиноидов и искусственно полученных элементов. Умение объяснить причину такого положения элементов. Знание сущности понятия «валентность», валентных возможностей атомов, периодического изменения валентности и размеров атомов | 6.10 |
|
| Строение вещества (5 часов) |
| 7 | Основные виды химической связи. Пространственное строение молекул неорганических и органических веществ | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание и умение различать основные виды химической связи. Знание факторов, обуславливающих пространственное строение молекул | 20.10 |
|
| 8 | Типы кристаллических решеток и свойства веществ. Причины многообразия веществ. Дисперсные системы | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание типов кристаллических решеток и причин многообразия веществ. Знание классификации дисперсных систем. Умение отличать коллоидные растворы от истинных | 27.10 |
|
| 9 | Подготовка к контрольной работе №1 | 1 | УОИСЗ | Структурирование знаний | Коррекционный | Умение применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений | 3.11 |
|
| 10 | Контрольная работа №1 | 1 | УК | Применение знаний, умений и навыков | Итоговый | Уметь применять знания, умения и навыки | 10.11 |
|
| 11 | Практическая работа №1 | 1 | УЗЗ | Постановка и решение проблемы | Коррекционный | Умение ставить задачу и выполнять ее | 17.11 |
|
| Химические реакции (11 часов) |
| 12 | Классификация химических реакций | 1 | УИНЗ | Общеучебная познавательная деятельность | Предварительный | Знание признаков, по которым классифицируют химические реакции и умение определять тип реакции | 1.12 |
|
| 13 | Скорость химических реакций. Катализ | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание понятий «скорость реакции», «энергия активации» и основных факторов, влияющих на скорость химических реакций | 8.12 |
|
| 14 | Химическое равновесие и условия его смещения. | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание понятия «химическое равновесие», условий смещения химического равновесия. | 15.12 |
|
| 15 | Производство серной кислоты контактным способом | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание процессов, происходящих при производстве серной кислоты | 22.12 |
|
| 16 | Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. Степень и константа диссоциации | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание понятий «электролиты», «неэлектролиты» и «электролитическая диссоциация». Умение составлять уравнения диссоциации электролитов. Знание сильных и слабых электролитов, понятий «степень диссоциации» и «константа диссоциации» | 29.12 |
|
| 17 | Реакции ионного обмена | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Умение писать уравнения реакций в молекулярной и ионной формах | 12.01 |
|
| 18 | Гидролиз органических и неорганических соединений | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Умение записывать уравнения реакций гидролиза | 19.01 |
|
| 19 | Подготовка к контрольной работе №2 | 1 | УОИСЗ | Структурирование знаний | Коррекционный | Умение применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений | 26.01 |
|
| 20 | Контрольная работа №2 | 1 | УК | Применение знаний, умений и навыков | Итоговый | Уметь применять знания, умения и навыки | 2.02 |
|
| 21 | Подготовка к практической работе №2 | 1 | УОИСЗ | Структурирование знаний | Коррекционный | Умение применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений | 9.02 |
|
| 22 | Практическая работа №2 | 1 | УЗЗ | Постановка и решение проблемы | Коррекционный | Умение ставить задачу и выполнять ее | 16.02 |
|
| Металлы (6 часов) |
| 23 | Общие способы получения металлов. Электролиз Коррозия металлов и ее предупреждение | 1 | Урок усвоения новых знаний | Общеучебная познавательная деятельность | Предварительный | Умение составлять схемы электролиза Знание сущности процесса коррозии и методов борьбы с ней | 2.03 |
|
| 24 | Обзор металлических элементов А-групп | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание физических и химических свойств металлических элементов А-групп | 9.03 |
|
| 25 | Общий обзор металлических элементов Б-групп. Медь | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание закономерностей изменения химической активности у элементов Б-групп. Знание физических и химических свойств, способов получения и применения меди | 16.03 |
|
| 26 | Цинк. Титан. Хром | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание физических и химических свойств, способов получения и применения цинка, титана и хрома | 23.03 |
|
| 27 | Железо, никель, платина | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание физических и химических свойств, способов применения железа, никеля, платины | 30.03 |
|
| 28 | Сплавы металлов. Оксиды и гидроксиды металлов | 1 | КУ | Общеучебная познавательная деятельность | Текущий, письменный опрос | Знание понятия «сплавы», их классификации. Знание свойств металлов IIА-группы и характеристики их оксидов и гидроксидов | 6.04 |
|
| Неметаллы (6 часов) |
| 29 | Обзор неметаллов. Оксиды неметаллов и кислородсодержащие кислоты. Водородные соединения неметаллов. Генетическая связь неорганических и органических веществ | 1 | Урок усвоения новых знаний | Общеучебная познавательная деятельность | Предварительный | Знание размещения неметаллических элементов в периодической системе, строения, химических свойств и способов применения неметаллов Знание изменений кислотных свойств оксидов в группах и периодах периодической системы, химических свойств кислотных оксидов и кислот. Знание общих формул водородных соединений, их свойств. Знание генетической связи неорганических и органических веществ | 20.04 |
|
| 30 | Лекарства, ферменты, витамины, гормоны, минеральные воды. Проблемы, связанные с применением лекарственных препаратов. Химия и пища . Калорийность жиров, белков и углеводов. Химия в повседневной жизни. Моющие и чистящие средства. Правила безопасной работы со средствами бытовой химии. Химические вещества как строительные и поделочные материалы, используемые в полиграфии, живописи, скульптуре, архитектуре. Химическое загрязнение окружающей среды и его последствия. Бытовая химическая грамотность.
| 2 | КУ | Структурирование знаний, логическая деятельность | Коррекционный | Умение применять полученные знания, умения и навыки в быту
| 27.04 |
|
| 31 | Подготовка к контрольной работе №3 | 1 | УОИСЗ | Структурирование знаний | Коррекционный | Умение применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений | 4.05 |
|
| 32 | Контрольная работа №3 | 1 | УК | Применение знаний, умений и навыков | Итоговый | Уметь применять знания, умения и навыки | 11.05 |
|
| 33 | Практическая работа №3 | 1 | УЗЗ | Постановка и решение проблемы | Коррекционный | Умение ставить задачу и выполнять ее | 18.05 |
|
| 34 | Итоговый урок | 1 | УОИСЗ | Структурирование знаний, логическая деятельность | Итоговый | Умение применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений | 25.05 |
|







 . Какое название соответствует веществу СН3 – СН – СН2 – СН3
. Какое название соответствует веществу СН3 – СН – СН2 – СН3 . Вещество СН3 – СН – СН = СН2 называется
. Вещество СН3 – СН – СН = СН2 называется . Какое название у вещества СН3 – СН – СН2 – СООН
. Какое название у вещества СН3 – СН – СН2 – СООН