Домашнее задание Катионы III-IV аналитических групп Вопросы для контроля исходного уровня знаний
Цель: проверить уровень сформированности знаний учащихся о проведении качественного анализа на катионы III-IV аналитических групп.
-
Какие катионы входят в III аналитическую группу?
______, _______, _________.
-
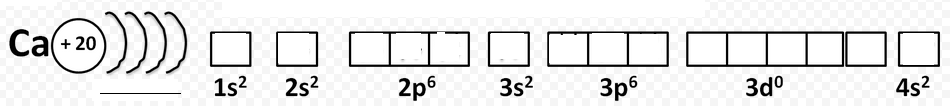
К каким элементам относятся катионы кальция и бария и какое имеют строение внешнего энергетического уровня
Относятся к ___-элементам.
Строение элемента кальция (вставьте пропущенные электроны и зарисуйте схему строения электронной оболочки:
-
Посмотрите таблицу растворимости солей и оснований в воде. Запишите формулы солей
В воде растворимы ________________________________________________
_________________________________________________________________
В воде малорастворимы ____________________________________________
В воде нерастворимы ______________________________________________
_________________________________________________________________
-
Какой цвет имеют соли бария и кальция в твердом виде (за счет катиона)?
| Катион кальция окраска | Катион бария окраска |
|
|
|
Иллюстрационный материал:
| 
| 
|
| Нитрат кальция | Нитрат бария |
-
На первом занятии мы готовили растворы солей, вспомните кто готовил растворы солей кальция и бария, какой цвет имеют полученные растворы
| 
| 
|
| Кальция хлорид | Бария хлорид |
| Растворы солей кальция окраска | Растворы солей бария окраска |
|
|
|
-
Запишите формулы оснований соответствующих данным катионам. К каким основаниям они относятся сильным или слабым.
|
| Формула | Свойства основания (сильное, слабое |
| Кальция гидроксид |
|
|
| Бария гидроксид |
|
|
-
Какое значение рН будут иметь растворы солей бария хлорида, кальция хлорида?
Хлорид кальция – соль образованная ______ (сильным, слабым основанием), соли гидролизу по катиону __________________ (подвергаются, не подвергаются).
Хлорид бария – соль образованная ______ (сильным, слабым основанием), соли гидролизу по катиону __________________ (подвергаются, не подвергаются).
-
Рассмотрим качественные реакции на катион кальция и бария. Какой тест является общим?
Соли бария окрашивают пламя в _____________ цвет
Соли кальция окрашивают пламя в ______________ цвет
Посмотрите видео об окраске пламени солями щелочных и щелочно-земельных металлов: https://www.youtube.com/watch?v=CXNtboFV2eY
-
Какой групповой реактив на катионы 3 аналитической группы? Запишите уравнения реакций в молекулярном и сокращенном ионном виде.
Групповой реактив __________________________________________________
Реакция на катионы кальция с групповым реактивом:
__________________________________________________
Реакция на катионы бария с групповым реактивом
_____________________________________________________
Посмотрите видео: https://www.youtube.com/watch?v=Zw4G9_zfEC0
https://www.youtube.com/watch?v=RhWvHJy_2pk
-
Зачем требуется добавление спирта этилового при проведении реакции на катион кальция с серной кислотой?
_____________________________________________________________________________
-
Какими реакциями можно доказать присутствие катиона кальция? Напишите уравнение кальция нитрата с оксалатом аммония.
_____________________________________________________________________________
-
Какими реакциями можно доказать присутствие катиона бария? Напишите уравнение взаимодействия бария нитрата с хроматом калия
Посмотрите видео : https://www.youtube.com/watch?v=vWknNe9YLBE
-
Почему в качестве рентгеноконтрастного средства можно использовать бария сульфат и нельзя бария карбонат? (Рассмотрите возможность взаимодействия двух веществ с соляной кислотой желудочного сока)
_____________________________________________________________________________
-
Какие катионы входят в IV аналитическую группу?
______, _______.
-
Посмотрите таблицу растворимости солей и оснований в воде, что вы можете сказать, про растворимость солей цинка и алюминия.
В воде растворимы ________________________________________________
_________________________________________________________________
В воде малорастворимы ____________________________________________
В воде нерастворимы ______________________________________________
_________________________________________________________________
-
Какой цвет имеют соли цинка и алюминия в твердом виде?
| 
| 
|
| Цинка нитрат | Алюминия нитрат |
| Катионы цинка окраска | Катионы бария окраска |
|
|
|
-
На первом занятии мы готовили растворы солей, вспомните? кто готовил растворы солей алюминия и цинка, какой цвет имеют полученные растворы
| 
| 
|
| Цинка хлорид | Алюминия хлорид |
| Растворы солей цинка окраска | Растворы солей алюминия окраска |
|
|
|
-
Запишите формулы оснований соответствующих данным катионам. К каким основаниям они относятся сильным или слабым.
|
| Формула | Свойства основания (сильное, слабое) |
| Цинка гидроксид |
|
|
| Алюминия гидроксид |
|
|
-
Какое значение рН будут иметь растворы солей цинка сульфата, алюминия сульфата?
Цинка сульфат – соль образованная ______ (сильным, слабым основанием), соли гидролизу по катиону __________________ (подвергаются, не подвергаются).
Алюминия сульфат – соль образованная ______ (сильным, слабым основанием), соли гидролизу по катиону __________________ (подвергаются, не подвергаются).
-
Рассмотрим качественные реакции на катион цинка и алюминия. Какой групповой реактив на катионы 4 аналитической группы? Запишите уравнения реакций в молекулярном и сокращенном ионном виде.
Реакция на соли цинка с гидроксидом натрия с эквивалентным количеством:
С избытком ________________________________________________________________
Реакция на соли алюминия с гидроксидом натрия с эквивалентным количеством:
С избытком ________________________________________________________________
Посмотрите видео образования гидроксида цинка и: https://www.youtube.com/watch?v=9nD3GRyscyM
А также гидроксида алюминия: https://www.youtube.com/watch?v=8uj6K70E8ds
-
Какую качественную реакцию на алюминий проводят еще?
Среда ______________(кислая, нейтральная или щелочная), с ализарином соли алюминия образуют соединение _____________________________ цвета.
-
Какими реакциями можно доказать наличие катиона цинка?
Реакция с сульфидом натрия
В молекулярном виде: ___________________________________________________
В полном ионном виде: __________________________________________________
В сокращенном ионном виде: _____________________________________________
Посмотрите видео: https://www.youtube.com/watch?v=kGxOkS-RteA
Реакция с желтой кровяной солью (K4[Fe(CN )6]
В молекулярном виде _________________________________________________________
Посмотрите видео: https://www.youtube.com/watch?v=khbD4lC7PEI
-
Напишите гидролиз соли цинка хлорида по первой ступени:
__________________________________________________________________________
__________________________________________________________________________
-
Напишите гидролиз соли алюминия хлорида по первой ступени
__________________________________________________________________________
__________________________________________________________________________
Посмотрите видео о гидролизе солей: https://www.youtube.com/watch?v=s9NLQM714x4
ПРАКТИЧЕСКАЯ РАБОТА № 1
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН БАРИЯ
Разбавленная серная кислота и сульфаты
BaCl2 + H2SO4 BaSO4 + 2HCl
Выполнение пробирочной реакции: 1к. BaCl2 + 1к. H2SO4
Образуется белый осадок
Хромат калия
K2CrO4 + BaCl2 BaCrO4 + 2 KCl
Выполнение пробирочной реакции: 1 к. BaCl2 + 1 к. раствора K2CrO4 и 1 к. раствора ацетата натрия.
Образуется желтый кристаллический осадок в нейтральной и уксуснокислой среде
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН КАЛЬЦИЯ
Разбавленная серная кислота
СaCl2 + H2SO4 СaSO4 + 2HCl
Выполнение пробирочной реакции: 3к. СaCl2 + 3 к. H2SO4 + 8 к. этанола
Образуется белый осадок
Оксалат аммония
CaСl2 + Na2C2O4 CaC2O4 + 2 NaCl
Выполнение пробирочной реакции: 3 к . СaCl2 + 3 капли раствора оксалата аммония.
Выпадает белый кристаллический осадок.
ПРАКТИЧЕСКАЯ РАБОТА №2
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН ЦИНКА
Раствор гидроксида натрия или калия
ZnС12 + 2NaOH Zn(OH)2 + 2NaCl
В избытке реактива
Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
Выполнение реакции: к 5 каплям раствора соли цинка осторожно по каплям при перемешивании добавляют 2 М раствор NaOH (или KOH) до полного растворения образующегося белого осадка гидроксида цинка.
Гексацианоферрат (II) калия
3ZnС12 + 2K4[Fe(CN)6] Zn3K2[Fe(CN)6]2 + 6KCl
Выполнение реакции: к 5 каплям раствора соли цинка прибавляют 5 капель раствора гексацианоферрата (II) калия.
Образуется белый осадок, нерастворимый в разведенной хлористоводородной кислоте.
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН АЛЮМИНИЯ
Раствор гидроксида натрия или калия
АlС13 + 3NaOH Al(OH)3 + 3NaCl
В избытке реактива
Al(OH)3 + 3NaOH Na3[Al(OH)6]
Выполнение реакции. К 4-5 каплям раствора соли алюминия осторожно по каплям при перемешивании добавляют 2 М раствор NaOH (или KOH) до полного растворения образующегося белого осадка гидроксида алюминия.
С ализарином
Выполнение реакции: возьмите кусочек фильтровальной бумаги и нанесите на него пипеткой 1 каплю раствора соли алюминия. Подержите бумагу в течение 1-2 мин. над открытой склянкой с концентрированным (25%) раствором NH3. На бумаге образуется Al(OH)3. В центр влажного пятна нанесите каплю ализарина и еще 1-2 мин. подержите фильтровальную бумагу над склянкой с концентрированным раствором NH3.
Подсушите фильтровальную бумагу над пламенем горелки. При этом исчезает фиолетовая окраска ализарина, а красное пятно алюминиевого лака остается.






































