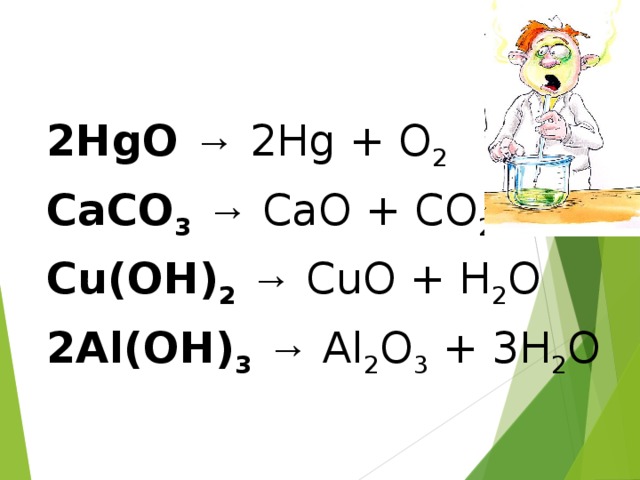Тема: Типы химических реакций
Класс: 8
Цель урока: обеспечение усвоения учащимися понятия классификации химических реакций, деления их на типы.
Задачи:
Образовательные - развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, указывать типы реакций, делать выводы и обобщения.
Развивающие - развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
Воспитательные - воспитание самостоятельности, сотрудничества, нравственных качеств - коллективизма, способности к взаимовыручке, адекватной самооценке.
Оборудование и реактивы:
компьютер
проектор
презентация "Типы химических реакций" (Приложение1.)
на столах у учащихся инструктивная карточка для проведения исследования
набор соответствующих реактивов, пробирки, спиртовка и т.п.
карточки с тестом для проверки знаний по теме: "Типы химических реакций"
смайлики для оценки эмоционального состояния учащихся во время урока.
Парты в классе расставлены так, чтобы весь класс был разделен на 4 группы, в каждой группе есть ассистент, он отмечает в учетных карточках группы положительные ответы учеников.
Тип урока: урок изучения нового материала и закрепления полученных знаний.
Методы: словесный, проблемно-поисковый, наглядный, практический, исследовательский.
Ход урока
I. Организационный этап (1 слайд) Приветствие Проверка присутствующих на уроке
II. Мотивационный этап (2 слайд)
Учитель:
Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром химических реакций.
О чем же пойдет речь на сегодняшнем уроке? (3 слайд)
Чтобы ответить на этот вопрос, попробуйте отгадать загадку: " Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
III. Актуализация опорных знаний. (беседа)
Учитель:
Так о чем же пойдет речь на сегодняшнем уроке? (О химических реакциях)
А что такое химическая реакция? (4 слайд) (Это явление, при котором из одних веществ образуются другие)
Каковы признаки химических реакций? (5 слайд) ( Изменение цвета, выпадение осадка, выделение тепла и света, выделение газа - это признаки химических реакций)
Каковы условия возникновения химических реакций? (6 слайд) (Измельчение, нагревание, соприкосновение, растворение и смешивание веществ - это условия проведения реакций)
Как много химических реакций окружает нас в жизни? (Великое множество различных реакций окружает нас в жизни )
Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций) (7 слайд)
Что такое классификация? (Деление на группы)
Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Запишите тему урока в тетрадь (8 слайд)
IV. Этап выявления существенных признаков для определения типов химических реакций.
На экране появляется 9 слайд, на котором представлены несколько химических реакций:
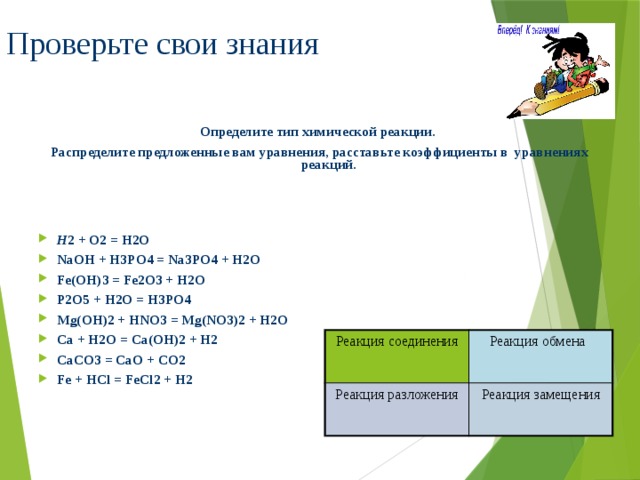
2H2 + O2 - 2H2O;
CaO + H2O - Ca(OH)2
Cu(OH)2 - CuO + H2O;
2HgO - 2Hg + O2
- можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
- различаются ли между собой реакции одной группы?
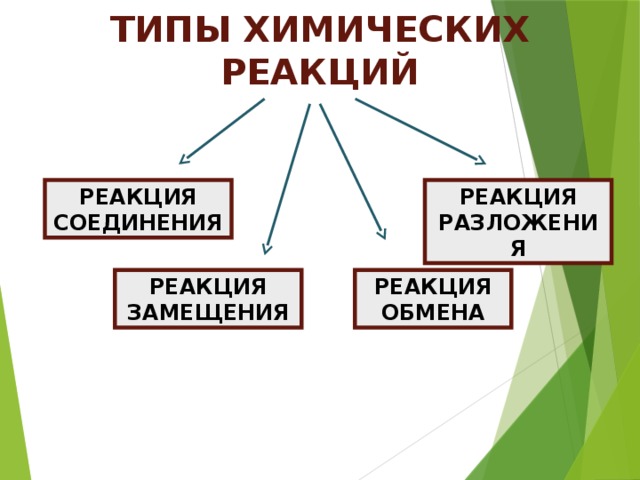
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
Введение понятия реакции соединения.
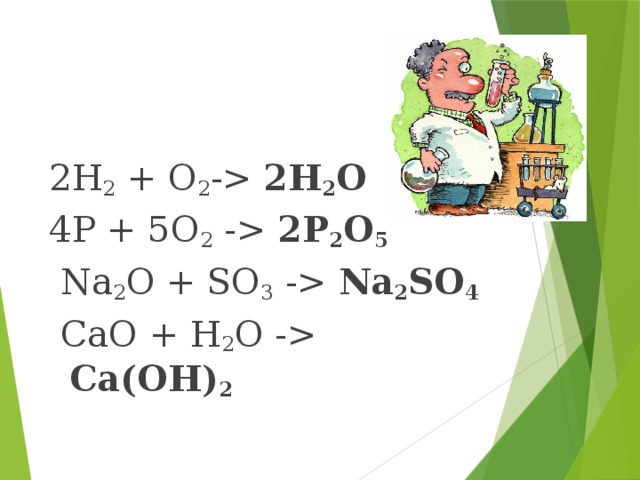
На экране появляется слайд № 10, на котором представлены реакции:
(1) 2H2 + O2- 2H2O;
(2) 4P + 5O2 - 2P2O5;
(3) Na2O + SO3 - Na2SO4;
(4) CaO + H2O - Ca(OH)2
Обсуждаются вопросы:
- что объединяет все эти реакции?
- в чём их отличие?
- как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом - сложные вещества. Во всех реакциях образуется одно сложное вещество.
Учитель предлагает учащимся попытаться вывести определение этого типа реакций (наиболее подготовленные учащиеся делают это легко) и, используя буквы А, В, С, вывести уравнение реакции соединения в общем виде:
A + B - AB
AB + CB - AB2C
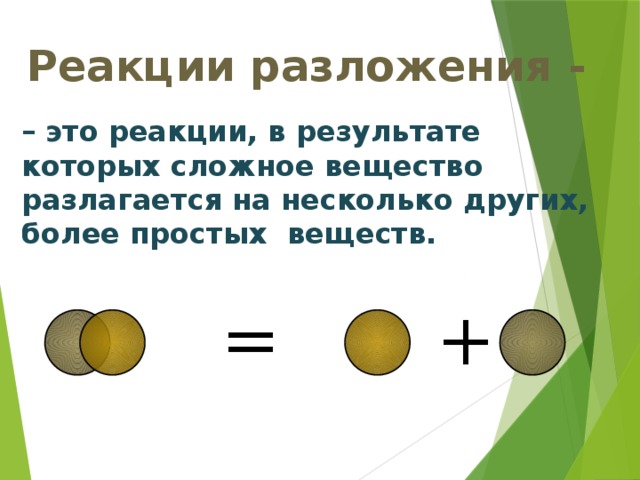
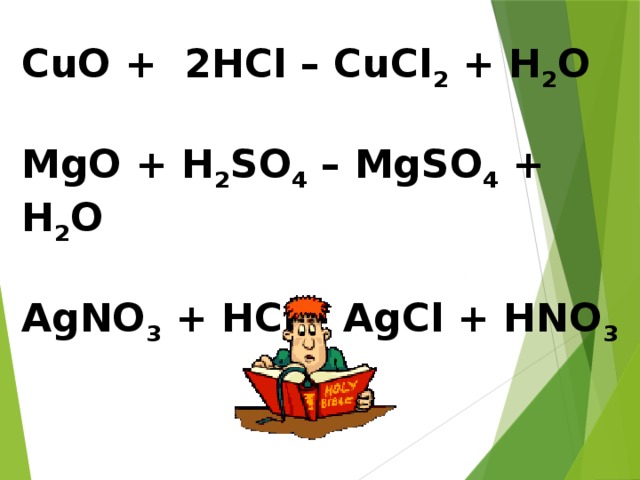
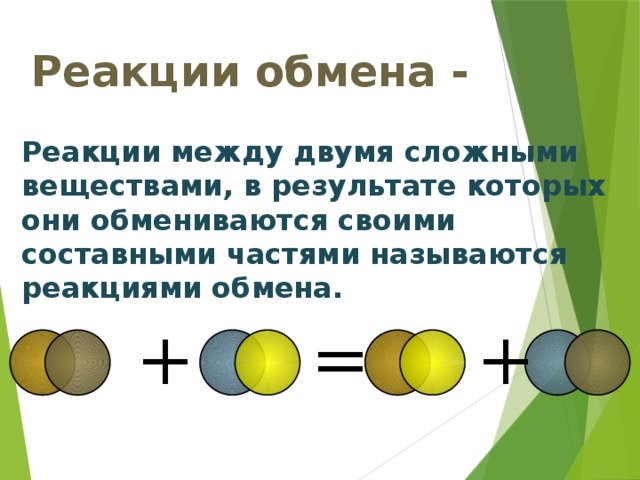
Введение понятий реакции разложения, замещения, обмена.
По такой же схеме, как и реакции соединения, изучаются реакции разложения, замещения, обмена (слайды №,11,12,13).
После изучения всех типов реакций появляется слайд № 14 и проводится обобщение материала.
Итак, мы узнали, как классифицируют химические реакции.
V. Самостоятельная работа по группам. (слайд №15)
А теперь проведем лабораторные исследования и определим, к какому типу принадлежит реакция проведенная вами.
1 группа - лабораторный опыт по реакции замещения,
2 группа - лабораторный опыт по реакции обмена,
3 группа - лабораторный опыт по реакции разложения,
4 группа - лабораторный опыт по реакции соединения.
Образец инструктивной карточки для проведения опыта:
Железный гвоздь опустите в раствор сульфата меди (II). Через 2 минуты выньте гвоздь. Что наблюдаете? Кирпично-красный цвет налета на гвозде говорит об образовании чистой меди. Спрогнозируйте, что образовалось еще? Запишите уравнения реакции. Определите тип реакции. Укажите признаки, по которым вы определили, что реакция прошла?
По одному человеку от группы отчитываются. Зачитывают уравнения реакций с комментарием. Затем на экране высвечивается правильная соответствующая запись уравнения. (слайд №16)
VI. Проверка знаний. (Рефлексия) (слайд №17)
Каждый ученик в группе получает карточку с заданием тестом и выполняет ее в течение 10 минут.
Тест состоит из 2-х частей: часть А включает 4 вопроса с выбором ответа, а часть Б - 2 вопроса на восстановление недостающих записей уравнений химических реакций.
ВАРИАНТ № 1
А.
1. (2 балла) Физическое явление – это:
а) ржавление железа
б) горение древесины
в) плавление свинца
2. (2 балла) Уравнение реакции обмена:
а) CaO + SiO2 = CaSiO3
б) FeS + 2 HCl = FeCl2 + H2S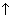
в) 2 KClO3 = 2 KCl + 3O2
3. (3 балла) По данной левой части уравнения CuO + H2SO4 = … восстановите его правую часть.
а) CuSO4 + H2O
б) CuSO4 + 2 H2O
в) CuSO4 + H2
4. (2 балла) Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) Li + O2 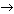 Li2O
Li2O
б) Fe2O3 + Al 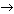 Al2O3 + Fe
Al2O3 + Fe
6. (7 баллов) Восстановите пропущенную запись и укажите тип химической реакции:
а) ? + 2 HCl = FeCl2 + H2
б) 2 Al + ? = 2 AlCl3
ВАРИАНТ № 2
А.
1. (2 балла) Химическое явление – это:
а) горение свечи
б) испарение бензина
в) плавление льда.
2. (2 балла) Уравнение реакции разложения:
а) CaO + SiO2 = CaSiO3
б) FeS + 2 HCl = FeCl2 + H2S
в) 2 KNO3 = 2 KNO2 + O2
3.(3 балла) По данной правой части уравнения … = CuCl2 + 2 H2O восстановите его левую часть.
а) Cu + 2 HCl
б) Cu(OH)2 + 2 HCl
в) CuO + 2 HCl
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) CuO + HCl 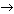 CuCl2 + H2O
CuCl2 + H2O
б) NH3 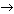 N2 + H2
N2 + H2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Fe2O3 + 3 H2 = ? + 3 H2O
б) Zn + ? = ZnCl2 + H2
ВАРИАНТ № 3
А.
1. (2 балла) Физическое явление – это:
а) испарение воды
б) горение керосина
в) скисание молока.
2. (2 балла) Уравнение реакции замещения:
а) BaO + H2O = Ba(OH)2
б) CuO + H2 = Cu + H2O
в) 3 KOH + H3PO4 = K3PO4 + 3 H2O
3. (3 балла) По данной левой части уравнения ZnO + 2 HCl =… восстановите его правую часть.
а) ZnCl2 + H2O
б) ZnCl2 + 2 H2O
в) ZnCl2 + H2
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) Fe2O3 + HCl 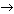 FeCl3 + H2O
FeCl3 + H2O
б) NO + O2 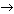 NO2
NO2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) ? + H2SO4 = ZnSO4 + H2
б) 4 Al + ? = 2 Al2O3
ВАРИАНТ № 4
А.
1. (2 балла) Химическое явление – это:
а) плавление олова
б) горение магния
в) замерзание воды..
2. (2 балла) Уравнение реакции соединения:
а) N2 + O2 = 2 NO
б) CaCO3 = CaO + CO2
в) CH4 + 2 O2 = CO2 + 2 H2O
3. (3 балла) По данной левой части уравнения Zn(OH)2 + 2 HCl = … восстановите его правую часть.
а) ZnCl2 + H2
б) ZnCl2 + H2O
в) ZnCl2 + 2 H2O
4. (2 балла) Из двух сложных веществ образуется два новых сложных вещества в реакции
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5 (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) Al2O3 + H2SO4 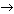 Al2(SO4)3 + H2O
Al2(SO4)3 + H2O
б) H2 + Cl2 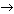 HCl
HCl
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Mg + 2 HCl = ? + H2
б) 2 Na + ? = 2 NaCl
(При наличии времени проводится взаимопроверка и оценивание друг друга).
Затем ученикам предлагается выбрать карточки с изображением смайликов характеризующих их эмоциональное состояние на уроке.
Ассистенты делают анализ работы их групп.
VII. Домашнее задание. Итоги урока. Выставление оценок. (слайд №18.)
Оформить на альбомном листе работу, где необходимо привести примеры разных типов реакций и нарисовать рисунки, иллюстрирующие эти типы.
Примеры таких работ приведены на следующих слайдах.
Если осталось время.
Дано K2SO4 + AgNO3 = … Какова правая часть уравнения? Каков тип реакции? Почему?
Расставьте коэффициенты и укажите тип реакции. Fe + Cl2 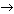 FeCl3 объяснить.
FeCl3 объяснить.







 адание 1. Подчеркните схемы реакций, которые являются химическими уравнениями.
адание 1. Подчеркните схемы реакций, которые являются химическими уравнениями. адание 2. Расставьте коэффициенты в следующих уравнениях реакций.
адание 2. Расставьте коэффициенты в следующих уравнениях реакций.





 римеры: Примеры:
римеры: Примеры: 






 2H 2 O 4P + 5O 2 - 2P 2 O 5 Na 2 O + SO 3 - Na 2 SO 4 CaO + H 2 O - Ca(OH) 2" width="640"
2H 2 O 4P + 5O 2 - 2P 2 O 5 Na 2 O + SO 3 - Na 2 SO 4 CaO + H 2 O - Ca(OH) 2" width="640"