Просмотр содержимого документа
«Урок химии "Гидролиз солей".»

Гидролиз солей.
Урок химии.


Гидролиз (греч. hydor - вода и lysis - разрушение) - процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает "слабое" - это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl - производное основания NaOH и кислоты HCl
- KNO 3 - производное основания KOH и кислоты HNO 3
- CuSO 4 - производное основания Cu(OH) 2 и кислоты H 2 SO 4
- Al 3 PO 4 - производное основания Al(OH) 3 и кислоты H 3 PO 4
- Ca(NO 2 ) 2 - производное основания Ca(OH) 2 и кислоты HNO 2

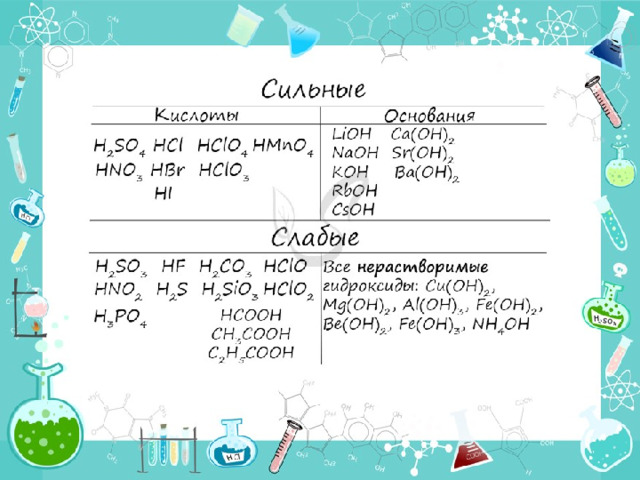
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие - сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт - она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем.

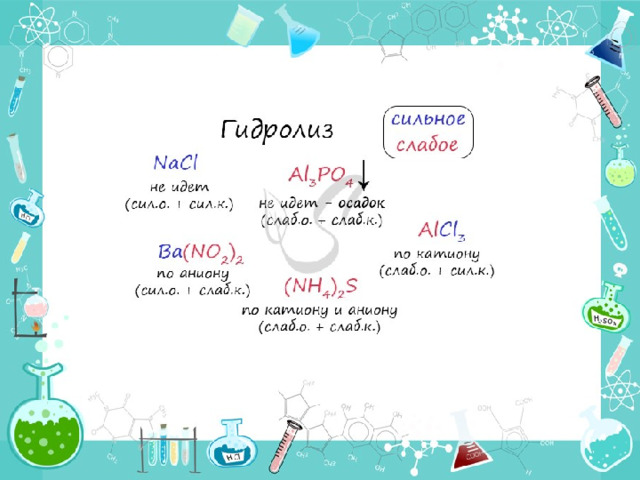
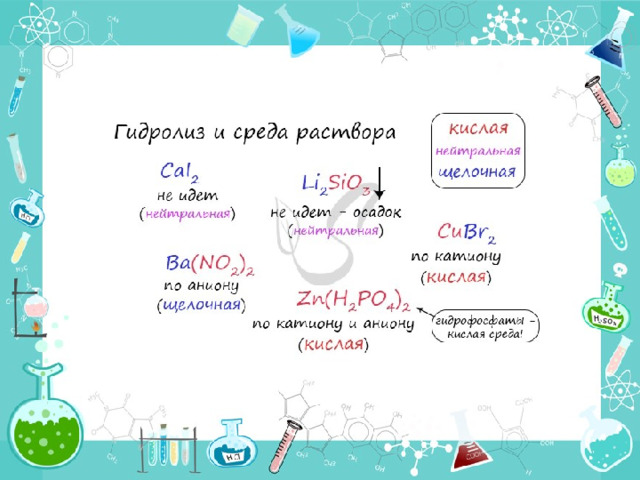
По катиону, по аниону или нет гидролиза?
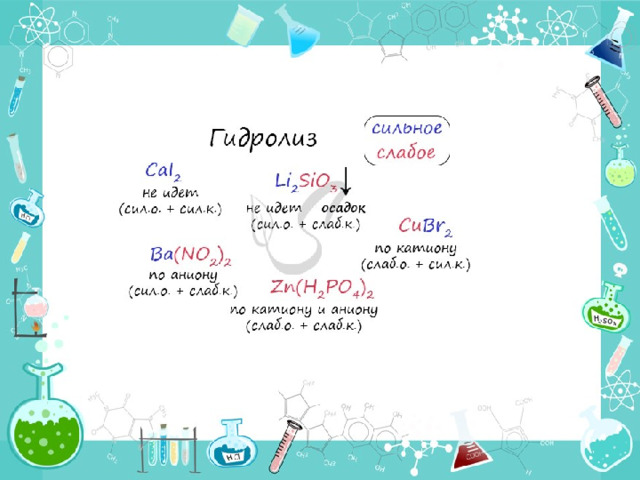
- Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты - гидролиза не происходит. Примеры: NaCl, KBr, CaSO 4 . Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO 4 , FeSO 3 , CaSO 3 .
- Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае - катион. Примеры: AlCl 3 , MgBr 2 , Cr 2 SO 4 , NH 4 NO 3 .

- Катион NH 4 + и его основание NH 4 OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH 4 Cl. Замечу также, что Ca(OH) 2 считается растворимым основанием, поэтому гидролиза соли CaCl 2 не происходит.
- Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K 3 PO 4 , NaNO 2 , Ca(OCl) 2 , Ba(CH 3 COO) 2 , Li 2 SiO 3 .
- Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO 2 ) 2 , Al 2 S 3 , Cr 2 (SO 3 ) 3 , CH 3 COONH 4 .

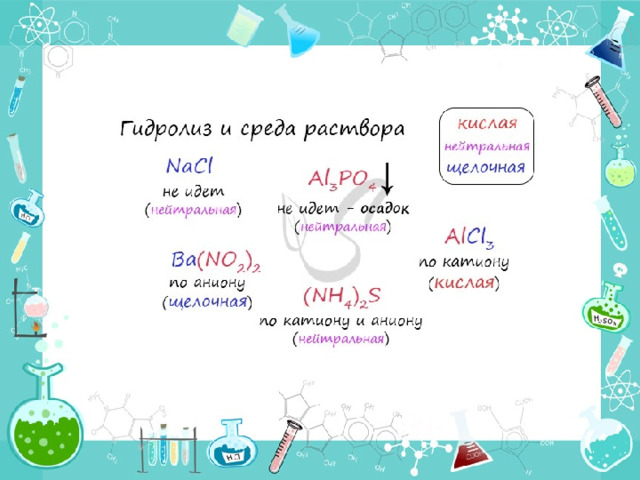
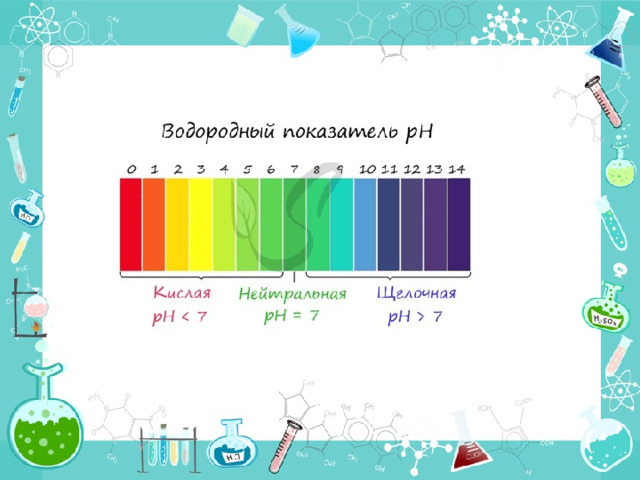
Среда раствора
- Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
- Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора - нейтральная.

- Если гидролиз идет по катиону (разрушается остаток основания) среда - кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
- Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH 4 H 2 PO 4 , LiHSO 4 . В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K 2 HPO 4 , Na 2 HPO 4 .

Индикатор - вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен менять его цвет, что наглядно отражает характер среды в определенный момент времени.

Лакмус Индикатор лакмус красный Кислоту укажет ясно. Индикатор лакмус синий - Щелочь здесь, не будь разиней! Когда ж нейтральная среда, Он фиолетовый всегда.
Фенолфталеин Фенолфталеиновый В щелочах малиновый Несмотря на это - В кислотах он без цвета.
Метиловый оранжевый От щелочи я желт как в лихорадке Я розовею от кислот, как от стыда И я бросаюсь в воду без оглядки - Здесь я оранжевый практически всегда!


https://studarium.ru/article/158
Источник:









































