Растворы. Растворение как физико-химический процесс
«Мы отнюдь не властвуем над
природой, все наше господство
состоит в том, что мы … в отличие
от всех других существ, умеем
познавать ее законы и правильно
их применять».
Ф. Энгельс.
Цель урока:
Образовательные:
Обеспечить развитие представлений о растворах, растворении как физико-химическом процессе, растворимости веществ в воде, зависимости растворимости от природы вещества, температуры и давления, кристаллогидратах.
Развивающие:
Создать условия для:
- развития мышления (учить анализировать, выделять главное, сравнивать, обобщать и систематизировать, определять понятия);
- развития мировоззрения учащихся;
- развития навыков устной и письменной речи;
- развития памяти;
- развития критического мышления.
Воспитательные:
Создать условия для воспитания самостоятельности и коммуникативности.
Способствовать развитию творческого отношения к учебной деятельности при выполнении химических опытов.
Тип урока: урок комплексного применения знаний, умений, навыков.
Вид урока: проблемно-исследовательский.
Ресурсы урока: учебник, таблицы «Растворение как физико-химический процесс», «Растворимость веществ в воде», дидактические материалы, презентация.
Методы и методические приемы: фронтальная беседа, рассказ, инструктаж, работа с таблицами и учебником, демонстрация презентации, объяснение схемы.
Оборудование: кристаллы гидроксида калия, раствор сульфата меди, стаканы с водой, стеклянная палочка, безводный медный купорос, серная кислота, нитрат аммония.
План урока:
Организационный момент
Целеполагание и мотивация
Актуализация ранее пройденного материала
Изучение нового материала
-тепловые эффекты при растворении;
-кристаллогидраты;
-растворимость веществ в воде
Закрепление материала (выполнение заданий у доски и в тетрадях учащихся)
Д/З
ХОД УРОКА:
Организационный момент (приветствие, проверка отсутствующих, организация внимания учащихся, психологический настрой учащихся)
Целеполагание и мотивация (урок начитается с эпиграфа и комментариев к нему)
«Мы отнюдь не властвуем над
природой, все наше господство
состоит в том, что мы … в отличие
от всех других существ, умеем
познавать ее законы и правильно
их применять».
Актуализация опорных знаний
В жизни мы чаще встречаемся с чистыми веществами или смесями?
Какие бывают смеси? (однородные, неоднородные)
Приведите примеры однородных смесей (растворы).
Слайд 1
С каким веществом мы чаще всего связываем понятие раствор? (вода)
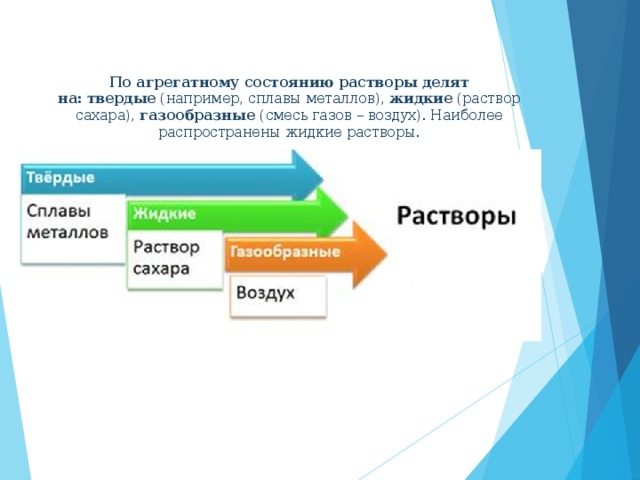
Слайд 2 Однако есть и спиртовые растворы. ДЕМ.: йод, лекарство
Это жидкие растворы. Но есть р-ры твердые и газообразные. ДЕМ.: сплавы, газообразные (воздух)
Мы более подробно будем изучать водные растворы. Почему?
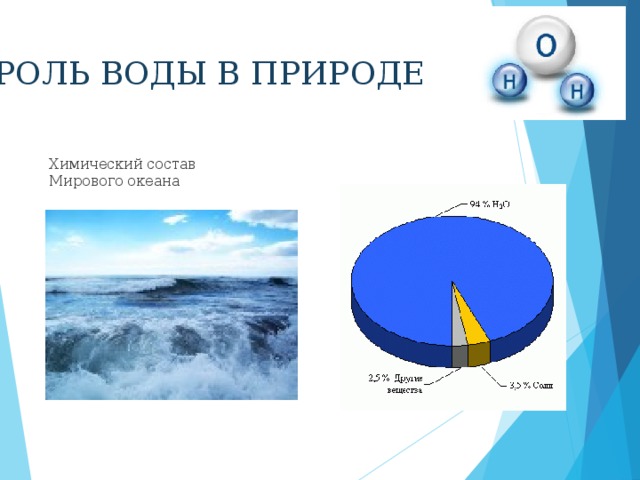
Какова роль воды в природе?
Слайд 3 В первичном океане 1% солей, в нем появились первые организмы, вышли на сушу, но сохранили в своих организмах водный раствор;
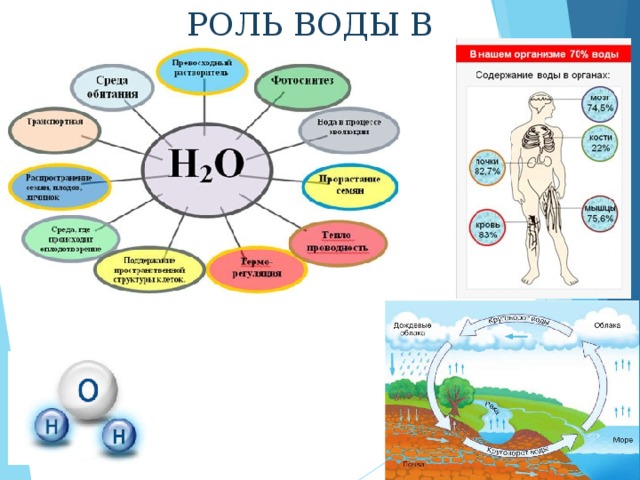
Слайд 4 В крови человека – 90 %. Пищеварение – гидролиз белков, жиров, углеводов
Слайд 5 Почвообразование. Снабжение растений питательными веществами.
Какова роль воды в технике? Получение соды, удобрений, кислот, металлов, бумаги. Каким же образом получаются растворы? Что же такое растворение? К какому явлению можно отнести растворение?
- Вспомните какими свойствами обладает вода?
- Что происходит при растворении веществ в воде?
- Вспомните как необходимо проводить растворение серной кислоты в воде? Почему? (дем. опыта)
- Что происходит при растворении нитрата аммония в воде? (дем. опыта)
-Чем отличаются эти опыты?
4.Изучение нового материала
1. Запишите свою гипотезу (научное предположение) в тетрадь.
Физическое явление: диффузия
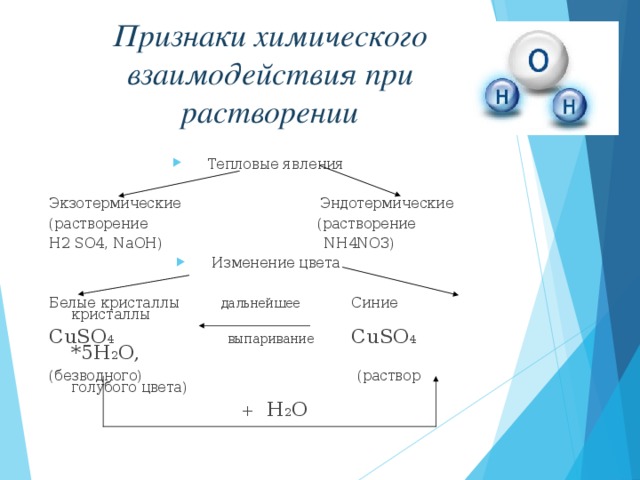
Химическое явление: изменение цвета, выпадение осадка, растворение осадка, выделение газа, поглощение или выделение тепла
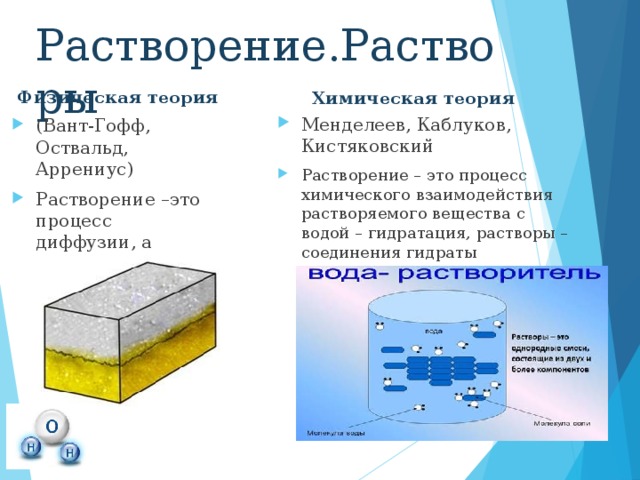
Слайд 6 Итак, наши мнения разделились. Класс разделился на 2 лагеря – сторонников физической теории растворов Вант-Гоффа, Аррениуса и Оствальда и их оппонентов – последователей химической теории растворов Д. И. Менделеева.
2. Сущность теорий растворов (Работа с учебником)
Слайд 7 Физическая теория растворов:
Растворение – это процесс диффузии, растворы – это однородные смеси
Химическая теория растворов:
Растворение – это процесс химического взаимодействия растворяемого вещества с водой – гидратация, растворы – соединения гидраты
В настоящее время считается, что растворение это физико-химический процесс. Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя.
Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
- Какие аргументы химической теории растворов вы сможете привести?
Слайд 8,9
- изменение цвета
- выделение или поглощение тепла
- многие вещества после растворения приобретают новые свойства – электропроводность
Слайд 10
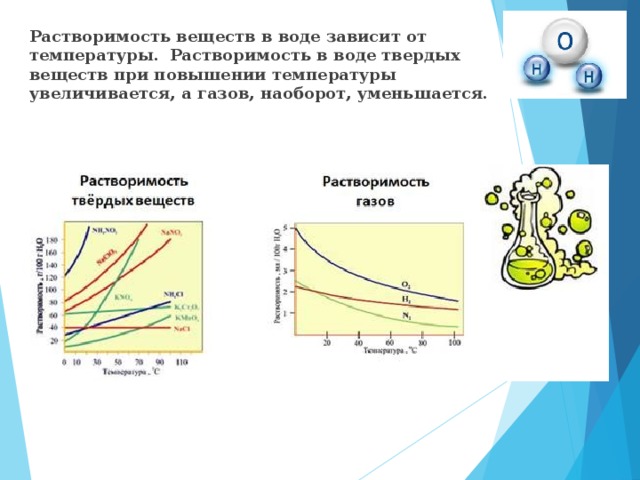
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
Слайд 11
-Какими бывают растворы?
- Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный.
Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным.
Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным.
Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
Слайд 12
- Как приготовить перенасыщенный раствор?
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.
Слайд 13
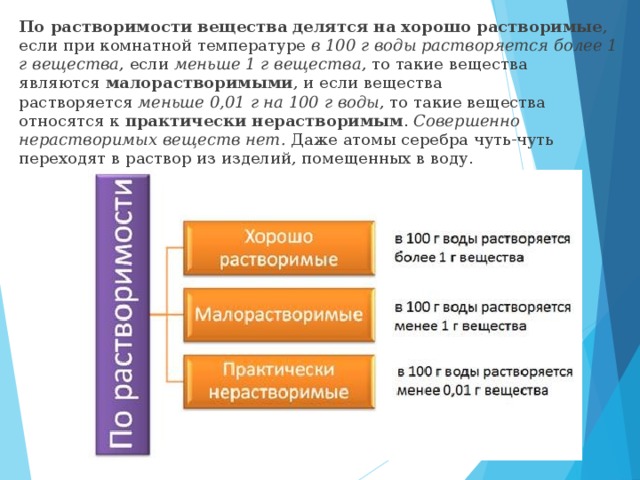
По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет.
- С помощью чего мы можем определить растворимость вещества в воде?
- Что мы должны помнить при написании уравнений в ионном виде?
- Как в уравнении такой реакции мы показываем нерастворимое в воде вещество?
5.Закрепление материала
Составьте уравнения реакций в молекулярном и ионном виде:
KOH (р) + HCl (р) = KCl(р) + H2O(ж)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O
CaO (тв) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (ж)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3- = Ca2+ + 2NO3- + H2O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O
3Mg(OH)2 (н) + 2H3PO4 (р) = Mg3(PO4)2↓(н) + 6H2O (ж)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6H2O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
CuCl2 (р) + 2KOH (р) = 2KCl(р) + Cu(OH)2↓
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2↓.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2↓.
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 3BaSO4↓ + 2Al3+ + 6Cl-
Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
Fe(OH)3 (н) + H3PO4 (р) = FePO4↓ + 3H2O.
Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3H2O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
K2S + 2HCl = 2KCl + H2S↑.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S↑.
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2NO3- = 2Na+ + CO2↑ + H2O + 2NO3-
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
3СaCO3 + 2H3РO4 = Са3(PO4)2↓ + 3H2O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3H2O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
6.Д/З §30, задание 2