11 класс. Повторение. Периодическая система. (учитель Е.В.Метейко)
Тема: «Зависимость свойств элементов от периодической смены электронных структур атомов»
Цели урока: выявить закономерности изменения металлических и неметаллических свойств элементов в периодах и в группах, причину изменения свойств элементов и их соединений, пронаблюдать периодическое изменение строения внешних электронных оболочек атомов; развивать умения выявлять причинно-следственные связи между явлениями, формировать самостоятельность суждений учащихся, интеллектуальных и учебно-коммуникативных умений и навыков.
Тип урока: усвоение новых знаний.
Методы: интерактивные технологии кооперативного обучения; работа в малых группах.
Оборудование: периодическая таблица Д.И.Менделеева.
Ход урока
I. Организационная часть урока. Сообщение темы, ознакомление с целями.
II.Основная часть урока.
2.1. Актуализация и коррекция знаний.
Интерактивная технология «Микрофон»
Что такое электроотрицательность?
Каким образом меняется радиус атомов в группах?
Как изменяется заряд ядра в периодах?
На каком месте в формулах сложных веществ, как правило, стоит более электроотрицательный элемент? Приведите примеры, когда это правило не выполняется.
Какой из элементов имеет большую электроотрицательность:
а) фтор или хлор; б) сера или фосфор; в) углерод или кремний?
Как изменяется электроотрицательность элементов в периодах? В группах?
Какая существует зависимость между радиусом атома и его электроотрицательностью?
Игровые моменты
Задание №1 «Путешествие»
1s22s2 – это гелий
Радиус атома фтора больше, чем радиус атома хлора
s-орбитали имеют сферическую форму
 да да
да да


 нет
нет

нет нет нет нет да
Период – горизонтальный ряд, начинающийся ще-лочным металлом, закан-чивающийся инертным газом
С увеличением числа электронных уровней ослабевает притяже-ние электронов к ядру
Составьте англ. слово из трех букв, написав обозначения:
-электроны
-нейтроны
-орбиталь из 5 ячеек
да да 

Ответ: 1-4-5-6
Задание №2 «Исправь ошибку»
1s22s22p1 II период III группа главная подгруппа
1s22s22p4 II период IV группа главная подгруппа
1s22s12p3 II период V группа главная подгруппа
Самостоятельная работа.
Химический диктант. Закончить предложения.
Вариант 1.
Химический элемент – это…
Количество электронных уровней в атоме можно определить…
С увеличением порядкового номера элемента в периоде радиус атома…
Электроотрицательность элементов в малых периодах…
Наиболее электроотрицательным элементом является…
На каждой орбитали может быть не больше…
Вариант 2.
В главных подгруппах электроотрицательность сверху вниз…
Порядковый номер химического элемента показывает…
По номеру группы можно определить…
С увеличением заряда ядра в периодах свойства химических элементов изменяются от…
Максимальное количество электронов на уровне можно определить по формуле…
Количество нейтронов равно…
Учащиеся в парах обмениваются своими самостоятельными работами и проверяют их. За каждое полное задание ставится 2 балла.
2.3. Новый материал
Мотивация познавательной деятельности.
Информация учителя.
Мы уже знаем, что в каждом периоде по мере увеличения зарядов атомов элементов происходит постепенное изменение структуры внешнего электронного шара. Как же с точки зрения теории строения атомов можно объяснить изменение свойств элементов в периодах от металлических к неметаллическим? В чем причина периодичности изменения свойств химических элементов? Выяснением этих вопросов мы и займемся на уроке.
Учащиеся объединяются в группы по шесть человек. Напоминаем учащимся о ролях, которые они должны поделить между собой и выполнять во время работы. Каждая группа получает задание.
Задание для 1-й группы
Дан ряд химических элементов: Li, Be, B, C, N, O, F.
Определите, по какому признаку составлен этот ряд.
Составьте электронные схемы строения атомов химических элементов.
Что в них общего?
Чем они отличаются?
Как именно происходит изменение свойств элементов в этом ряду?
Сформулируйте общий вывод: с чем связано изменение свойств химических элементов в периодах.
Задание для 2-й группы
Дан ряд химических элементов: Li, Na, K, Rb, Cs.
Определите, по какому признаку составлен этот ряд.
Составьте электронные схемы строения атомов химических элементов.
Что в них общего?
Чем они отличаются?
Как именно происходит изменение свойств элементов в этом ряду?
Сформулируйте общий вывод: с чем связано изменение свойств химических элементов в периодах.
Задание для 3-й группы
Составьте электронные схемы строения атомов:
а) неона и натрия; б) аргона и калия.
Чем отличаются по строению атомы этих химических элементов?
Как объяснить химическую инертность благородных газов с точки зрения строения атомов?
Как объяснить химическую активность щелочных металлов с точки зрения на строение атома?
Сделайте вывод: с чем связано скачкообразное изменение свойств при переходе от благородного газа до щелочного металла, то есть появление нового периода.
После выполнения работы группы по очереди озвучивают проблему, поставленную перед ними. Вносятся дополнения и изменения. Выводы фиксируются в тетрадях:
Увеличение числа внутренних оболочек является причиной наблюдаемых изменений.
В группах сверху вниз:
группах сверху вниз:
L i - увеличивается число электронных уровней;
i - увеличивается число электронных уровней;
N a - увеличиваются радиусы атомов;
a - увеличиваются радиусы атомов;

K - ослабевает притяжение электронов к ядру;

Rb - ослабевает способность присоединять электроны;

Cs - усиливаются металлические свойства.
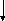


Металлические свойства усиливаются сверху вниз и справа налево.
Н
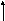
 еметаллические свойства усиливаются слева направо и снизу вверх.
еметаллические свойства усиливаются слева направо и снизу вверх.
2.4. Систематизация и обобщение знаний обучающихся
Определите, как изменяются свойства в следующих рядах:
а) Na, Mg, Al, Si;
в) I, Br, Cl, F;
c) O, S, Se, Te.
Расставьте элементы H, O, F, S, P в порядке увеличения их электроотрицательности.
Какой из металлов будет наиболее энергично взаимодействовать с водой: Ca, Zn, Ba?
Потерялся породистый оксид, принадлежащий жителю пятого подъезда. Особые приметы: имеет молекулярную массу 108. прошу вернуть за вознаграждение. Укажите номер квартиры, с которой потерялся оксид и укажите химический характер этого оксида.
III. Заключительная часть урока.
Оценивание работы учащихся за урок
Подведение итогов работы на уроке
Рефлексия:
Как вы считаете, ответили ли мы на все вопросы, поставленные в начале урока?
Что помогло при подготовке ответов на сложные вопросы, связанные со строением периодической системы Д.И.Менделеева?
Какие трудности возникли при работе?
Какая часть урока понравилась больше всего?
Удовлеиворены ли вы результатами работы на уроке?
Домашнее задание
Параграф 8, №55,56, задача 45







 да да
да да
 нет
нет



 группах сверху вниз:
группах сверху вниз: i - увеличивается число электронных уровней;
i - увеличивается число электронных уровней; a - увеличиваются радиусы атомов;
a - увеличиваются радиусы атомов;



 еметаллические свойства усиливаются слева направо и снизу вверх.
еметаллические свойства усиливаются слева направо и снизу вверх.

















