Муниципальное бюджетное образовательное учреждение
«Лицей №9 имени А.С.Пушкина Зеленодольского муниципального района Республики Татарстан»
«ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ»
(8 класс)
Theory of electrolytic dissociation'
Учитель химии высшей квалификационной категории
Чугунова Светлана Александровна
Chugunova Svetlana Alexandrovna
Представлен урок химии в 8 классе по учебнику И.И.Новошинского, Н.С.Новошинской. На уроке учащиеся знакомятся с механизмом электролитической диссоциации.
Chemistry lesson is presented for 8th grade pupil with using of textbook of I.I. Novoshinsky, N.S. Novoshinskaya. Students are acquainting with the mechanism of electrolytic dissociation during the lesson.
Глоссарий: диполь, электролит, электролитическая диссоциация, неэлектролиты, ионы, Сванте Август Аррениус.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Цель:
Формировать понятие электролитов и неэлектролитов, механизма электролитической диссоциации ковалентных и ионных соединений.
Развить навыки написания уравнений диссоциации, само- и взаимоконтроля, взаимопомощи.
Прививать интерес к предмету, способствовать выработке умения работать в коллективе.
Оборудование: прибор для электролитической проводимости растворов, NaCl, H2O, химические стаканы.
Ничего невозможно
сделать без великих людей….
Шарль де Голль
Изучение нового материала
Давайте перенесёмся в 1813 г. В Лондон, в лабораторию Королевского института, где работали двое учёных – Гемфри Дэви и Майкл Фарадей, которые начали исследование в области электричества, и понаблюдаем за их работой. Для этого проделаем несколько экспериментов. Воспользуемся прибором для определения электрической проводимости растворов.
Опыт 1. Опустим электроды в воду – лампочка не загорается.
Опыт 2. Опустим электроды в твёрдую поваренную соль – лампочка не загорается.
Опыт 3. Разведем поваренную соль в воде и опустим в раствор электроды – лампочка загорелась.
Фарадей назвал вещество, раствор которого проводит электрический ток, электролитом.
В 1889 г. В Лейпциг к Вильгельму Оствальду, профессору местного университета, приехал шведский химик Сванте Аррениус, чтобы продолжить исследования, начатые ими в Риге. Новые теории и перспективы поработать с крупнейшими европейскими химиками привлекли сюда и Ивана Алексеевича Каблукова. Около года двое учёных работали вместе. Но оставалось неясным, почему электролиты распадаются на ионы. В чём причина этого распада?
С ущность процесса растворения теоретически обосновал Д.И. Менделеев. Им была разработана гидратная теория растворов. Сущность её заключается в следующем. Атомы водорода и кислорода в воде образуют ковалентную полярную связь, общие электронные пары смещены к более электроотрицательному атому кислорода. На атоме кислорода образуется частичный отрицательный заряд, а на атомах водорода – частичный положительный заряд. Образуется диполь.
ущность процесса растворения теоретически обосновал Д.И. Менделеев. Им была разработана гидратная теория растворов. Сущность её заключается в следующем. Атомы водорода и кислорода в воде образуют ковалентную полярную связь, общие электронные пары смещены к более электроотрицательному атому кислорода. На атоме кислорода образуется частичный отрицательный заряд, а на атомах водорода – частичный положительный заряд. Образуется диполь.
При взаимодействии растворённого вещества с растворителем образуются химические соединения.
При соприкосновении кристаллов NaCl с водой происходит яростная атака молекул соли молекулами воды. При этом положительные концы молекул воды притягиваются к отрицательным ионам Cl-, а отрицательные – к положительным ионам Na+. При этом идёт разрыв связей между NaCl и образуются отдельные ионы Na+ и Cl-.



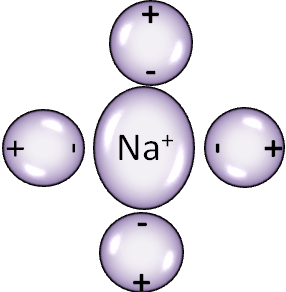

Электролиты – кислоты, основания или соли, водные растворы или расплавы которых проводят электрический ток.
Электролитическая диссоциация – распад электролита при его растворении в воде или расплавлении на ионы.
Вещества, растворы и расплавы которых не проводят электрический ток, называются неэлектролитами (имеют ковалентные неполярные или малополярные связи).
К сильным электролитам относятся:
HCl, HNO3, H2SO4, HClO4 в разбавленных растворах;
LiOH, NaOH, KOH, Ca(OH)2 и др.;
Почти все соли.
К слабым электролитам относят:
H2O
H2S, H2SO3, H2CO3, HCN, H2SiO3, H3BO3, CH3COOH, H3PO4 и д.
Al(OH)3, Cu(OH)2, Fe(OH)2 , Fe(OH)3 и др.
NH4OH
Некоторые соли: ZnCl2, Fe(NCS)3, Hg(CN)2 и др.
Водные растворы кислот имеют кислый вкус. В формулах кислот общей частицей является атом водорода и можно предположить, что он (в виде иона) является причиной одинакового вкуса всех этих столь различных веществ. Образующиеся при диссоциации в водном растворе ионы водорода придают раствору кислый вкус, поэтому такие вещества и называют кислотами. В природе только ионы водорода имеют кислый вкус. Они создают в водном растворе так называемую кислотную (кислую) среду. Это вещества с ковалентной полярной связью.

 HCl H+ + Cl-
HCl H+ + Cl-

 H2SO4 H+ + SO4-
H2SO4 H+ + SO4-
Водные растворы имеют одинаково неприятный горько-мыльный вкус и вызывают на коже ощущение скольжения. По видимому, за это свойство ответственны гидроксид-ионы ОН-, входящие в состав таких соединений. Это соединения с ионной связью.
N
 aOH Na+ + OH-
aOH Na+ + OH-

 Ca(OH)2 Ca2+ + 2OH-
Ca(OH)2 Ca2+ + 2OH-
Соли тоже относятся к соединениям с ионной связью.
N
 aCl Na+ + Cl-
aCl Na+ + Cl-

 CaCl2 Ca2+ + 2Cl-
CaCl2 Ca2+ + 2Cl-
N
 a2CO3 2Na+ + CO32-
a2CO3 2Na+ + CO32-
Суммы зарядов положительных и отрицательных ионов, образующихся при электрической диссоциации вещества равны по абсолютной величине.
Электрическая диссоциация у многоосновных кислот проходит ступенчато.
H
 3PO4 H+ + H2PO4-
3PO4 H+ + H2PO4-

 H2PO4- H+ + HPO42-
H2PO4- H+ + HPO42-

 HPO42- H+ + PO43-
HPO42- H+ + PO43-
В водном растворе диссоциация проходит лишь по первой ступени. Ступенчато могут диссоциировать и гидроксиды:

 Fe(OH)3 Fe(OH)2+ + OH-
Fe(OH)3 Fe(OH)2+ + OH-

 Fe(OH)2+ FeOH2+ + OH-
Fe(OH)2+ FeOH2+ + OH-
F
 eOH2+ Fe3+ + OH-
eOH2+ Fe3+ + OH-
За признание заслуг в развитии химии, достигнутых теорией электролитической диссоциации шведскому учёному Сванте Августу Аррениусу в 1903 г. Была присуждена третья нобелевская премия по химии.
Закрепление знаний
В городе Зеленодольске в лицее №9 в кабинете №305 в первом ряду на первой парте была оставлена…..лужа (!!!!) неизвестного происхождения. Эксперты установили, что в её состав входят ионы: Al3+, NO3-,Ca2+, Cl-, K+. Растворы каких веществ могли разлить преступники?
Al(NO3)3 , AlCl3, Ca(NO3)2, KNO3, CaCl2 , KCl
Игра «Третий лишний»
NaOH, раствор кислоты, сера
Заведомо ложное умозаключение, построенное на неправильных положениях, называется «софиумом». Попробуйте опровергнуть предложенный софиум:
«Если встать в лужу, в которой лежит оголённый провод, находящийся под напряжением, можно получить смертельный удар током. Следовательно, вода проводит электрический ток»
Когда в 1887 г. появились первые работы Сванте Аррениуса по диссоциации, его оппоненты (научные противники) приводили убийственные доводы против диссоциации. Например, «при растворении хлорида натрия мы получаем солёную воду, которая не только не причиняет вреда организму человека, но, напротив, полезна ему. Если принять точку зрения Аррениуса, то образовавшийся при диссоциации натрий тут же вступит в реакцию с водой». Аррениус быстро нашёл ошибку в рассуждениях оппонентов. А вы сможете это сделать?
Минеральная вода одного из источников содержит ионы Na+, K+, Mg2+, Ca2+, Cl-, HCO3-, SO42-. Какие соли растворены в воде?
NaHCO3, KHCO3, Na2SO4, K2SO4, NaCl, KCl,
Mg(HCO3)2, MgSO4, MgCl2, Ca(HCO3)2, CaSO4, CaCl2
В водных растворах каких веществ есть: а) ионы водорода; б) гидроксид-ионы.
LiOH, Ba(OH)2, Na3PO4, Ca(OH)2, H3PO4
Д/З: §38 (учебник И.И.Новошинскиий, Н.С.Новошинская).







 ущность процесса растворения теоретически обосновал Д.И. Менделеев. Им была разработана гидратная теория растворов. Сущность её заключается в следующем. Атомы водорода и кислорода в воде образуют ковалентную полярную связь, общие электронные пары смещены к более электроотрицательному атому кислорода. На атоме кислорода образуется частичный отрицательный заряд, а на атомах водорода – частичный положительный заряд. Образуется диполь.
ущность процесса растворения теоретически обосновал Д.И. Менделеев. Им была разработана гидратная теория растворов. Сущность её заключается в следующем. Атомы водорода и кислорода в воде образуют ковалентную полярную связь, общие электронные пары смещены к более электроотрицательному атому кислорода. На атоме кислорода образуется частичный отрицательный заряд, а на атомах водорода – частичный положительный заряд. Образуется диполь. 





 HCl H+ + Cl-
HCl H+ + Cl-


















