

Установите соответствие «Класс вещества – функциональная группа»
Класс вещества
Функциональная группа
1. Многоатомные спирты
А) Альдегидная
- COH
2. Альдегиды
Б) Карбоксильная
- COOH
3. Карбоновые кислоты
В) Гидроксильные
- OH

ПРОВЕРЯЕМ «Класс вещества – функциональная группа»
Класс вещества
Функциональная группа
1. Многоатомные спирты
В) Гидроксильные
- OH
2. Альдегиды
А) Альдегидная
- COH
3. Карбоновые кислоты
Б) Карбоксильная
- COOH

Установите соответствие «Класс вещества –качественная реакция»
Название вещества / функциональная группа
Качественная реакция
1. Многоатомные спирты (гидроксильные)
А)
С металлами (выделение Н 2 );
Изменение окраски индикатора.
2. Альдегиды (альдегидная)
Б)
С Cu (ОН ) 2 , (ярко синее окрашивание).
3. Карбоновые кислоты (карбоксильная)
В)
С Ag 2 O ( Реакция «Серебряного зеркала» ) ;
С Cu (ОН ) 2 , при нагревании (морковный цвет).

ПРОВЕРЯЕМ «Класс вещества –качественная реакция»
Название вещества / функциональная группа
Качественная реакция
1. Многоатомные спирты (гидроксильные)
Б)
С Cu (ОН ) 2 , (ярко синее окрашивание).
2. Альдегиды (альдегидная)
В)
С Ag 2 O ( Реакция «Серебряного зеркала» ) ;
С Cu (ОН ) 2 , при нагревании (морковный цвет).
3. Карбоновые кислоты (карбоксильная)
А)
С металлами (выделение Н 2 );
Изменение окраски индикатора.

КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Спирты Альдегиды Углеводы
Карбоновые кислоты Жиры Эфиры
ЧТО ОБЪЕДИНЯЕТ ЭТИ РАСТЕНИЯ ?


Углеводы (сахара) - органические вещества, состав которых выражается формулой Cx(H 2 O)y, где x и y 3.
Углеводы – важнейшие природные соединения. Они содержатся в клетках и тканях всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле.
Углеводы образуются растениями в процессе фотосинтеза из углекислого газа и воды.
ФОТОСИНТЕЗ: xCO 2 + yH 2 O + энергия Cx ( H 2 O ) y + xO 2
углеводы

КЛАССИФИКАЦИЯ
По способности к гидролизу углеводы делятся на две группы:
1. Простые – моносахариды:
Триозы, тетрозы, пентозы
гексозы ( ГЛЮКОЗА , фруктоза).
2. Сложные:
Дисахариды (сахароза).
Полисахариды (крахмал, целлюлоза)
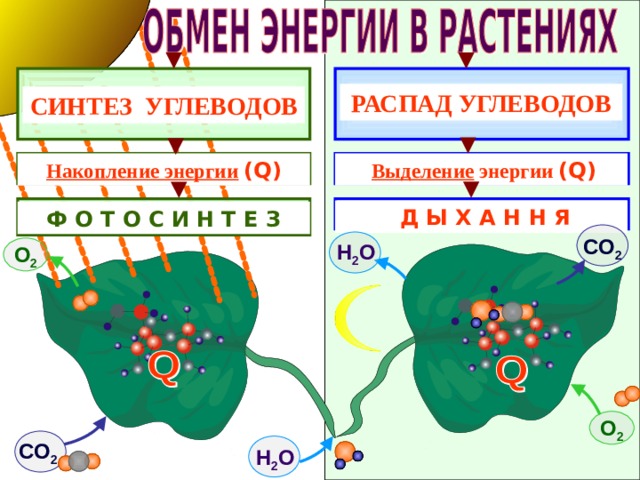
РАСПАД УГЛЕВОДОВ
СИНТЕЗ УГЛЕВОДОВ
Выделение энергии ( Q )
Накопление энергии ( Q )
Д Ы Х А Н Н Я
Ф О Т О С И Н Т Е З
СО 2
Н 2 О
О 2
О 2
СО 2
Н 2 О


МОНОСАХАРИДЫ
Для моносахаридов не характерна реакция гидролиза.
Наиболее яркие представители моносахаридов – глюкоза и фруктоза С 6 Н 12 O 6
Глюкоза ↔ Фруктоза
изомеры

Дисахариды - сахароза С 12 Н 22 O 11
Дисахариды - это углеводы, молекулы которых состоят из двух остатков моносахаридов.
Примером наиболее распространенных в природе дисахаридов является сахароза (свекловичный или тростниковый сахар). Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы.
Для дисахаридов характерна реакция гидролиза под действием кислот или ферментов, в результате которой образуются моносахариды:
С 12 Н 22 O 11 + H 2 O 2 С 6 Н 12 O 6

Полисахариды
Наиболее распространенный полисахарид - крахмал (С 6 Н 10 O 5 ) n .
Он образуется в растениях в результате фотосинтеза.
Раствор йода окрашивает крахмал в темно-синий цвет.
При нагревании в присутствии катализаторов или под действием ферментов крахмал гидролизируется, превращаясь в глюкозу:
(С 6 Н 10 O 5 ) n + ( n -1) H 2 O n С 6 Н 12 O 6

Полисахариды
Целлюлоза (С 6 Н 10 O 5 ) n имеет такой же химический состав, как и крахмал, но состоит она из неразветвленных молекул. Целлюлоза - волокнистое, нерастворимое в воде вещество. С йодом не взаимодействует.
Целлюлоза гидролизируется, образуя в итоге глюкозу:
(С 6 Н 10 O 5 ) n + ( n -1) H 2 O n С 6 Н 12 O 6

Установите соответствие «УГЛЕВОД – НАХОЖДЕНИЕ В ПРИРОДЕ»
А. Сахароза
Б. Крахмал
В. Целлюлоза
Г. Глюкоза
Д. Фруктоза и глюкоза
1
2
3
4
5

ПРОВЕРЯЕМ «УГЛЕВОД – НАХОЖДЕНИЕ В ПРИРОДЕ»
-Г. Глюкоза
-В. Целлюлоза
-Б. Крахмал
-А. Сахароза
-Д. Фруктоза и глюкоза
1
2
1
2
3
4
3
4
5
5

ГЛЮКОЗА.
Молекулярный состав глюкозы С 6 Н 12 О 6 .
А как будет выглядеть структурная формула?
УСТАНОВИМ ОСОБЕННОСТИ СТРОЕНИЯ ГЛЮКОЗЫ?

ОПЫТ 1

ОПЫТ 2


ГЛЮКОЗА.
Молекулярный состав глюкозы С 6 Н 12 О 6 .
Особенностью строения является наличие:
- альдегидной группы – СОН (сходство с альдегидами);
- пяти гидроксильных групп -ОН (сходство с многоатомными спиртами).
ГЛЮКОЗА – АЛЬДЕГИДОСПИРТ.
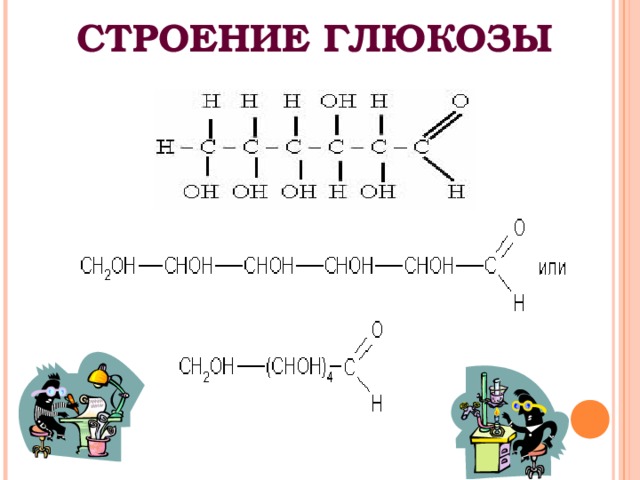
СТРОЕНИЕ ГЛЮКОЗЫ

РЕАКЦИИ ПО АЛЬДЕГИДНОЙ ГРУППЕ
1) Взаимодействие с аммиачным раствором Ag 2 O (реакция серебренного зеркала):
СН 2 ОН – (СНОН) 4 – СОН + Ag 2 O →
→ СН 2 ОН – (СНОН) 4 – СООН + + 2Ag↓
2) Взаимодействие Cu(OH) 2 (при нагревании):
СН 2 ОН – (СНОН) 4 – СОН + 2С u (ОН) 2 →
→ СН 2 ОН – (СНОН) 4 – СООН + С u 2 О + 2Н 2 О

РЕАКЦИИ ПО ГИДРОКСИЛЬНЫМ ГРУППАМ
Образование комплексных соединений синего цвета с С u (ОН) 2 гидроксидом меди ( II ) – качественная реакция на гидроксильные группы (многоатомные спирты).

РЕАКЦИИ БРОЖЕНИЯ ГЛЮКОЗЫ
а) спиртовое брожение
C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2
б) молочнокислое брожение
C 6 H 12 O 6 2CH 3 -CH(OH)-COOH
(молочная кислота)

ПОЛУЧЕНИЕ
Гидролиз крахмала
(С 6 Н 10 O 5 ) n + ( n -1) H 2 O n С 6 Н 12 O 6

УСТАНОВИТЕ СООТВЕТСТВИЕ «Свойства глюкозы - применение»
1. Сладкий вкус
А. При квашении капусты, огурцов, молока …
2. Окисление в организме, с выделением энергии
Б. В алкогольной промышленности
3. Молочно – кислое брожение
В. В кондитерской промышленности
4. Спиртовое брожение
Г. В медицине

ПРОВЕРЯЕМ «Свойства глюкозы - применение»
1. Сладкий вкус
В. В кондитерской промышленности
2. Окисление в организме, с выделением энергии
Г. В медицине
3. Молочно – кислое брожение
А. При квашении капусты, огурцов, молока …
4. Спиртовое брожение
Б. В алкогольной промышленности
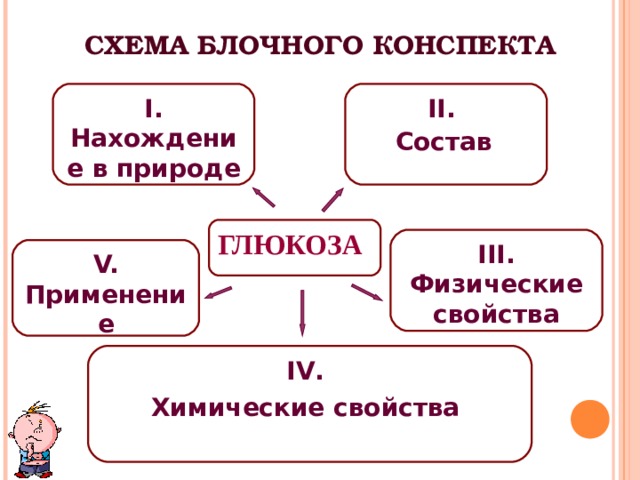
СХЕМА БЛОЧНОГО КОНСПЕКТА
II .
Состав
I. Нахождение в природе
ГЛЮКОЗА
III. Физические свойства
V. Применение
IV .
Химические свойства
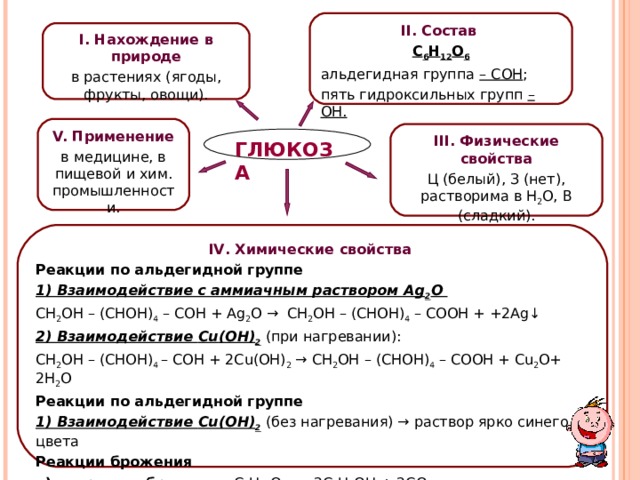
II . Состав
С 6 Н 12 О 6
альдегидная группа – СОН ;
пять гидроксильных групп – ОН.
I. Нахождение в природе
в растениях (ягоды, фрукты, овощи).
V. Применение
в медицине, в пищевой и хим. промышленности.
III. Физические свойства
Ц (белый), З (нет), растворима в Н 2 О, В (сладкий).
ГЛЮКОЗА
IV . Химические свойства
Реакции по альдегидной группе
1) Взаимодействие с аммиачным раствором Ag 2 O
СН 2 ОН – (СНОН) 4 – СОН + Ag 2 O → СН 2 ОН – (СНОН) 4 – СООН + +2Ag↓
2) Взаимодействие Cu ( OH ) 2 (при нагревании):
СН 2 ОН – (СНОН) 4 – СОН + 2С u (ОН) 2 → СН 2 ОН – (СНОН) 4 – СООН + С u 2 О+ 2Н 2 О
Реакции по альдегидной группе
1) Взаимодействие Cu ( OH ) 2 (без нагревания) → раствор ярко синего цвета
Реакции брожения
а) спиртовое брожение C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2
б) молочнокислое брожение C 6 H 12 O 6 2CH 3 -CH(OH)-COOH

Я успел качественно выполнить работу!
Я молодчина!
Я хорошо подготовился к уроку!
Я с работой не справился, в следствии не качественной подготовки к уроку.
На следующем уроке я буду чувствовать себя так











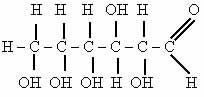






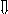

 ЦЕНИТЕ УСПЕШНОСТЬ СВОЕЙ РАБОТЫ
ЦЕНИТЕ УСПЕШНОСТЬ СВОЕЙ РАБОТЫ
 Я с работой не справился в следствии плохой подготовки к уроку.
Я с работой не справился в следствии плохой подготовки к уроку. 

















































