
МКОУ «Совхозная СОШ», Бахтин В.В., учитель химии. 2017г.
Алюминий и его соединения

Положение в Периодической системе
- Алюминий располагается в 3 периоде, в главной подгруппе 3 группы.
- Порядковый номер элемента – 13
- Относительная атомная масса – 27
- Алюминий – металл, соединения которого обладают амфотерными свойствами.

Строение атома алюминия
- Заряд ядра атома алюминия +13
- В атоме 3 энергетических уровня
- Электронная оболочка атома алюминия содержит
s - и p -электроны
- На внешнем электронном уровне 3 электрона (2 – спаренных s- электрона и 1 – неспаренный p- электрон)

Нахождение в природе
- По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.

Получение алюминия
- Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы.
AlCl 3 + 3K = 3KCl + Al
- В настоящее время алюминий получают электролизом оксида:
эл.ток
2 Al 2 O 3 = 4 Al + 3O 2 – 3352 кДж

Физические свойства
- плотность (при 20°С) 2698,9 кг/м3;
- t пл 660,24°С;
- t кип около 2500°С;
Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопровод-ность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии).
На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al 2 О 3 , защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.

Химические свойства
4 Al + 3O 2 = 2Al 2 O 3
4 Al 0 - 3 ē → Al +3 окисление, восстановитель
3 O 2 0 + 4ē → 2O -2 восстановление, окислитель
- Вытесняет водород из воды
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ↑
4 Al 0 - 3 ē → Al +3 окисление, восстановитель
3 2H +1 + 2ē → H 2 0 восстановление, окислитель

Химические свойства
- Взаимодействует с кислотами:
2Al + 6HCl = 2AlCl 3 + 3H 2 ↑
2Al + 6H + + 6 Cl - = 2Al 3+ + 6Cl - + 3H 2 ↑
2Al + 6H + = 2Al 3+ + 3H 2 ↑
- Взаимодействует со щелочами:
2 Al + 2H 2 O + 2NaOH = 2NaAlO 2 + 3H 2 ↑
2Al + 2 H 2 O + 2Na + + 2OH - = 2Na + + 2AlO 2 - + 3H 2 ↑
2Al + 2 H 2 O + 2OH - = 2AlO 2 - + 3H 2 ↑

Химические свойства
- Вытесняет металлы из их оксидов
(алюминотермия):
8 Al + 3Fe 3 O 4 = 9Fe + 4Al 2 O 3
8 Al 0 - 3 ē → Al +3 – окисление, восстановитель
3 24 Fe +2 + 2ē → Fe 0 – восстановление, ок-ль
3 2 Fe +3 + 6 ē → 2 Fe 0 – восстановление, ок-ль

Соединения алюминия. Оксид
- Очень твердый порошок белого цвета.
- Образуется:
а) при окислении или горении алюминия:
4 Al + 3O 2 = 2Al 2 O 3
б) в реакции алюминотермии:
2 Al + Fe 2 O 3 = 2 Fe + Al 2 O 3
в) при термическом разложении гидроксида:
2Al(OH) 3 = Al 2 O 3 + H 2 O

Химические свойства оксида алюминия
Al 2 O 3 по характеру амфотерный оксид.
Взаимодействует:
а) с кислотами:
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 6H + + 3SO 4 2- = 2Al 3+ + 3SO 4 2- + 3H 2 O
Al 2 O 3 + 6H + = 2Al 3+ + 3H 2 O
б) со щелочами:
Al 2 O 3 + 6NaOH = 2Na 3 AlO 3 + 3H 2 O
Al 2 O 3 + 6Na + + 6OH - = 6Na + + 2AlO 3 3- + 3H 2 O
Al 2 O 3 + 6OH - = 2AlO 3 3- + 3H 2 O

Гидроксид алюминия
- Белый нерастворимый в воде порошок
- Проявляет амфотерные свойства.
- Взаимодействует:
а) с кислотами:
Al(OH) 3 + 3HNO 3 = Al(NO 3 ) 3 + 3H 2 O
Al(OH) 3 + 3H + + 3NO 3 - = Al 3+ + 3NO 3 - + 3H 2 O
Al(OH) 3 + 3H + = Al 3+ + 3H 2 O
б) со щелочами:
Al(OH) 3 + 3 KOH = K 3 AlO 3 + 3H 2 O
Al(OH) 3 + 3 K + + 3OH - = 3K + + AlO 3 3- + 3H 2 O
Al(OH) 3 + 3OH - = AlO 3 3- + 3H 2 O
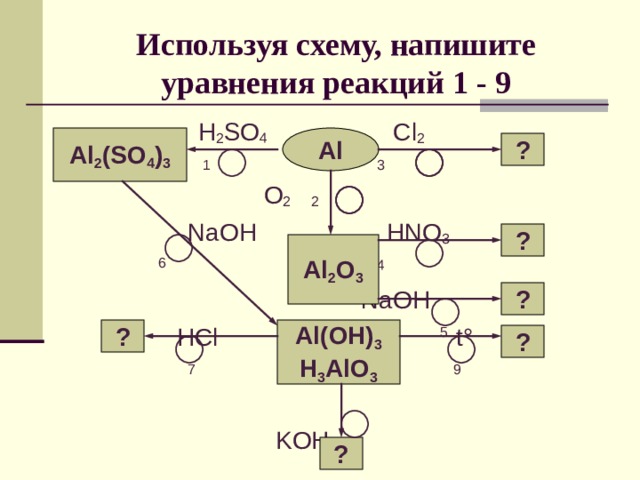
Используя схему, напишите уравнения реакций 1 - 9
H 2 SO 4 Cl 2
1 3
O 2 2
NaOH HNO 3
6 4
NaOH
HCl 5 t °
7 9
KOH 8
Al 2 (SO 4 ) 3
Al
?
?
Al 2 O 3
?
?
Al(OH) 3
H 3 AlO 3
?
?







































