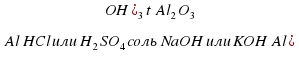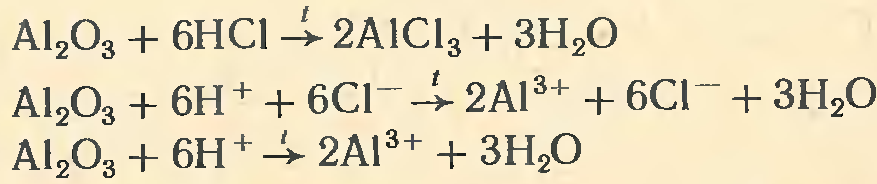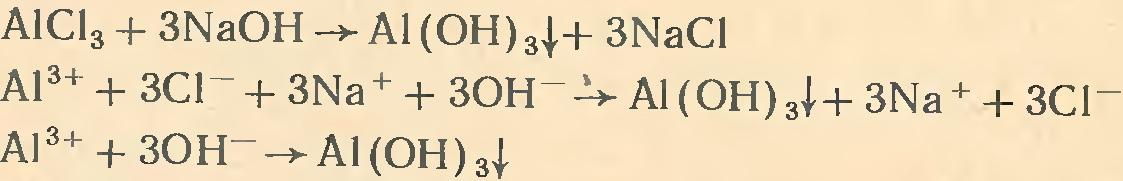Урок № 38
Дата:« » 20 год
Класс:9
Тема:Алюминий и его соединения
Цели урока:
Образовательная: познакомить учащихся с физическими и химическими свойствами алюминия и его соединений
Развивающая: развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения.
Воспитывающая: воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Тип урока: изучение нового материала
Вид урока: нетрадиционный
Оборудование: ПСХЭ Д. И. Менделеева, ЭХРНМе, интерактивная доска, презентация
Прогнозируемый результат: Учащиеся знают физические, химические свойства алюминия и его соединений.
План урока:
Организационный момент.
Приветствие
Психологический настрой
Проверка д/з.
Составление кластера «Жесткость воды и способы ее устранения.»
Изучение нового материала
Объяснение
А) стратегия «Знаю-Хочу узнать-Узнал»
Б) стратегия «Джигсо-2»
Закрепление нового материала
Фронтальный опрос
Выполнение упражнений.
Подведение итогов
1. Комментирование оценок
2. Рефлексия
Домашнее задание.
Ход урока
Организационный момент.
Приветствие
Психологический настрой
Проверка д/з.
Составление кластера «Жесткость воды и способы ее устранения.»
Объяснение нового материала
Объяснение
А) стратегия «Знаю-Хочу узнать-Узнал»
| Деятельность учителя | Деятельность учеников |
| Вызов | 1. Целеполагание. | 1. Совместно с учителем ставят цели урока. |
| 2. Организует заполнение таблицы ЗХУ учащимися. | 2. Заполняют таблицу ЗХУ |
| 3. Заполняет таблицу на доске. | 3. Фронтальная беседа. |
| Осмысление | 4. Организует работу с текстом. | 4. Чтение текста с пометками, индивидуальное заполнение в таблице графы “узнал”. Обсуждение друг с другом в группах результатов заполнения таблицы. |
| 5. Заполняет со слов учащихся графу “узнал” на доске. | 5. Фронтальная беседа. |
| Рефлексия | 6. Организует проведение демонстрационных опытов. | 6. Экспериментальнодоказывают свойства амфотерности алюминия. Пишут уравнения в ионном виде на оценку. |
| 7. Задает вопросы по тексту: 1) Почему алюминий был дорог в XIX веке? 2) Как будет выглядеть полное ионное уравнение взаимодействия гидроксида алюминия со щелочью? 3) Как гидроксид алюминия с точки зрения химии понижает кислотность желудочного сока? | 7. Фронтальное обсуждение с опорой на текст. Заполняют IV графу в таблице “что бы еще хотели узнать о соединениях алюминия”. |
| 8. Подводит итоги урока, возвращается к целям урока. | 8. Составляют по группам кластер. |
Б) стратегия «Джигсо-2»
Алюминий находится в главной подгруппе III группы. Схема расположения электронов по энергетическим уровням и орбиталям следующая:
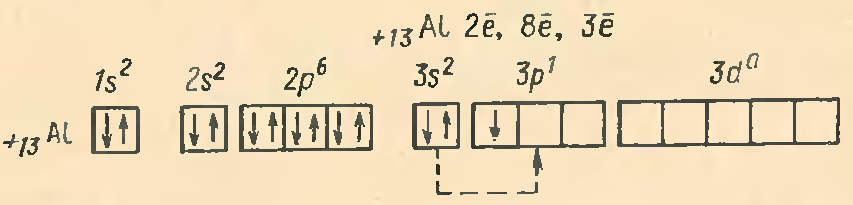
В атоме алюминия легко происходит распаривание 3s2-электронов и один электрон переходит на 3 р-орбиталь. В результате получаются три неспаренных электрона. Этим объясняется, что алюминий проявляет степень окисления +3.
Нахождение алюминия в природе,его получение и свойства. Алюминий — третий по распространенности элемент в земной коре. Он встречается только в соединениях.
Получение. Немецкий химик Ф. Вёлер в 1821 г. получил алюминий при нагревании хлорида алюминия с щелочными металлами калием и натрием без доступа воздуха:
А1С13 + 3К→ 3КС1 + А1
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан метод получения алюминия из бокситов.

Физические свойства. Алюминий — серебристо-белый металл, легкий (р=2,7 г/см3), плавится при 660°С. Он очень пластичен, легко вытягивается в проволоку и прокатывается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 электрической проводимости меди).
Химические свойства. В электрохимическом ряду напряжения алюминий помещен сразу за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода, даже при температуре ее кипения. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl2→2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью — амальгама алюминия. На амальгамированной поверхности оксидная пленка удерживаться не может, поэтому алюминий реагирует с водой при обычных условиях:
2А1 + 6НОН→2А1(ОН)3↓+ 3H2
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:
4 Al + 3O2 = 2 Al2O3
2 Al + 3 Cl2 = 2 AlCl3
2 Al + 3S = Al2S3
2Al+6HCl = 2AlCl3 + 3H2
2Al+2NaOH = 2NaAlO2 + H2
2 Al + 3CuSO4 =Al2(SO4)3 +3 Cu
Применение. Алюминий применяется для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины — сплавы алюминия с кремнием. Основные преимущества этих сплавов — легкость и высокая прочность. Упомянутые сплавы широко используются в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используется также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
Важнейшие соединения алюминия. Оксид алюминия А1203 можно получить следующими путями:
Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
4А1+3 О2 → 2А1203
За счет превращения по приведенной ниже схеме:
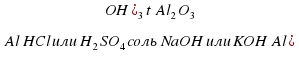
Оксид алюминия — твердое, тугоплавкое (темп.пл. 2050°С) вещество белого цвета.
По химическим свойствам — это амфотерный оксид. С кислотами реагирует с трудом, проявляет свойства основных оксидов:
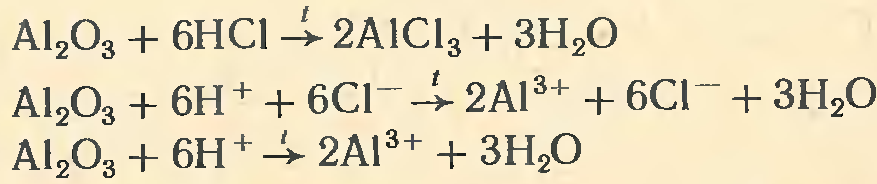
Оксид алюминия реагирует со щелочами и проявляет свойства кислотных оксидов. Причем при сплавлении образуются соли метаалюминиевой кислоты НAlO2, т. е. метаалюминаты:

В присутствии воды реакция протекает иначе:
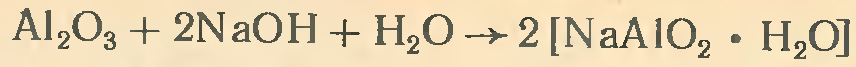
В водном растворе алюминат натрия NaA102присоединяет одну или две молекулы воды. Это можно изобразить так: a) NaA102• Н20 или NaH2A103; б) NaA102•2Н2О или Na[А1 (ОН) 4].
Гидроксид алюминия А1(ОН)3получают при взаимодействии раствора щелочи с растворами солей алюминия (раствор щелочи нельзя брать в избытке!):
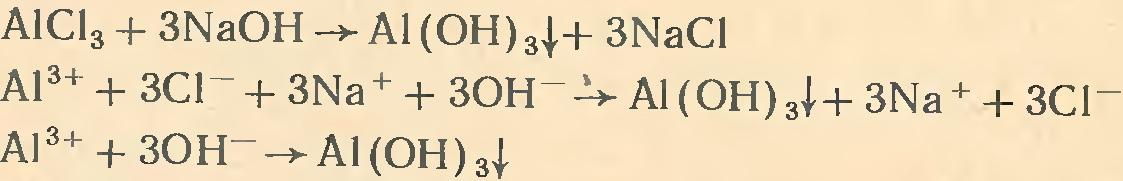
Если белую желеобразную массу гидроксида алюминия выделить из раствора и высушить, то получается белое кристаллическое вещество, практически не растворяющееся в воде.
Гидроксид алюминия (как и его оксид) обладает амфотер-ными свойствами. Подобно всем основаниям, гидроксид алюминия реагирует с кислотами. При сплавлении гидроксида алюминия со щелочами образуются метаалюминаты, а в водных растворах — гидраты метаалюминатов:
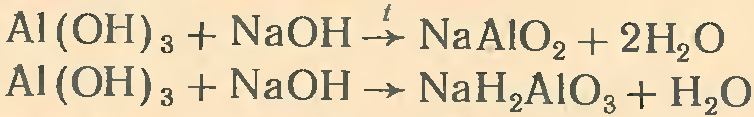
Соли алюминия получают в основном при взаимодействии металлического алюминия с кислотами.
По физическим свойствам — это твердые кристаллические вещества, хорошо растворимые в воде. Химические свойства солей алюминия аналогичны свойствам других солей. Так как соли алюминия образованы слабым основанием и сильной кислотой, то они в водных растворах подвергаются гидролизу.
Закрепление нового материала
1. Фронтальный опрос
2. Найдите соответствие между реагентами и продуктами реакции.
| 1 | Al + O2 | А | AlCl3 + H2 |
| 2 | Al + H2O | Б | AlCl3 |
| 3 | Al + Cl2 | В | AlCl3 + H2O |
| 4 | Al + HCl | Г | AlCl3 + Hg |
| 5 | Al + NaOH | Д | AlCl3 + HgCl2 |
| 6 | Al + HgCl2 | Е | NaAlO2 + H2 |
| 7 | Al + Fe3O4 | Ж | Al(OH)3 + H2 |
| | | З | Al(OH)3 + Na |
| | | И | Al2O3 + Fe |
| | | К | Al2O3 |
Для самопроверки.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| к | ж | б | а | е | д | и |
Проверь себя (запись химических уравнений):
4 Al + 3O2 = 2 Al2O3
2 Al + 3 Cl2 = 2 AlCl3
2 Al + 3S = Al2S3
2Al + 6H2O = 2Al(OH)3 + 3H2
2Al+6HCl = 2AlCl3 + 3H2
2Al+2NaOH = 2NaAlO2 + H2
2Al+3HgCl2 = 2AlCl3 + 3Hg
8Al+3Fe3O4 = 4Al2O3 + 9Fe
Подведение итогов
1. Комментирование оценок
2. Рефлексия
Домашнее задание. § 35 упр. 7,9; §36 упр. 6