Просмотр содержимого документа
«Алкены. Свойства»


Свойства алкенов

Физические свойства
С 2 – С 4 – г
С 5 – С 16 – ж
Высшие – т
плохо растворимы в воде, но хорошо
растворяются в органических растворителях
повышается t кип и t пл, плотность
Чистые вещества и смеси
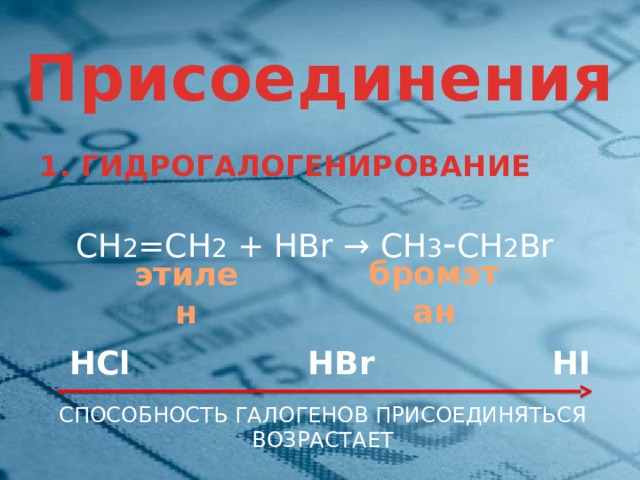
I . Присоединения
1. ГИДРОГАЛОГЕНИРОВАНИЕ
СН 2 =СН 2 + HBr → СН 3 - СН 2 Br
бромэтан
этилен
HCl HBr HI
СПОСОБНОСТЬ ГАЛОГЕНОВ ПРИСОЕДИНЯТЬСЯ ВОЗРАСТАЕТ
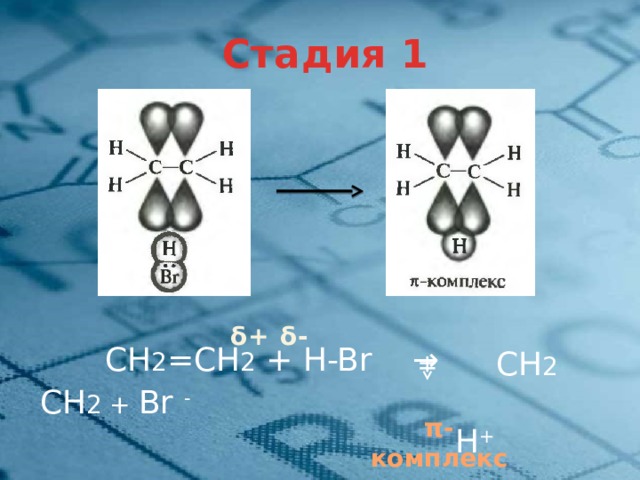
Стадия 1
δ+ δ-
СН 2 =СН 2 + H-Br →
СН 2 СН 2 + Br -
H +
π-комплекс
5
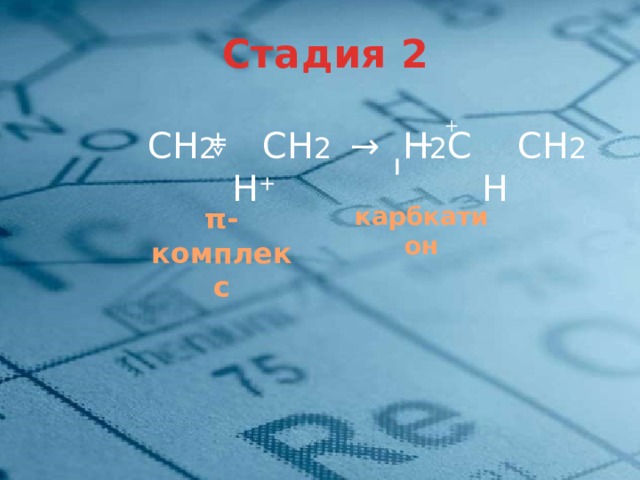
Стадия 2
+
СН 2 СН 2 → Н 2 С СН 2
H + H
карбкатион
π-комплекс
6
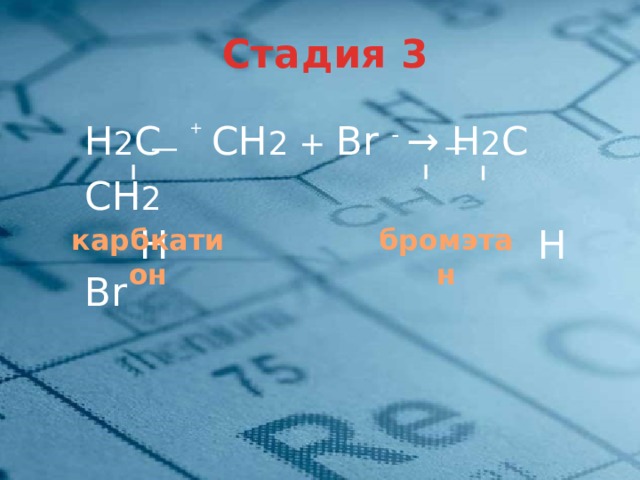
Стадия 3
Н 2 С СН 2 + Br - → Н 2 С СН 2
H H Br
+
карбкатион
бромэтан
7

Н + - ЭЛЕКТРОФИЛ
ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ
А Е
англ. addition electrophilic reaction
7

СН 3 - СН - СН 3
Br
СН 2 =СН - СН 3 + HBr →
Правило Марковникова
атом водорода присоединяется к наиболее гидрогенизированному атому углерода
9

Исключение из правила Марковникова
СН 2 =СН - СН 3 + HBr
СН 3 - СН 2 - СН 2 Br
пероксидный эффект
9
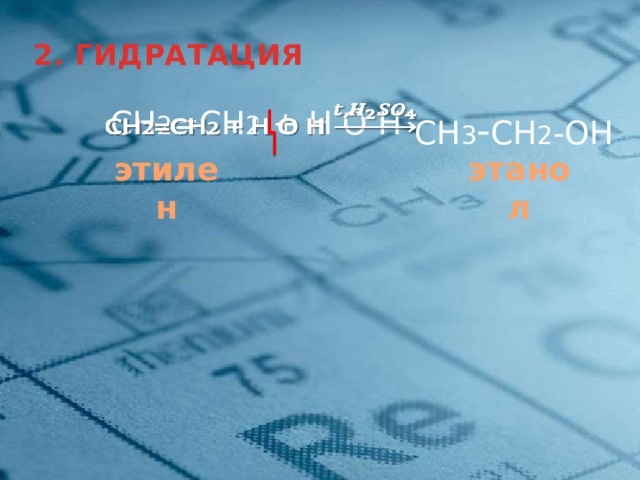
2. ГИДРАТАЦИЯ
СН 2 =СН 2 + H О Н
СН 3 - СН 2 -OH
этилен
этанол
9
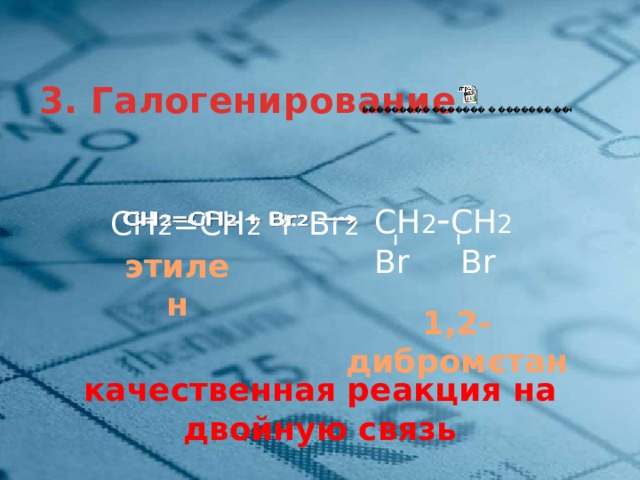
3. Галогенирование
СН 2 - СН 2
Br Br
СН 2 =СН 2 + Br 2
этилен
1,2-дибромєтан
качественная реакция на двойную связь
12
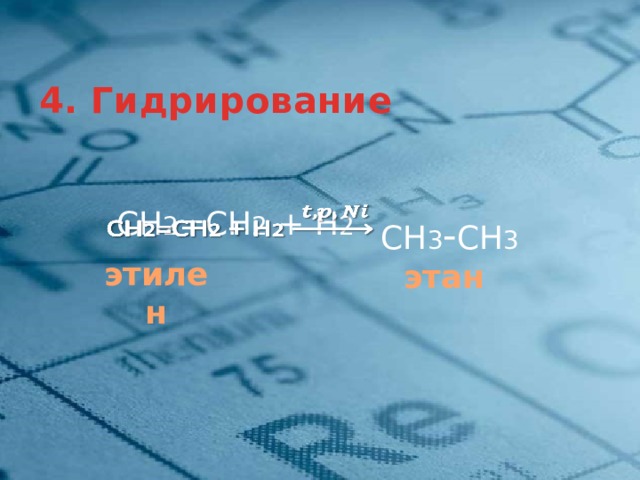
4. Гидрирование
СН 2 =СН 2 + Н 2
СН 3 - СН 3
этилен
этан
13
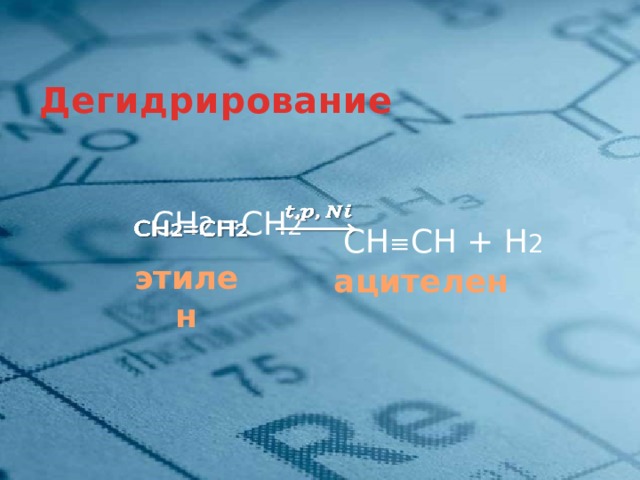
Дегидрирование
СН 2 =СН 2
СН ≡ СН + Н 2
этилен
ацителен
14

II . Окисление
1. Горение
С 2 Н 4 + 3О 2 → 2СО 2 + 2Н 2 О
14
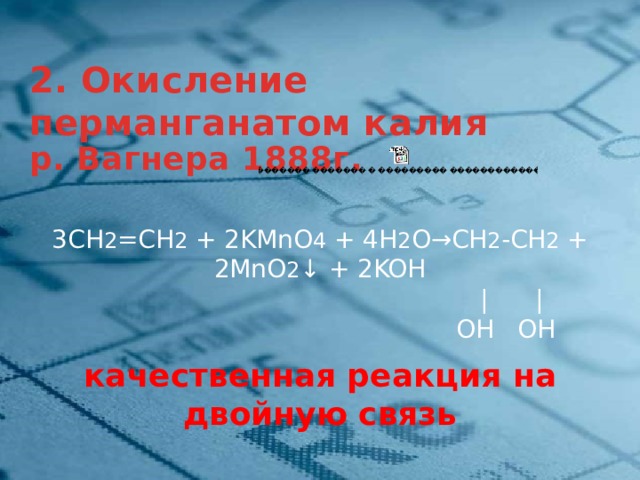
2. Окисление перманганатом калия
р. Вагнера 1888г.
3СН 2 =СН 2 + 2KMnО 4 + 4H 2 O→СН 2 -СН 2 + 2MnO 2 ↓ + 2KOH
| |
OH OH
качественная реакция на двойную связь
14

Окисление перманганатом калия
в кислой среде
5СН 3- СН=СН-СН 3 + 8KMnО 4 + 12H 2 SO 4
→ 10СН 3 COOH + 8MnSO 4 + 2K 2 SO 4 +12H 2 O
бутен-2
этановая
кислота
(уксусная)
определение положения двойной связи
14

3. Каталитическое окисление
2СН 2 =СН 2 + О 2 2СН 2 -CН 2
O
эпоксиэтан
18

III . Замещения
СН 3 -СН=СН 2 + Сl 2 Сl-СН 2 -СН=СН 2 + HСl
3-хлорпропен-1
пропен-1
19










































