1-БАП
РЕЗЕРФОРД-БОРДУН АТОМУ
§1. Атомдун моделдери
Томсондун атому. Чогулган эксперименталдык малыматтардын негизинде 1902-ж. У.Томсон (лорд Кельвин) атомдун биринчи моделин сунуш кылган. Кельвиндин модели боюнча атом мейкиндиктин кандайдыр бир анча чон эмес , мүмкүн сфера формасындагы аймагында топтолгон он зарядлардан жана анын ичинде өздөрүнүн теӊ салмактуу абалдарынын жанында термелишкен электрондордон турат . Электрондордун суммардык терс заряды атомдордун оӊ зарядына барабар , ошондуктан атом жалпысынан электр бейтарапту . Термелген электрондор Максвеллдин теориясы боюнча жарыкты нурлантыпты керек , ошондуктан дүүлүкпөгөн абалда бул электрондор жана оӊ заряд тынч абалда болуулары керек . Буга чейин , заряддалган бөлүкчөлөрдүн системасы электрдик күчтөрдүн аракети астында гана тынч абалда боло албастыгы белгилүү болгондуктан , заряддардын мындай бөлүштүрүүсү кандайча тынч абалда болору түшүнүксуз болуучу ; бирок атомдун ичинде кандайдыр бир башка күчтөр да аракет этишет деп божомолдоого болот эле .
[Ж.Ж. Томсон бул моделди өркундөтүп , 1903-ж , атом үчүн өзүнүн моделин сунуш кылат . Томсон боюнча атом , ичине теӊ салмактуу абалдарынын тегерегинде термелишкен электрондор жайланышкан , оӊ заряд менен үзгүлдүксүз заряддатлан радиусу болжол менен 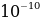 м ге барабар шар түрүндө болот (1.1-сүр.). Жогорудагыдай эле атомдо оӊ заряд электрондордун жалпы терс заряды менен тендешип турат.
м ге барабар шар түрүндө болот (1.1-сүр.). Жогорудагыдай эле атомдо оӊ заряд электрондордун жалпы терс заряды менен тендешип турат.
Томсон оӊ заряд заряддардын системасында электрдик эмес күчтөрдүн





сүрөт
R r
Аракети астында тынч абалда кармалып турат деп божомолдоп , электрондор кандайча жайланышканда тынч абалда болуша тургандыгын изилдеген . Ал электр зарядынын туруктуу жайланышы химиялык активдүү эмес элементтерге. Туруктуулугу анча эмес жайланышуу - активдүүрөк элементтерге тиешелүү болот деген болжомолдоону сунуш кылган . Мунуменен д элементтердин мезгилдик таблицасын
түшүндүргүу келген .
Томсондун атому дүүлүккөндө (мисалы , шамдын жанында ), жеӊил электрондор гана дүүлүгүшүп , оор оӊ заряд тынч абалда калган . Калабы электрондун дал ушул термелүүлөрү байкалган спектрлерди шарттап жана электрондордун ар башка жайланышына атомду мүнөздөөчү спектрдик сызыктардын ар кандай шайкештиги туура келет болуш керек . Атомдор курланткан жарык толкундаарынын өлчөнгөн узундуктарын пайдаланып , Томсон оӊ заряд ээлеген аймакты баалай алган . Томсондун модели классикалык физиканын алкагынан чыкпастан түзүлгөн .
Классикалык элестетүүлөргө ылайык , атом монохроматтык толкунду , качан нурланткан атомдогу электрон гармониялык термелүү жасаганда , демек , теӊ салмактуу абалынын жанында F= - kx түрүндөгү квазисерпилгичтүү күчтүн таасири аркасында кармалып турганда нурланта алмак . Анда бир тектүү заряддалган шардын ичиндеги талаанын чыӊадышы төмөндөгүчө аныкталат:
E(r) = 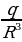 , (1.1)
, (1.1)
Мында q – шардын заряды . R – анын радиусу , r – электрондун теӊ салмактуу абалынан четтенип . Демек , теӊ салмактуу абалынан (шаардын борборунун ) r аралыгында жайланышкан электронго
F=(-e)E= -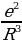 r = - kr (1.2)
r = - kr (1.2)
күчү аркет этет. Мындай шартта кандайдыр бир жол менен теӊ салмактуу абалынан чыгарылган электрон
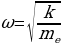 =
= 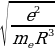 (1.3)
(1.3)
Жыштыгы менен термелүү жасайт , мында е - электрондун заряды , m1 - электрондун массасы , R – атомдун радиусу (1.3) кө ылайык
R = 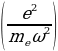 1/3 (1.4)
1/3 (1.4)
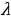 = 6000 A толкун узундугуна (спектердин көрүнгөн аймагы)
= 6000 A толкун узундугуна (спектердин көрүнгөн аймагы) 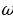
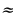
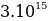 рад/с туура келет. Демек
рад/с туура келет. Демек
R = 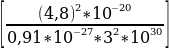 1/3
1/3 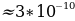 м.
м.
Бирок Томсондун модели кээ бир Физикалык кубулуштарды туура түшүндүргөнү менен кийинчерээк олуттуу карама – каршылыктарга учураган . Ошондуктан атомдун моделин аныктоо аракеттери улантыла берген.
Резерфорддун атому . Атомдун түзүлүшү жөнүндөгү элестетүүлөрдү өнүктүрүүдө Резерфорддун заттардагы  - бөлүкчөсүн изилдөө боюнча жүргүзгөн тажрыйбалары абдан чоӊ мааниге ээ. Нурлануулар же ар кандай бөлүкчөлөрдүн – X – нурлары , электрондор (
- бөлүкчөсүн изилдөө боюнча жүргүзгөн тажрыйбалары абдан чоӊ мааниге ээ. Нурлануулар же ар кандай бөлүкчөлөрдүн – X – нурлары , электрондор (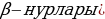 жана
жана  - бөлүкчөлөрдүн заттардан чачыроосу 1910- ж. чейин эле жүргүзүлүп келген . Атомдун түзүлүшүн изилдөө үчүн эӊ ылайыктуусу оор
- бөлүкчөлөрдүн заттардан чачыроосу 1910- ж. чейин эле жүргүзүлүп келген . Атомдун түзүлүшүн изилдөө үчүн эӊ ылайыктуусу оор  – бөлүкчөлөр болгон .
– бөлүкчөлөр болгон .  - бөлүкчөсүнүн массасы болжол менен 6,62*
- бөлүкчөсүнүн массасы болжол менен 6,62*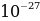 кг , б.а., гелийдин атомунун массасына барабар , анын заряды оӊ жана чондугу боюнча электрондун зарядына караганда эки эсеге чоӊ болору жана радиоактивдүү полонийден бөлүнүп чыккан
кг , б.а., гелийдин атомунун массасына барабар , анын заряды оӊ жана чондугу боюнча электрондун зарядына караганда эки эсеге чоӊ болору жана радиоактивдүү полонийден бөлүнүп чыккан  - бөлүкчөсүнүн ылдамдыгы 1,6*
- бөлүкчөсүнүн ылдамдыгы 1,6*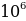 м/с га барабар экендиги белгилүү болгон . Мындан
м/с га барабар экендиги белгилүү болгон . Мындан  – бөлүкчөсү нурлануу процессинде эки электронунан ажыраган гелийдин атому деп болжомолдоого болот. Бул болжоолдоо Резерфорд жана Ройдс тарабынан далилденген . 1911-ж. Резерфорддун сунушу боюнча анын окуучулары Х Гейгер (1882 – 1945-жж.) жана У. Марсден (1889 – 1970-жж.) радиоактиивдүү заттар бөлүп чыгарган
– бөлүкчөсү нурлануу процессинде эки электронунан ажыраган гелийдин атому деп болжомолдоого болот. Бул болжоолдоо Резерфорд жана Ройдс тарабынан далилденген . 1911-ж. Резерфорддун сунушу боюнча анын окуучулары Х Гейгер (1882 – 1945-жж.) жана У. Марсден (1889 – 1970-жж.) радиоактиивдүү заттар бөлүп чыгарган  - бөлүкчөлөрүнүн чачырашын сандык түрдө изилдешкен . Бута катары эсептелген атомдор менен
- бөлүкчөлөрүнүн чачырашын сандык түрдө изилдешкен . Бута катары эсептелген атомдор менен  - бөлүкчөлөрүнүн ортосундагы жекече кагылуушуну мүмкүн болушунча так изилдөө үчүн бутактачасы мүмүкүн болушунча жука болушу керек , антпесе көптөгөн кагылышуулардын натыйжасы жекече кагылышуунун натыйжасы басып кетмек . Мындай тактачаны алтындан жасоого болот . Акырындап жалпайтуу менен калындыгы болгону алтындын 400 атомун кармаган аябагандай жука алтын тактачасы (фольга) даярдалган . Андан соӊ вакуумда жайланышкан бута – тактачасынан
- бөлүкчөлөрүнүн ортосундагы жекече кагылуушуну мүмкүн болушунча так изилдөө үчүн бутактачасы мүмүкүн болушунча жука болушу керек , антпесе көптөгөн кагылышуулардын натыйжасы жекече кагылышуунун натыйжасы басып кетмек . Мындай тактачаны алтындан жасоого болот . Акырындап жалпайтуу менен калындыгы болгону алтындын 400 атомун кармаган аябагандай жука алтын тактачасы (фольга) даярдалган . Андан соӊ вакуумда жайланышкан бута – тактачасынан  - бөлүкчөлөрүнүн чачырашы күкүрттүү- цинк экранында микроскоптун же лупанын жардамы менен байкалган . Экрандын ар кандай бөлүгүн байкоо менен Гейгер бир минута ичинде канча жолу сцинтилляциялар (жылтэтүүлөр) болорун эсептей алган. Бул болсо белгилүү бурч боюнча чачыраган бөлүкчөлөрдүн
- бөлүкчөлөрүнүн чачырашы күкүрттүү- цинк экранында микроскоптун же лупанын жардамы менен байкалган . Экрандын ар кандай бөлүгүн байкоо менен Гейгер бир минута ичинде канча жолу сцинтилляциялар (жылтэтүүлөр) болорун эсептей алган. Бул болсо белгилүү бурч боюнча чачыраган бөлүкчөлөрдүн 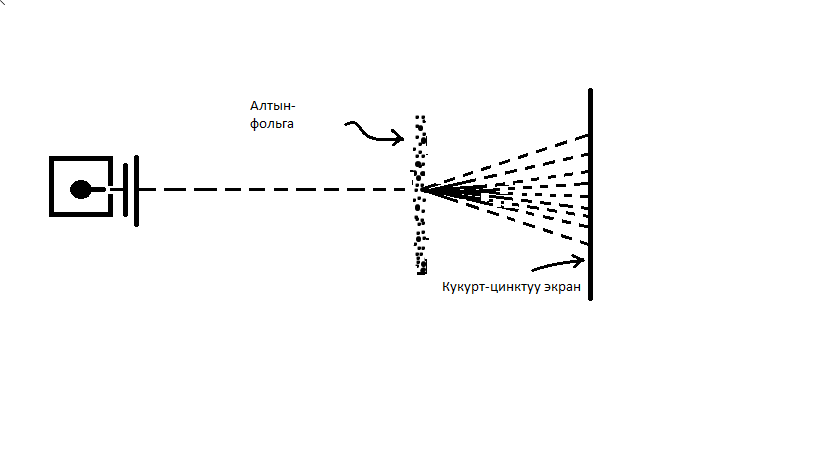 салыштырма санын эсептөөгө мүмкүндүк берген (1.2-сүр.).
салыштырма санын эсептөөгө мүмкүндүк берген (1.2-сүр.).
1.2- сүрөт
Бул тажрыйбадан  - бөлүкчөлөрүнүн басымдуу көпчүлүгү анча чоӊ эмес 1-
- бөлүкчөлөрүнүн басымдуу көпчүлүгү анча чоӊ эмес 1-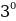 ка барабар бурчка чачыраары аныкталган . Мындай бөлүкчөлөрдүн бурчтук бөлүштүрүлүшү кокустуктуу каталарды мүнөздөгөн Гаусстун (1777-1855-жж.) Ийрлиги менен жакшы сүрөттөлгөн . Бирок , кээ бир
ка барабар бурчка чачыраары аныкталган . Мындай бөлүкчөлөрдүн бурчтук бөлүштүрүлүшү кокустуктуу каталарды мүнөздөгөн Гаусстун (1777-1855-жж.) Ийрлиги менен жакшы сүрөттөлгөн . Бирок , кээ бир  - бөлүкчөлөр 1500 ка жана андан чоӊ бурчтарга чачырай тургандыгы да байкалган . Мындай бөлүкчөлөрдүн салыштырма саны өтө эле аз болгон . Мисалы үчүн калыӊдыгы 1 мкм алтын фольгасы аркылуу өткөндө
- бөлүкчөлөр 1500 ка жана андан чоӊ бурчтарга чачырай тургандыгы да байкалган . Мындай бөлүкчөлөрдүн салыштырма саны өтө эле аз болгон . Мисалы үчүн калыӊдыгы 1 мкм алтын фольгасы аркылуу өткөндө  - бөлүкчөлөрүнүн болжол менен 20 000 ден бири баштапкы багытка салыштырмалуу 1800 ка чейин жеткен бурчка чагылышкан . Тажрыйбалардын жыйынтыгын талдоо менен Резерфорд ,
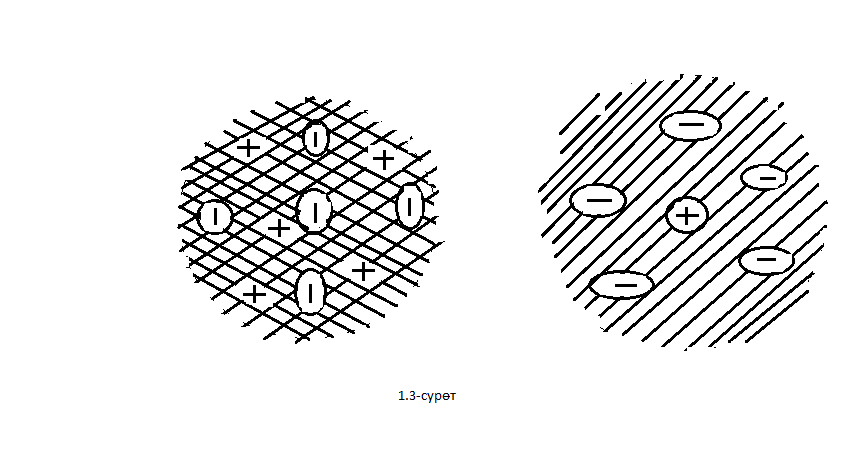
- бөлүкчөлөрүнүн болжол менен 20 000 ден бири баштапкы багытка салыштырмалуу 1800 ка чейин жеткен бурчка чагылышкан . Тажрыйбалардын жыйынтыгын талдоо менен Резерфорд ,  - бөлүкчөлөрдүн баштапкы багыттан мындай күчтүү четтеши , эгерде атомдун ичинде өтө кичине көлөмгө топтолгон чоӊ масса менен байланышкан заряд мүмкүн деген тыянакка келген . Бул тыянакка таянып Резерфорд Томсондун моделинин (1.3.а-сүр.) ордуна өзүнүн ядролук (планетардык ) моделин (1.3.б-сүр.) сунуш кылган . Бул модель боюнча атомду борборунда заряды Ze ге барабар оор , өлчөмү 10-14 м ден чоӊ эмес оӊ ядро жана анын айланасында атом ээлеген бүткүл көлөм боюнча бир калыпта бөлүштүрүлгөн Z электрондор жайланышкан заряддардын системасы катарында кароого болот . Атомдун дээрлик бардык массасы ядродо топтолгон болот.
- бөлүкчөлөрдүн баштапкы багыттан мындай күчтүү четтеши , эгерде атомдун ичинде өтө кичине көлөмгө топтолгон чоӊ масса менен байланышкан заряд мүмкүн деген тыянакка келген . Бул тыянакка таянып Резерфорд Томсондун моделинин (1.3.а-сүр.) ордуна өзүнүн ядролук (планетардык ) моделин (1.3.б-сүр.) сунуш кылган . Бул модель боюнча атомду борборунда заряды Ze ге барабар оор , өлчөмү 10-14 м ден чоӊ эмес оӊ ядро жана анын айланасында атом ээлеген бүткүл көлөм боюнча бир калыпта бөлүштүрүлгөн Z электрондор жайланышкан заряддардын системасы катарында кароого болот . Атомдун дээрлик бардык массасы ядродо топтолгон болот.





 Резерфорддун тыянагы Вильсондун
Резерфорддун тыянагы Вильсондун
Камерасындагы  - бөлүкчөлөрүнүн издеринин сүрөтүн талдоодо абдан жакшы далилденген . Адатта
- бөлүкчөлөрүнүн издеринин сүрөтүн талдоодо абдан жакшы далилденген . Адатта  - бөлүкчөлөрүнүн издеринин учтары эч кандай өзгөчөлүктөр менен айырмаланышпайт . Бирок кез – кезде издин учтары
- бөлүкчөлөрүнүн издеринин учтары эч кандай өзгөчөлүктөр менен айырмаланышпайт . Бирок кез – кезде издин учтары  түрүндө болгон учурлар байкалат (1.4-сүр.).
түрүндө болгон учурлар байкалат (1.4-сүр.).
Мында  - бөлүкчөсүнүн ядро менен кагылышкан учуру сүрөткө тартылып
- бөлүкчөсүнүн ядро менен кагылышкан учуру сүрөткө тартылып
1.4-сүрөт калган . Кагылышуунун натыйжасында  - бөлүкчөлөрүнүн кыймылынын багыты кескин
- бөлүкчөлөрүнүн кыймылынын багыты кескин
Өзгөрүп , кыймылга келген ядро жаӊы из калтырып , сүрөттө көрүнүп турган  пайда кылышат . Жогоруда келтирилген тыянакка таянып , Резерфорд
пайда кылышат . Жогоруда келтирилген тыянакка таянып , Резерфорд  - бөлүкчөлөрүнүн чачырашынын сандык теориясын иштеп чыккан жана чачыраган бөлүкчөлөрдүн ө бурчунун маанилери боюнча бөлүштүрүлүшүнүн формуласын алган . Бул формуланы алууда Резерфорд төмөндөгүдөй ой жүгүрткөн . Биринчиден
- бөлүкчөлөрүнүн чачырашынын сандык теориясын иштеп чыккан жана чачыраган бөлүкчөлөрдүн ө бурчунун маанилери боюнча бөлүштүрүлүшүнүн формуласын алган . Бул формуланы алууда Резерфорд төмөндөгүдөй ой жүгүрткөн . Биринчиден  - бөлүкчөлөрүнүн баштапкы багытынан четтеши алар менен атомдун ядролорунун ортосундагы кулондук аракет этишүү менен шартталат . Электрондун массасы
- бөлүкчөлөрүнүн баштапкы багытынан четтеши алар менен атомдун ядролорунун ортосундагы кулондук аракет этишүү менен шартталат . Электрондун массасы  - бөлүкчөсүнүн массасына караганда болжол менен 7300 эсеге аз болгондуктан электрон менен аракет этишүү
- бөлүкчөсүнүн массасына караганда болжол менен 7300 эсеге аз болгондуктан электрон менен аракет этишүү  - бөлүкчөсүнүн изинин өзгөрүшүнө салым кошо албайт . Экинчиден , ядронун массасы
- бөлүкчөсүнүн изинин өзгөрүшүнө салым кошо албайт . Экинчиден , ядронун массасы  - бөлүкчөнүн массасына салыштырмалуу чоӊ , ошондуктан ядрону кыймылсыз деп эсептөөгө болот .
- бөлүкчөнүн массасына салыштырмалуу чоӊ , ошондуктан ядрону кыймылсыз деп эсептөөгө болот .  - бөлүкчөлөрүнүн ядронун электр талаасындагы кыймылы Резерфорд тарабынан классикалык физиканын негизинде каралган . Каралган учурда классикалык физиканын колдонулушунун тууралыгы кийинчерээк пайда болгон кванттык механика менен негиздөөгө болот .
- бөлүкчөлөрүнүн ядронун электр талаасындагы кыймылы Резерфорд тарабынан классикалык физиканын негизинде каралган . Каралган учурда классикалык физиканын колдонулушунун тууралыгы кийинчерээк пайда болгон кванттык механика менен негиздөөгө болот .
Резерфорддун тажрыйбасында калыӊдыгы 10-4 – 10-5 см ге барабар абдан жука металл фольгалары пайдаланылган . Ошондуктан бул учурда чоӊ бурчтарга чачыроону караган кезде  - бөлүкчөлөрүнүн атомдун ядролору менен көп жолу кагылышын эске албастан , эӊ кичине аралыкка жакындаган
- бөлүкчөлөрүнүн атомдун ядролору менен көп жолу кагылышын эске албастан , эӊ кичине аралыкка жакындаган  - бөлүкчөсүнүн бир гана ядро менен аракет этишин карасак болот . Ядролор жана атомдун электрондору менен бир нече жолу кагылуушулар чачыроо бурчунун кичине маниилеринде гана кандайдыр бир ролду ойнойт . Мындай бурчтарды биз карабайбыз .
- бөлүкчөсүнүн бир гана ядро менен аракет этишин карасак болот . Ядролор жана атомдун электрондору менен бир нече жолу кагылуушулар чачыроо бурчунун кичине маниилеринде гана кандайдыр бир ролду ойнойт . Мындай бурчтарды биз карабайбыз .  - бөлүкчөсү калган ядролордон бир топ алыс аралыкта учуп өткөндүктөн , алардын ортосундагы аракет этишүү да көӊүлгө алынбайт . Ошентип , Резерфорддун теориясы чечтөө бир ядронун электр талаасы менен шартталып , бул чечтөөгө салыштырмалуу калган бардык чечтөөлөрдү чогуусу менен көнүлгө албай койсо боло турган учурда гана колдонулат . Тиешелүү чачыроо Резерфорддук деп аталат . Чачыроонун натыйжасында
- бөлүкчөсү калган ядролордон бир топ алыс аралыкта учуп өткөндүктөн , алардын ортосундагы аракет этишүү да көӊүлгө алынбайт . Ошентип , Резерфорддун теориясы чечтөө бир ядронун электр талаасы менен шартталып , бул чечтөөгө салыштырмалуу калган бардык чечтөөлөрдү чогуусу менен көнүлгө албай койсо боло турган учурда гана колдонулат . Тиешелүү чачыроо Резерфорддук деп аталат . Чачыроонун натыйжасында  - бөлүкчөсүнүн кинетикалык энергиясы өзгөрбөгүндүктөн , б.а., атомду (атомдун ядросун андан бетер) дүүлүктүрүүгө сарпталбагандыктан , бул чачыроо серпилгичтүү болот .
- бөлүкчөсүнүн кинетикалык энергиясы өзгөрбөгүндүктөн , б.а., атомду (атомдун ядросун андан бетер) дүүлүктүрүүгө сарпталбагандыктан , бул чачыроо серпилгичтүү болот .
 - бөлүкчөсүнүн атомдун ядросунан чачырашы жөнүндөгү маселе планеталардын Күндүн айланасындагы кыймылы
- бөлүкчөсүнүн атомдун ядросунан чачырашы жөнүндөгү маселе планеталардын Күндүн айланасындагы кыймылы
Жөнүндөгү И. Кеплердин (1571-1630-жж.) маселесине окшош . Эки учурда теӊ нерселердин аракет этишүү күчторү борбордук болот жана алардын ортосундагы аралыктын квпдратына тескери пропорционалдуу өзгөрөт . Планеталар учурунда бул тартылуу күчү ,  учурунда - түртүшүү күчү . Натыйжада
учурунда - түртүшүү күчү . Натыйжада  сү (1.5-сүр.) гипербола боюнча кыймылдайт жана чачыроо бурчу θ анын гиперболалык изинин асимптоталарынын ортосундагы бурчуна барабар болот
сү (1.5-сүр.) гипербола боюнча кыймылдайт жана чачыроо бурчу θ анын гиперболалык изинин асимптоталарынын ортосундагы бурчуна барабар болот
ctg 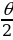 =
=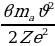 , (1.5)
, (1.5)
мында ma - 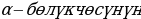 массасы ,
массасы , 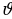 – анын
– анын  б.а., ядродон алыс жердеги ылдамдыгы , Ze – ядронун заряды , 2е -
б.а., ядродон алыс жердеги ылдамдыгы , Ze – ядронун заряды , 2е -  сүнүн элементардык заряддан эки эсе чоӊ заряды . Z саны ядронун заряддык саны деп аталат . Көпчүлүк учурда бирдик катарында элементардык заряд катары е кабыл алынганын эске алуу менен аны кыскача эле ядронун заряды деп аташат ,
сүнүн элементардык заряддан эки эсе чоӊ заряды . Z саны ядронун заряддык саны деп аталат . Көпчүлүк учурда бирдик катарында элементардык заряд катары е кабыл алынганын эске алуу менен аны кыскача эле ядронун заряды деп аташат ,  аркылуу мээлөө аралыгы , б.а., ядродон
аркылуу мээлөө аралыгы , б.а., ядродон 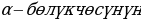 дүүлүкпөгөн түз сызыктуу изине жүргүзүлгөн перпендикулярдык узундугу белгиленет .
дүүлүкпөгөн түз сызыктуу изине жүргүзүлгөн перпендикулярдык узундугу белгиленет .
Атомдук кубулуштардын аймагында (1.5) формуласынын өзү эмес , андан келип чыккан статистикалык натыйжалар эксперимент аркылуу текшерилет . Чачыроонун дифференциалдык эффективдүү кесилиши түшүнүгүн киргизебиз . I аркылуу ядрого учуп келип тийген  сүнүн жалпак жарыш шооласынын интенсивдүүлүгүн , б.а., убакыт бирдиги ичинде агымга перпендикулярдуу бирдик бет аркылуу өткөн
сүнүн жалпак жарыш шооласынын интенсивдүүлүгүн , б.а., убакыт бирдиги ичинде агымга перпендикулярдуу бирдик бет аркылуу өткөн  лөрүнүн санын белгилейбиз . Бул бөлүкчөлөрдүн ичинен агымга перпендикулярдуу do аянтчасы аркылуу dN1 = Ido га барабар
лөрүнүн санын белгилейбиз . Бул бөлүкчөлөрдүн ичинен агымга перпендикулярдуу do аянтчасы аркылуу dN1 = Ido га барабар  сү өтөт . Чачырагандан кийин бул бөлүкчөлөр элементардык dΩ нерселик бурчуна келип тийишет . dΩ нерселик бурчунун чондугу жана анын огунун багыты do аянтцасынын чондугу жана абалы менен аныкталат . Ошондуктан dN1 дин I ге болгон катышы do га барабар жана аянттын өлчөмүнө ээ . Ал ,
сү өтөт . Чачырагандан кийин бул бөлүкчөлөр элементардык dΩ нерселик бурчуна келип тийишет . dΩ нерселик бурчунун чондугу жана анын огунун багыты do аянтцасынын чондугу жана абалы менен аныкталат . Ошондуктан dN1 дин I ге болгон катышы do га барабар жана аянттын өлчөмүнө ээ . Ал ,  лөрдү dΩ нерселик бурчуна чачыратуу үчүн ядронун дифференциалдык эффективдүү кесилиши деп аталат . Бул түшүнүк
лөрдү dΩ нерселик бурчуна чачыратуу үчүн ядронун дифференциалдык эффективдүү кесилиши деп аталат . Бул түшүнүк  сүнүн эле эмес , каалагандай бөлүкчөлөрдүн чачырашына жана бөлүкчөлөр катышкан башка процесстерге да колдонулат . Ошентип , аныктама боюнча
сүнүн эле эмес , каалагандай бөлүкчөлөрдүн чачырашына жана бөлүкчөлөр катышкан башка процесстерге да колдонулат . Ошентип , аныктама боюнча
Dσ = 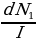 (1.6)
(1.6)
Б.а., атом убакыт бирдиги ичинде dΩ нерселик бурчуна чачыраткан бөлүткүчтөрдүн санынын келип түшкөн бөлүкчөлөрдүн интенсивдүүлүгүнө болгон катышы чачыроонун дифференциалдык эффективдүү кесилиши болот .
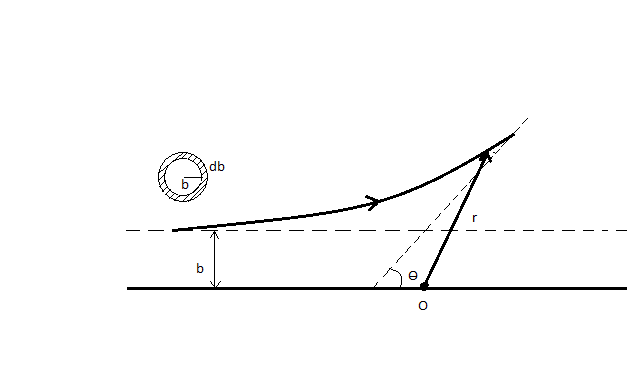
Эми  лөрүнүн атомдун жекече ядросунан чачыроосу үчүн дифференциалдык кесилишти карайбыз . мында , чачыроонун натыйжасында
лөрүнүн атомдун жекече ядросунан чачыроосу үчүн дифференциалдык кесилишти карайбыз . мында , чачыроонун натыйжасында  сү кандай чондуктагы dσ аянтчасы аркылуу өткөндө dΩ нерселик бурчунун ичине келип түшөөрүн аныкташыбыз керек болот . X огу катары
сү кандай чондуктагы dσ аянтчасы аркылуу өткөндө dΩ нерселик бурчунун ичине келип түшөөрүн аныкташыбыз керек болот . X огу катары 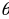 = 0 мээлөө аралыгы туура келген
= 0 мээлөө аралыгы туура келген  сүнүн түз сызыктуу изин алабыз (мындай бөлүкчө ядро менен бетме-бет кагылышмак ). Цилиндрдик симетрияны пайдаланып , жөнөкөйлүк үчүн dσ ны агымга перпендикулярдуу шакектик аянтчага алмаштырабыз dσ = 2
сүнүн түз сызыктуу изин алабыз (мындай бөлүкчө ядро менен бетме-бет кагылышмак ). Цилиндрдик симетрияны пайдаланып , жөнөкөйлүк үчүн dσ ны агымга перпендикулярдуу шакектик аянтчага алмаштырабыз dσ = 2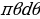 . Мындай аянтчанын ички радиусу
. Мындай аянтчанын ички радиусу 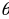 га , тышкысы
га , тышкысы 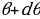 га барабар , ал эми борбору X – огунда жайланышат (1.5-сүр. Үстүндө сол жакта ).
га барабар , ал эми борбору X – огунда жайланышат (1.5-сүр. Үстүндө сол жакта ). 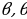 + d
+ d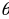 интервалына чачыроо бурчунун θ, θ +dθ интервалы туура келет (1.5) формуласы боюнча
интервалына чачыроо бурчунун θ, θ +dθ интервалы туура келет (1.5) формуласы боюнча
d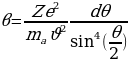
шакектик аянтча аркылуу өткөн  лөрү чачырагандан кийин келип түшкөн dΩ = 2
лөрү чачырагандан кийин келип түшкөн dΩ = 2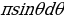 нерселик бурчун киргизип төмөндөгүнү оӊой эле алабыз :
нерселик бурчун киргизип төмөндөгүнү оӊой эле алабыз :
dσ = 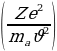 2
2 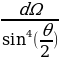 (1.7)
(1.7)
Бул түрдө (1.7) формуласы шакектик эле эмес , калагандай элементардык бет dσ үчүн жарактуу болот . Бул формула Резерфорддун формуласы деп аталат.
Эми (1.7) формуласын экспериментте текшерсе боло тургандай түргө келтиребиз . Ар башка атомдордун  лөрүн чачыратуусу бири-биринен көзкаранды болбойт. Мындан бирдик көлөмдөгү ядорлордун (атомдордун) саны n болсо , анда V көлөмү убакыт бирдиги ичинде dΩ нерселик бурчуна чачыраткан
лөрүн чачыратуусу бири-биринен көзкаранды болбойт. Мындан бирдик көлөмдөгү ядорлордун (атомдордун) саны n болсо , анда V көлөмү убакыт бирдиги ичинде dΩ нерселик бурчуна чачыраткан  лөрүнүн саны
лөрүнүн саны
dN = nVIdσ = nVI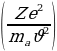 2
2 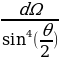 (1.8)
(1.8)
туюнтмасы менен аныкталат . Мына ушул түрдө Резерфорддун формуласы тажрыйбада далилденген . Атап айтканда , тажрыйбадан dΩ турактуу болору, б.а., (1.8) формуласынан көрүнүп тургандай чачыроо бурчу θ дан көзкаранды болбой тургандыгы көргөзүлгөн .
Резерфорддун формуласынын тажрыйбада далилденишин  лөрүнүн жана аны менен аракет этишкен ядролордун борборлору жакындай ала турган кичине аралыктарда Кулондун закону орун ала тургандыгынын кыйыр далилдөөсү катары кароого болот .
лөрүнүн жана аны менен аракет этишкен ядролордун борборлору жакындай ала турган кичине аралыктарда Кулондун закону орун ала тургандыгынын кыйыр далилдөөсү катары кароого болот .
 сү менен атомдун ядросунун ортосунда кулондук аракет этишүү орун ала тургандыгына таянган теориянын тууралыгы баштапкы кыймылынын багытына карама – каршы багытка чагылышкан
сү менен атомдун ядросунун ортосунда кулондук аракет этишүү орун ала тургандыгына таянган теориянын тууралыгы баштапкы кыймылынын багытына карама – каршы багытка чагылышкан  лөрү дагы атомдун ядросунун аймагына кире албай тургандыгын күбөлөйт . Ушуну менен бирге эле ядронун дал өзүн көздөй учуп келе жаткан
лөрү дагы атомдун ядросунун аймагына кире албай тургандыгын күбөлөйт . Ушуну менен бирге эле ядронун дал өзүн көздөй учуп келе жаткан  сү анын борборуна кандай эӊ кичине аралыкка жакындай ала тургандыгын
сү анын борборуна кандай эӊ кичине аралыкка жакындай ала тургандыгын  сүнүн кинетикалык энергиясын бөлүкчө толугу менен токтогон моменттеги
сүнүн кинетикалык энергиясын бөлүкчө толугу менен токтогон моменттеги  сү менен ядронун ортосундагы аракет этишүүнүн потенциалдык энергиясына бараборлоо менен тапсак болот :
сү менен ядронун ортосундагы аракет этишүүнүн потенциалдык энергиясына бараборлоо менен тапсак болот :
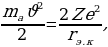 (1.9)
(1.9)
Мында 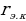
 сү менен ядронун борборлорунун ортосундагы эӊ кичине аралык . Мындан
сү менен ядронун борборлорунун ортосундагы эӊ кичине аралык . Мындан
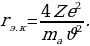 (1.10)
(1.10)
Эгерде Z = 30 , 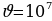 м/c ,
м/c , 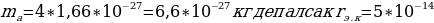 м болот .
м болот .
Мындан көп өтпөй эле борбордук ядронун электрдик заряды (тактап айтканда , чондугу ядронун курамындагы электрондордун суммардык зарядына барабар оӊ заряддын саны) Менделеевдин мезгилдик системасындагы берилген элементтин номерине так дал келери аныкталган . 1913- ж башында бул ой голандиялык физик А.Ван-дер-Брук (1870-1926-жж.) тарабынан айтылган жана бир нече ай кийин Резерфорддун жаш окуучусу Г.Мозли (1887 – 1915-жж.) тарабынан тажрыйба жүзүндө далилденген . Мозли ар башка элементтерге мүнөздүү рентген нурларынын спектрин изилдеген . Көрсө , бул нурлардын толкун узундуктары элементтин мезгилдик системадагы  Z өскөн сайын системалуу түрдө азаят экен . Мындан , Мозли бул законченемдүүлүк атомдун зарядынын
Z өскөн сайын системалуу түрдө азаят экен . Мындан , Мозли бул законченемдүүлүк атомдун зарядынын 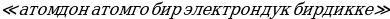 чоӊоюшу менен шартталат жана мындай бирдиктердин саны
чоӊоюшу менен шартталат жана мындай бирдиктердин саны 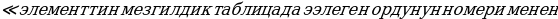
Дал келет  , - деген тыянакка келет .
, - деген тыянакка келет .
Экинчи жагынан , атом электрдик бейтараптуулукка ээ, демек электрондордун терс заряды ядронун оӊ зарядын жоюшу керек . Бул болсо , атомдогу электрондордун толук саны да Z ке барабар дегенди билгизет . Ошентип , Резерфорд атом Күн системасына окшош деген тыянакка келет . өлчөмү 10-14 м ге барабар ядро , борбордук жарык берүүчү - Күнгө окшош , ал эми электрондор орбиталары атомдун өлчөмдөрүндөй , б.а., 10-10 м болгон планеталардын ролун ойнойт . Күн системасынан аыйрмаланып , атомдо ядронун оӊ заряды +Ze электрондук булутчанын заряды -Ze менен жоюшат , ал эми гравитация учурунда эч кандай жоюшуу болушу мүмкүн эмес . Атомдун планетардык модели кийинчерээк көптөгөн жолу далилденип , жалпы кабыл алууга ээ болду .
Резерфорд атомдун планетардык моделин түзүп , илимге зор салым кошту . Анын моделинин сүрөтү XX кылымдын эмблемасы болуп эсептелет . Чындыгында электрондордун орбиталарынын болбой тургандыгы кийинчерээк белгүлүү болду . Бирок ошого карабастан , кванттык механиканы түзүүдө негиз болуп калган Резерфоддун модели тарыхый мааниге ээ.
Атомдун планетардык моделинин көптөгөн ийгилигине карабастан , аны классикалык физиканын негизинде түшүндүрүү өтө кыйын болгон . Атап айтсак , планетардык модель классикалык механиканын жана электдинамиканын закондоруна каршы болот . Кыймылсыз заряддардын системасы туруктуу абалда боло албай тургандыгына байланыштуу , Резерфорд атомдун статистикалык моделинен баш тартып , электрондор ядронун айланасында ийри из боюнча кыймылдашат деп божомолдоого мажбур болгон . Бирок , бул учурда электрон ылдамданууга ээ болуу менен кыймылдайт да , классикалык электрдинамиканын жоболоруна ылайык , ал электрмаггниттик (жарык) толкундарын үзгүлтүксүз нурлантышы керек . Нурлантуу процесси энергиянын жоготулушу менен коштолуп , акырында электрон ядрого түшүп калмак (1.6-сүр). Электрондун өзүнүн орбитасынан ядрого түшүп калуу убактысы болгону секунданын миллиарддан бир бөлүгүн түзөт . Бирок мунун бардыгы күндө көрүп жүргөн заттын атомунун туруктуулугу жөнүндөгү элестетүүбүзгө карама – каршы келет . Буга кошумча , электрондун ядрого түшүп келе жаткандыгы нурлантуусу үзгүлтүксүз болмок жана анын жыштыгы электрондун орбитасынын радиусу кичирейген сайын өсмөк жана атомдун спектри туташ тилке түрүндө болмок . Бирок ар бир атомго мүнөздүү спектр дискреттүү болору экспериметтен белгилүү бол-
уп , ал XIX кылымдагы ар кандай затты химиялык талдоонун негизи
болгон.
1.6-сүрөт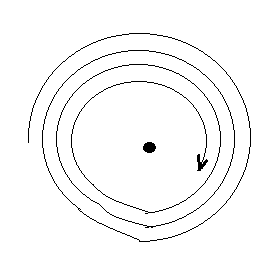
Жогоруда айтылгандардын негизинде атомдун Резерфорд сунуш кылган модели таза классикалык жоболорду колдонуу менен атом дүйнөсүн изиилдөөгө кошулган акыркы салым болгон десек жаӊылышпайбыз
§ 2. Атомдун спектрлериндеги
Законченемдүүлүктөр
И.ньютон кадимки ак жарыкты айнек призмасы аркылуу өткөзгөндө түзүүчүлөргө ажырап спектрди берерин көргөзгөн . Жарыктын ар кандай булактары , жалпысынан алганда , ар башка спектрге ээ болот . Эӊ эле жөнөкөй учурда , жарык буллагынан чыккан белгилүү толкун узундугу 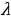 га ээ түстүү нур призмаддан сынгандан кийин эч кандай спектр байкалбайт . Болгону экранда берилген толкун узундугуна тиешелүү жарыктанган ичке тилке байкалат .
га ээ түстүү нур призмаддан сынгандан кийин эч кандай спектр байкалбайт . Болгону экранда берилген толкун узундугуна тиешелүү жарыктанган ичке тилке байкалат .
Ысыган катуу заттар чыгарган нурлануу туташ спектрди берет. Газдарда (туташ аймак менен бирге) сызыктуу жана тилкелүү спектрлар байкалат . Сызыктуу спектр законченемдүү түрдө жайланышкан аздыр – көптүр ичке түзүлүшкө ээ бир катар спектрдик сызыктардан турат . Тилкелүү спектрди жөн көз же ажыратуу жөндөмдүүлүгү кичине спектроскоп менен карагнда тилкелер туташтай болуп көрүнөт , бирок , жогорку ажыратуу жөндөмтүүлүгүнө ээ спектрдик куралды колдонгондо тилкелер бири – бирине тыгыз жайланышкан көптөгөн спектрдик сызыктан турары көрүнөт .
XX кылымдын башында газдардын сызыктуу спектрлери атомдор жана иондор , ал эми тилкелүүлөрү – молекулар тарабынан чыгарылары белгилүү болгон . Ошондуктан аларды атомдук жана молекулалык спектрлер деп да аташат . Суутектин атомунун спектрин вакуумдук суутектик түтүктө электр разряды жүргөн кезде , качан гана молекулаларынын басымдуу көпчүлүгү атомдорго ажыраганда байкай алабыз .
Атомдун көптөгөн спектрдик сызктарга ээ болушу , алардын ички түзүлүшүнүн татаалдыгын көргөзөт . Ошондуктан спектрлерди талдоодо чогулган эмпирикалык көп материалдар XX кылымда атомдун түзүлүшү жөнүндөгу теориянын өнүгүшүнүн негизи болгон .
Спектрдеги спектрдик сызыктын абалы толкун узундугу 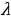 же жыштык v = c/
же жыштык v = c/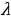 менен мүнөздөлөт . Жыштык спектрдик законченемдүүлүктөрдү туюнтууга ыӊгайлуурак , бирок аны эсептеп чыгуу үчүн жарыктын ылдамдыгы с ны жогорку тактыкта билүүбүз керек . Толкун узундугу
менен мүнөздөлөт . Жыштык спектрдик законченемдүүлүктөрдү туюнтууга ыӊгайлуурак , бирок аны эсептеп чыгуу үчүн жарыктын ылдамдыгы с ны жогорку тактыкта билүүбүз керек . Толкун узундугу 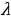 спектрдик куралдын жардамы менен эӊ жогорку тактыкта , үтүрдөн кийинки жетинчи жана андан да жогорку ондук белгиге чейин өлчөнөт . Ошондуктан v нун ордуна спектроскопияда спектроскопиялык толкундук сан деп аталган
спектрдик куралдын жардамы менен эӊ жогорку тактыкта , үтүрдөн кийинки жетинчи жана андан да жогорку ондук белгиге чейин өлчөнөт . Ошондуктан v нун ордуна спектроскопияда спектроскопиялык толкундук сан деп аталган 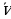 колдонулат .
колдонулат . 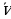 вакуумда 1 см узундукка туура келген толкундун санын көргөзө :
вакуумда 1 см узундукка туура келген толкундун санын көргөзө :
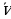 = 1/
= 1/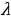 * (1.11)
* (1.11)
Cпектрлерди изилдөө 1860 – ж. немец окумуштуулары Г.Кирхгоф (1824 – 1887 – жж.) жана Р.Бунзендин (1811 – 1899)-жж.) Cпектрди байкоонун жардамы менен химиялык талдоо жүргүзүү аттуу эмгегинин жарык көрүшү менен башталган . Кийинки жылдарда атомдук спектрлерди изилдөөлөр күчөгөн .
Акырындап атомдук спектрлер баш ийген законченемдүүлүктөр табылы баштаган . 1855 – ж . швейцариялык физик , орто мектептин мугалими И.Бальмер (1825 – 1898 – жж.) суутектин спектринин көрүнүүчү аймагында жайланышкан , шарттуу түрдө 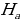 ,
, 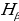 ,
, 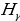 жана
жана 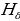 деп белгиленген сызыктардын толкун узундуктарынын ортосунда төмөндөгүдөй жөнөкөй формула
деп белгиленген сызыктардын толкун узундуктарынын ортосунда төмөндөгүдөй жөнөкөй формула
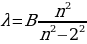 (1.12)
(1.12)
Менен туюнтулган катнаш бар экендигин аныктаган , мындан n – 3,4,5,6 га барабар бүтүн сан , B = 364,70 нм ге барабар турактуу чоӊдук . Бальмердин бул формуласы аны толкун узундугу аркылуу эмес , жарык термелүүсүнүн жыштыгы аркылуу жазганда айкыныраак болот . Жарык толкунун жыштыгы төмөндөгүгө барабар
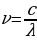 , (1.13)
, (1.13)
Мында с – жарыктын вакуумдагы ылдамдыгы . Бальмер боюнча
_________________________
Азыркы учурда жарык термелүүлөрүнүн жыштыгы сызыктуу эмес оптиканын ыкмаларын колдонуу менен спектроскопияда толкундун узундугун өлчөөгө караганда жогорку тактыкта өлчөӊөт . Ошондуктан спектроскопияда 1/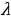 же с/
же с/ ны колдонуунун принципиалдык айырмасы жок . Спектроскопияда жыштыкты жана спектрдик толкундук санды бир эле v тамгасы менен белгилөө кабыл алынган . Түшүнбөстүктөр болбос үчүн биз жыштыкты v, ал эми спектрдик толкундук санды
ны колдонуунун принципиалдык айырмасы жок . Спектроскопияда жыштыкты жана спектрдик толкундук санды бир эле v тамгасы менен белгилөө кабыл алынган . Түшүнбөстүктөр болбос үчүн биз жыштыкты v, ал эми спектрдик толкундук санды 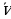 аркылуу белгилейбиз . Дегинкисинен айтканда
аркылуу белгилейбиз . Дегинкисинен айтканда 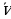 нун ордуна 1/
нун ордуна 1/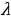 белгилөөсүн колдонуу ыӊгайлуурак .
белгилөөсүн колдонуу ыӊгайлуурак .
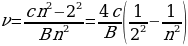 . (1.14)
. (1.14)
Бальмердин ачылшы атомардык суутекти изилдөөгө кызыгууну күчөттү . 1906 – ж . Америкалык физик Т.Лайман (1879-1949-жж.), Ф.Бреккет (1879-1949-жж.), америкалык физик А.Пфунд (1865-1947-жж.) жана башкалар инфракызыл аймакта жайланышкан жаӊы серияларды ачышкан. Ар бир аймактагы спектрдик сызыктардын жыштыктары үчүн туура келген Бальмердин формуласына окшош өзүнчө формулалары бар экендиги аныкталган . Эгерде R = 4с/В белгилөосүн киргизсек , анда Бальмердин төмөндөгүдөй формуласы
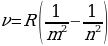 (1.15)
(1.15)
Каалагандай серия үчүн колдонулат, мында m жана n бүтүн сандар жана nm . Бул формула ушундай түрдө швед физиги И.Ридберг (1854 – 1919 – жж.) тарабынан жазылган жана R = 3,29*1015 с-1 турактуусу Ридбергдин турактуусу деп аталат .
Ушуга окшоп зааконченемдүүлүктөр башкача элементтердин , атап ииайтсак , жегич металдардын спектрлерине да табылган .
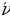 =
= 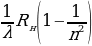 , n = 2,3,4,…. (1.16)
, n = 2,3,4,…. (1.16)
Мында R н = 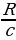 суутектин атому үчүн Ридбергдин турактуусу
суутектин атому үчүн Ридбергдин турактуусу
(Rн = 109678,76 см -1), m =1
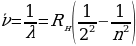 , n = 3,4,5,… (1.17)
, n = 3,4,5,… (1.17)
Формуласы менен мүнөздөлгөн суутектин атомунун спектриндеги Бальмердин сериясы 1.7 – сүрөтүндө көргөзүлгөн . 1- таблицада Бальмердин сериясынын биринчи тогуз сызыгы үчүн толкун узундуктардын байкалган жана эсептелген маанилери келтирилген . өлчөө абада жүргүзүлдүктөн (1.17) формуласы боюнча эсептөөлөр аба үчүн түзөтүүлөрдү киргизүү жүргүзүлдү . Таблицадан (1.17) формуласы өтө жогорку тактыкта тажрыйба менен дал келери көрүнүп турат .
1-1-таблица
Суутектин бальмердик сериясынын толкун узундуктары
|
n
| Бел- гиле- ниши
| 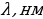
|
n | Бел- гиле- ниши
| 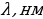
|
| Эсептел- гени | Байкал-ганы | Эсептел- гени | Байкал-ганы |
| 3 | 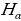
| 656,279 | 656,285 | 8 | 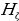
| 388,905 | 388,906 |
| 4 | 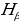
| 486,133 | 486,132 | 9 | 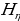
| 383,539 | 383,540 |
| 5 | 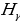
| 434,047 | 434,046 | 10 | 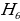
| 379,790 | 379,791 |
| 6 | 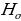
| 410,174 | 410,173 | 11 | 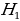
| 377,067 | 377,065 |
| 7 | 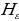
| 397,008 | 397,007 |
|
|
|
|




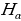
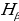
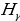
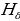
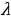 = 653,3 481,1 434,0 410,2 364,7 нм
= 653,3 481,1 434,0 410,2 364,7 нм
1.7 – сүрөт
Пашендин сериясы үчүн
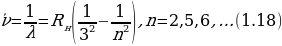
Бул серияны 1908 – ж. комбинациялык принциптин негизинде швейцариялык физик В.Ритц (1878 – 1909- жж.) алдын ала айткан . Бул сериянын сызыктарынын бардыгы Бальмердин сериясы дагы комбинациялоо жолу менен алынат . Каралган серия ушул эле жылы Пашен тарабынан ачылат .
Брекеттин сериясы :
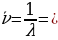
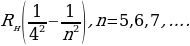 (1.19)
(1.19)
Пфунддун сериясы :
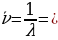
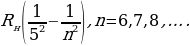 (1.20)
(1.20)
Бул сериялар тиешелүү түрдө 1922-ж. жана 1924-ж. ачылган . Брекеттин сериясы комбинациялоо жолу менен Пашендин , ал эми Пфунддун сериясы – Брекеттин сериясындагы сызыктардан алынат .
Лаймандын сериясы үчүн эӊ чоӊ толкун узундугу n = 2 учуруна тура келет . Ал 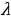 = 4/3Rн = 121,56713 нм ге барабар . Буга тиешелүү сызык суутектин резонанстык (күчөнүү) сызыгы деп аталат . Эӊ чон жыштык (толкундук сан ) (1.16) – (1.19) формулалары боюнча n =
= 4/3Rн = 121,56713 нм ге барабар . Буга тиешелүү сызык суутектин резонанстык (күчөнүү) сызыгы деп аталат . Эӊ чон жыштык (толкундук сан ) (1.16) – (1.19) формулалары боюнча n = 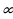 болгое учурда алынат . Бул жыштык сериянын чегарасы деп аталат . Мисалы , Бальмердин сериясы үчүн сериянын чегарасы төмөндөгүгө барабар:
болгое учурда алынат . Бул жыштык сериянын чегарасы деп аталат . Мисалы , Бальмердин сериясы үчүн сериянын чегарасы төмөндөгүгө барабар:
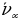 =
= 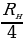 = 27419,69 см-1 же
= 27419,69 см-1 же 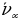 =
= 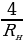 = 364,70142 нм.
= 364,70142 нм.
Чегарага жакындаган сайын спектрдик сызыктардын сериясы тыгыздала баштайт жана алардын ортосундагы толкун узундуктардын айырмасы асимптотикалык түрдө нөлгө умтулат , бул учурда сызыктардын интенсивдүүлүктөрү да нөлгө умтулат . Бул законченемдүүлүк суутектин эле спектрдик сериясында эмес , башка элементтердин спектрдик серияларында да байкалат . Мында , ары жагында туташ спектр башталган чегара да орун алат.
§3. Бордун постулаттары
§ 2 де сериялар үчүн келтирилген формулалар эмпирикалык жол менен тандалып алынганына жана тажрыйбада өтө жогорку тактыкта далилденгендигине карабастан теориялык негизге ээ болушкан эмес . Жогоруда келтирилген сериялык формулалардын түрлөрү , аларда бүтүн сандардын укмуштуудай кайталанышы , Ридбергдин турактуусунун универсаалдулугу табылган законченемдүүлүктөр өтө терен физикалык мааниге ээ экендигин жана аны чечмелөө классикалык физиканын алкагында мүмкүн эместигин күбөлөйт .
Атомдун жаӊы сапатка ээ – кванттык - теориясын түзүүнүн биринчи аракетин 1913 – ж. Н.Бор жасаган . Бор сызыктуу спектрлердин эмпирикалык законченемдүүлүктөрүн , Резерфорддун ядролук моделин жана жарыкты нурлантуунун жана жутуунун кванттык мүнөзүн бириктирүүгө аракет кылып , Төмөндөгүдөй үч постулатты сунуш кылат .
Бордун биринчи постулаты (туруктуу абалдардын постулаты ):
Электрондор атомдо мүмкүн болгон классикалык орбиталардын ичинен белгилүү радиуска ээ орбиталар боюнча гана кыймылдай алышат .
Станционарду же туруктуу деп аталган бул орбиталарда электрондун импульсунун моменти h/(2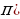 ге эселүү болот (орбиталардын радиусун кванттоо шарты) :
ге эселүү болот (орбиталардын радиусун кванттоо шарты) :
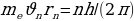 , (1.21)
, (1.21)
Мында me - электрондун массасы 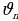 – n- орбитадагы анын ылдамдыгы,
– n- орбитадагы анын ылдамдыгы, 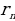 – n –орбитанын радиусу, n – бүтүн (n = 1,2,3,…) маанилерге ээ кванттык сан , h – планк турактуусу .
– n –орбитанын радиусу, n – бүтүн (n = 1,2,3,…) маанилерге ээ кванттык сан , h – планк турактуусу .
Электрон стационардуу орбиталар боюнча кыймылдаганда энергияны нурлантпай (жутпайт).
Электрон бир стационардуу абалдан экинчисине өткөндө , энергиясы тиешелүү стационардык абалдардын энергияларынын айырмасына барабар
h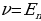 -
-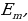 (1.22)
(1.22)
бир фотон бөлүнүп чыгат (жыштыктар шарты ), мында  жана
жана 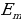 тиешелүү түрдө атомдун нурлантканга (жутканга) чейинки жана кийинки энергиялары
тиешелүү түрдө атомдун нурлантканга (жутканга) чейинки жана кийинки энергиялары 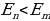 болгондо атом фотонду нурлантат (атом энергиясы чоӊ абалдан энергиясы кичине абалга , б.а., электрон ядродон алысыраак жайланышкан орбитадан жакыныраак жайланышкан орбитага өткөндө ),
болгондо атом фотонду нурлантат (атом энергиясы чоӊ абалдан энергиясы кичине абалга , б.а., электрон ядродон алысыраак жайланышкан орбитадан жакыныраак жайланышкан орбитага өткөндө ), 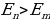 болгондо атом фотонду жутат (атом энергиясы чоӊ
болгондо атом фотонду жутат (атом энергиясы чоӊ
_________________________
Латындын postulatum- талап кылынган деген сөзүнөн . Постулат деп , илимий теорияны түзүү үчүн негиз катары алынган , далилдөөсүз кабыл алынган ырастама айтылат .
абалга , б.а., электрон ядродон алысыраак жайланышкан орбитага өткөндө ) Кванттык өтүүлөрдүн мүмкүн болгон дискреттүү 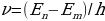 жыштыктарынын топтому атомдун сызыктуу спектрин аныктайт.
жыштыктарынын топтому атомдун сызыктуу спектрин аныктайт.
§ 4. Франк жана Герцтин тажрыйбасы
Атомдордун энергиялары дискреттүү маанилерге ээ боло тургандыгын 1913 – ж. Франк жана Г.Герц электрондор менен атомдордун кагылышууларын кармоочу потенциал ыкмасы аркылуу изилөө менен далилдешкен . Бул тажрыйбалардын принциптик схемасы 1.8 – сүрөтүндө көргөзүлгөн .
Б балонунда 102 Па басым
астында сымаптын буусу кармалып турат . Ысытылган К катоду менен С торчосунун ортосундагы потенциалдардын айырмасы (чыӊалуу) U1 V вольтмери менен өлчөнөт. U1 ди П патонциометринин жардамы менен өзгөртүүгө болот ; С торчосу менен А электродунун (анод) ортосундагы анча чоӊ эмес мааниге ээ утурлоочу потенциалдарынын айырмасы 0,5
1.8 – сүрөт В ко барабар . Катод бөлүп
чыгарган электрондор КС мейкиндигинде чыӊалуусу U1 ге
барабар электр тааласы менен ылдамтылат да , А электродун көздөй кыймылдашат да, А электродун көздөй кыймылдашат . Эгерде торчо аркылуу учуп өтүп бараткан кездеги электрондордун кинетикалык энергиясы 0,5 эВ тон чоӊ болсо , анда алар U2 = 0,5 В ко барабар токтотуучу чыӊалуунун аракетин женип , А электродуна жетишет да , чынжырда ток жүрө баштайт . Бул ток күчү G гальванометри менен өлчөнөт .
Гальванометрдеги ток күчү IG нын U1 ден көзкарандылыгы-


15 U1,B
IG
нын Франк – Герц тарабынан алынган графиги 1.9 – сүрөтүндө көргөзүлгөн . U
1 чыӊалуусун нөлдөн баштап чонойткондо , ток күчү башында өсө баштайт да, андан соӊ U
1 = 4,9 В ко жеткенде кескин төмөндөйт . U
1 ди андан ары чоӊойтсок I
G ток күчү кайтадан өсө баштайт да , U
1 = 24,9В = 9,8В болгондо кайтадан кескин тө –
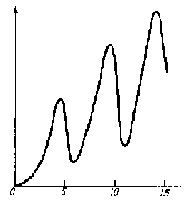
1.9-сүрөт
мөндөйт ; андан соӊ IG нын төмөндөшү U1 = 34,9В = 14,7В то байкалат ж.б.у.с. Графиктеги жанаша максимумдардын ортосундагы аралык U1 дин 4,9 В ко өзгөрүшүнө туура келет (1.9-сүр). 1В ко барабар потенциалдардын айырмасы электронго 1 эВ ко барабар кинетикалык энергия берерин эске сала кетебиз , демек U1 дин 4,9 В ко көбөйүшү электрондун кинетикалык энергиясынын 4,9 эВ ко чоноюшуна туура келет.
Графиктин мындай мүнөзү , электрондор (торчону көздөй учуп бара жаткан) сымаптын атомдору менен кагылышканда , алар энергиянын чоӊдугу 4,9 В ко барабар дискреттүү үлүшүн гана жутаары менен түшүндүрүлөт .
Электрондордун энергиясы 4,9 В тон кичине (U1 серпилггичтүү болот да , электрондордун кинетикалык энергиялары иш жүзүндө өзгөрбөйт . Мындай кагылышууларда атомдун ички энергиясы да өзгөрбөйт . Натыйжада электрондор С торчосуна токтотуучу потенцмалдардын айырмасы U2 ни жеӊгенге жеткидей энергия менен келип жетет . Ошондуктан U1 дин өсүшү IG нын өсүшү менен коштолот .
Качан U1 4,9 В ко жеткенде , торчого учуп жеткен электрондордун энергиясы 4,9 эВ ко барабар болот. Бул учурда электрондор менен атомдордун кагылышуулары серпилгичүү эмес болур калат да , электрон өзүнүн энергиясынын баарын (4,9 эВ) сымаптын атомуна берет , себеби сымаптын атому энергиянын мындай үлүшүн алууга жөндөмдүү болот . Бул учурда атом жакынкы дүүлүккөн абалга (б.а., жакынкы жогорку энергиялык деӊгээлге ) өтөт , ал эми кинетикалык энергиясын жоготкон электрон А электрондоруна чейин жетпей калат . Ошентип , А электродуна чейин атомдор менен серпилгичтүү кагылышкан электрондор гана келип жетет . Натыйжада А электродуна келип жеткен электрондордун саны азаят , б.а., IG ток күчү кескин кичирейип , графикте биринчи максимумдун пайда болушун шарттайт .
U1 чыналуусунун мааниси , серпилгичтүү эмес кагылуушуга катышкан электрондордун жетишерлик саны токтотуучу потенциалдардын айырмасы U2 ни женгендей чондукка жеткенде Ic ток күчү кайтадан өсө баштайт . Бирок U1 = 9,8 В болгон учурда , электрон биринчи серпилгичтүү эмес кагылышуудан кийин (К дан С га чейинки жолдун ортосунда) торчого чейин учуп жеткиче атом менен экинчи жолу серпилгичтүү эмес кагылышканга жеткидей энергияга (4,9 эВ) ээ болот . Мындай серпилгичтүү эмес кагылышууга катышкан электрондор А электродуна жете алышпайт , натыйжада IG кайтадан кескин төмөндөйт . Графиктеги экинчи максимумдун пайда болушу ушуну менен түшүндүрүлөт . Кийинки максимумдардын пайда болушун (U1 = 14,7 В ж.б.) ушуга окшош эле түшүндүрсөк болот .
Дүүлүккөн атомдор мурдагы энергиялык деӊгээлине кайтканда hv = 4,9 эВ ко барабар энергиянын квантын нурлантышат . Бул нурлануунун жыштыгын Бордун үчүнчү постулаты боюнча (1.22 формуласы ) оной эле тапсак болот :
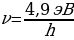 = 1,18*1015 Гц.
= 1,18*1015 Гц.
Бул чондук жыштыктын сымаптын буусунун нурлануу спектриндеги тиешелүү сызык үчүн спектроскопиялык ыкманы колдонуп түздөн – түз аныкталган мааниси менен дал келет .
Франк – Герцтин кийинки тажрыйбаларында атомдор жуткан (нурланткан) энергиянын дискреттүү маанилери натрийдин , гелийдин буулары үчүн да аныкталган .
§5. Суутектин атомунун спектри
(Бордун теориясы)
Суутектин атомунда бир элементардык оӊ зарядка ээ ядронун (протондун) тегерегинде терс элементардык -е зарядына ээ бир электрон айланат. Ядронун массасы электрондун массасынан 1840 эсе чоӊ болгондуктан , аны кыймылсыз деп эсептейбиз жана биринчи жакындатууда электрондун орбитасын айлана деп алабыз . Протон менен электрондун ортосунда кулондук гана күч аракет этишкендикткен электрондун кыймылы үчүн төмөндөгүдөй тендемени жазып алабыз :
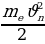
 (1.23)
(1.23)
мында mе - электродун массасы , 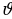 n – электрондун n – орбитадагы ылдамдыгы ,
n – электрондун n – орбитадагы ылдамдыгы , 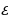 о = 8,85*10-12 Ф/м – электрдик турактуулук .
о = 8,85*10-12 Ф/м – электрдик турактуулук .
(1.22) жана (1.23) тендемелерин чогуу чыгарып , жөнөкөй өзгөртүп түзүүдөн кийин суутектин атомунун орбиталарынын радиустары үчүн төмөнкүдөй туюнтманы алабыз :
rn = 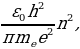 (1.24)
(1.24)
мында n – кванттык саны 1,2,3,… бүтүн маанилерге ээ болот . (1.24) формуласы боюнча каалагандай стационардык орбитанын радиусун эсептесек болот . Мисалы үчүн ядрого эӊ кичине аралыкка жайланышкан орбитанын (n = 1) радиусу (биринчи Бордук радиус )
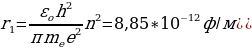
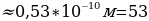 пм
пм
(1.24) формуласынын оӊ жагындагы n ден башка бардык чоӊдуктар турактуу болушат . Демек , турактуу орбиталардын радиустары өз ара натуралдык катардын сандарынын квадраттарындай , б.а., 1:4:9:16 ж.б.у.с. катышат .
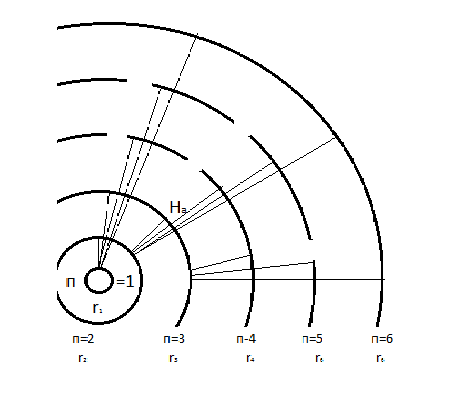
(1.24) формуласы боюнча эсептелген суутектин атомунун орбиталары 1.10 – сүрөтүндө көргөзүлгөн . Радиустун пикометр боюнча туюнтулган маанилери төмөндөгүдөй болушут : 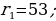
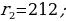
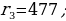
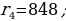
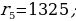 жана
жана 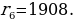
Эми атомдогу электрондун толук энергиясы  ди тарабыз .
ди тарабыз .
Ал электрондун орбита боюнча алга умтулуу кыймылынын кинетикалык энергиясы 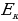 нын жана электрондун ядрого тартылуусунун потенциалдык энергиясы
нын жана электрондун ядрого тартылуусунун потенциалдык энергиясы 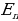 нын суммасынын турат .
нын суммасынын турат .
(1.23) формуласынын эске алып , төмөнкүнү алабыз :



Пашендин сериясы
Бальмердин сериясы
Лаймандын сериясы
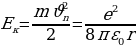 (1.25)
(1.25)
Электрондун потенциалдык энергиясы терс жана төмөндөгүгө барабар болот :
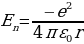 (1.26)
(1.26)
Ошентип толук энергия Еn төмөнкүчө аныкталат :
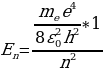 . (1.27)
. (1.27)
Бул формула боюнча электрондун энергиясын каалагандай турактуу орбита үчүн тапсак болот . Мисалы , ядрого эӊ жакын жайгашкан орбита үчүн (n=1)
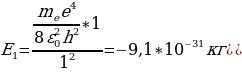
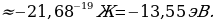
Стационардык орбитада жайланышкан электрондун толук энергиясы атомдун энергиясынын деӊгээли же энергиялык деӊгээл деп аталат . 1.11- сүрөтүндө суутектин атомунун (1.27) формуласы боюнча эсептелген энергиялык деӊгээлдеринин схемалык сүрөттөлүшү жана аларга тиешелүү энергиянын маанилери көргөзүлгөн .
Ошентип , (1.27) формуласына ылайык , атомдун энергиясы n кванттык санынын өсүшү , б.а., электрондун орбитасынын радиусунун өсүшү менен чоӊоёт экен .
Атом эӊ кичине энергияга (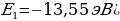 электрон ядрого эӊ жакын жайгашкан орбита (n=1) боюнча кыймылдаганда , ал эми энергиянын эӊ чон маанисине (
электрон ядрого эӊ жакын жайгашкан орбита (n=1) боюнча кыймылдаганда , ал эми энергиянын эӊ чон маанисине (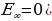 – электрон эӊ алыскы орбита ( n =
– электрон эӊ алыскы орбита ( n = 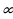 ) боюнча кыймылдаганда , б.а., атом иондошкон учурда ээ болот.
) боюнча кыймылдаганда , б.а., атом иондошкон учурда ээ болот.



















Дүүлүккөн
деӊгээл
w=-0,84 эВ
W=-0,54 эВ
W =-0,38 эB
w = 0
n = 4
n = 5
n = 6
Нормалдуу
деӊгээл
Лаймандын
сериясы
Бальмердин
сериясы текст
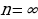



n = 3
Пашендин
сериясы



W=-13,55
W=-1,50 эВ
n = 2
Электрон экинчи орбитадан (n = 1) биринчи орбитага (n = 1) өткөндө атом hv2-1 = - 3,38 эВ – (-13,55 эВ) = 10,17 эВ энергиясына ээ квантты нурлантат , ал эми электрон үчүнчү орбитадан (n = 3) экинчисине (n = 3) өткөндө 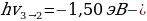 3,38 эВ) = 1,88 эВ энергиясына ээ квант нурланат . Бул нурланууларга жыштыктардын (толкун узундуктардын) төмөндөгүдөй маанилери туура келет :
3,38 эВ) = 1,88 эВ энергиясына ээ квант нурланат . Бул нурланууларга жыштыктардын (толкун узундуктардын) төмөндөгүдөй маанилери туура келет :
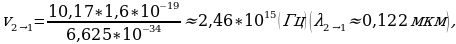
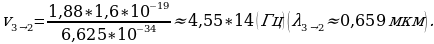
Электрон алыс жайланышкан орбитага , б.а., атомдук жогорку энергиялык деӊгээлде өзүнөн – өзү өтүшү мүмкүн эмес . Мындай өтүү болуш үчүн атомго тыштан энергиянын белгилүү санын беришибиз , б.а., атомду дүүлүктүрүү керек . Мисалы үчүн , электрон биринчи стационардык орбитадан экинчисине өтүшү үчүн , атом 10,17 эВ ко барабар энергияны жутушу керек .
Атомдун нормалдуу абалы болуп , электрон ядрого эӊ жакын орбита (n = 1) боюнча кыймылдаган учур эсептелет . Мында атом квантты нурланта албайт , себеби бул орбитада кыймылдаган электрон ядрого андан ары жакындай албайт . Атомдун нормалдуу абалына туура келген энергиялык денгээл 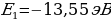 нормалдуу деӊгээл; калган деӊгээлдердин баары дүүлүккөн деп аталышат .
нормалдуу деӊгээл; калган деӊгээлдердин баары дүүлүккөн деп аталышат .
Атомдун нурлануусунун жыштыгы үчүн жалпы формуланы чыгарабыз . Бул үчүн энергиянын (1.27) туюнтмасын жыштыктар шартынын туюнтмасы (1.22) ге коёбуз :
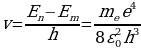
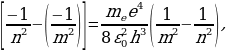 (1.28)
(1.28)
мында n жана Еn - атомдун баштапкы абалына (нурлантканга чейинки) туура келген кванттык сан жана энергия , m жана Еm – атомдун акыркы абалы (нурланткандан кийин) үчүн ошол эле мүнөздөмөлөр . (1.28) формуласынын оӊ жагындагы көбөйтүүчү Ридбергдин турактуусуна барабар болот :
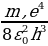 =
= 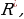 (1.29)
(1.29)
анда (1.28) формуласы
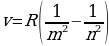 (1.30)
(1.30)
түрүндө ээ болот .
(1.30) формуласынын эмпирикалык түрдө алынган сериалдык (1.17) – (1.20) формулалары менен салыштыруу , алар (1.30) формуласынын жекече учурлары экендигин көргөзөт .
_______________________
* спектроскопияда 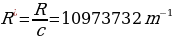 чондугу колдонулат .
чондугу колдонулат .
 да Ридбергдин турактуусу деп аталат .
да Ридбергдин турактуусу деп аталат .
Демек , Лаймандын сериясынын спектралдык сызыктары электрон экинчи , үчүнчү , төртүнчү ж.б орбиталардан биринчисине; Бальмердин сериясынын сызыктары үчүнчү , төртүнчү , бешинчи ж.б орбиталардан экинчисине ; Пашендин сериясынын сызыктары электрон төртүнчү , бешинчи , алтынчы орбиталардан үчүнчүсүнө ж.б.у.с. өткөн учурларга туура келет .
Газ ар кандай дүүлүгүшкөн көптөгөн атомдордон тургандыктан , анда бир эле убакытта электрондун мүмкүн болгон бардык өтүүлөрү орун алат .
Ошондуктан суутектин атомунун спектринде бир эле убакытта бардык сериялардын сызыктары байкалат .
Лаймандын , Бальмердин жана Пашендин спектрдик серияларынын пайда болушу (1.10) жана (1.11) сүрөтүндө көргөзүлгөн .
(1.30) формуласынан Ридбергдин турактуусуннун физикалык мааниси келип чыгат ; эгерде n = 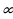 жана m = 1 болсо , анда v = R , б.а., Ридбергдин турактуусу суутектин атомунун нормалдуу абалга өткөн кездеги нурлантуусунун жыштыгына барабар .
жана m = 1 болсо , анда v = R , б.а., Ридбергдин турактуусу суутектин атомунун нормалдуу абалга өткөн кездеги нурлантуусунун жыштыгына барабар .
Суутектин атомунун түзүлүшү жөнүндөгү Бордун теориясы суутек сымал , б.а., бир эле электронду курамына камтыган (мисалы 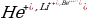 иондошкон атомдор үчүн да орун алат . Бирок бул учурда ядронун зарядын е эмес , Ze (Z – элементтин атомдук номери) деп түшүнүүбүз керек .
иондошкон атомдор үчүн да орун алат . Бирок бул учурда ядронун зарядын е эмес , Ze (Z – элементтин атомдук номери) деп түшүнүүбүз керек .
Суутек сымал атомдор үчүн Бордун (1.30) спектрдик формуласы төмөндөгүдөй түргө ээ болот
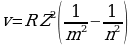 (1.31)
(1.31)
Бордун теориясы суутектин атомунун спектрин абдан жакшы түшүндүргөн , бирок көп электрондуу атомдордун спектрин түшүндүрүү үчүн Бордун теориясын колдонууга мүмкүн эмес болгон .
Көп электрондуу атомдордун спектрлеринде бир сызыктын ордуна бири – бирине жакын жайланышкан эки же андан көп спектрдик сызыктар байкалган . Бул кубулуш мультиплеттүүлүк деп аталат . Мультиплеттүүлүк берилген n кванттык санына туура келген энергиялык деӊгээлдин чегинде электрондор энергиялары боюнча бир аз айырмалана тургандыгын күбөлөйт .
Айлана түрүндөгү орбиталарга негизделген Бордун теориясы бул кубулушту түшүндүрө алган эмес . Мындан атомдогу электрондун бардык мүмкүн болгон энергиялык деӊгээлдеринин мүнөздөө үчүн бир эле кванттык сан жетшсиздик кылаары келип чыккан .
1916 – ж . Немец физиги А.Зоммерфельд (1868 – 1951 – жж.) электрон жеке эле айлана боюнча эмес эллипстик орбита боюнча да кыймылдашы мүмкүн деп болжолдогон . Эллипстин фокусунда жайгашкан ядродон ар кандай алыстыкта электрондун ылдамдыгы өзгөрөт . Салыштырмаалуулук теориясына ылайык кыймылдаган нерсенин массасы 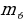 ылдамдыктын чоӊоюшу менен өсөт жана
ылдамдыктын чоӊоюшу менен өсөт жана
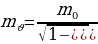
Формуласы менен аныкталат , мында с - жарыктын ылдамдыгы , 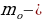 нерсенин тынч абалдагы массасы .
нерсенин тынч абалдагы массасы .
Демек электрондун кыймылынын ылдамдыгынын өзгөрүшү анын массасынын өзгөрүшүнө алып келет бул болсо электрондун кыймыл санынын моменти  дин өзгөрүүсүн шарттайт . Мына ушуну менен бир кванттык сан менен мүнөздөлгөн энергиялык деӊгээлдин чегинде электрондун энергиялык мүнөздөмөлөрүнүн ар башка болушун түшүндүрүүгө болот . Эгерде айлана формуласындагы орбитаны мүнөздөөгө анын радиусун аныктоочу бир эле кванттык сан n жетиштүү болсо , эллипстик орбита үчүн эки чондукту - эллипстин чоӊ жана кичине жарым окторун билүү керек болот . Жарым октордун ортосундагы катнаш каалагандай болбойт , алар секириктүү гана өзгөрө алышыт , б.а., квантталат . Бул учурда чоӊ жарым ок n кванттык санына , ал эми кичине жарым ок k кванттык санына туура келет . Мында n башкы кванттык сан деп аталат жана бүтүн сандарга барабар болот , k - кошумча кванттык сан деп аталып , башкы кванттык сандан чоӊ эмес бүтүн сандарга барабар мааниге ээ болот . Ошентип , ар бир энергиялык деӊгээл , кошумча кванттык сандарга туура келген энергиялардын деӊгээлдерине ажырап кетет .
дин өзгөрүүсүн шарттайт . Мына ушуну менен бир кванттык сан менен мүнөздөлгөн энергиялык деӊгээлдин чегинде электрондун энергиялык мүнөздөмөлөрүнүн ар башка болушун түшүндүрүүгө болот . Эгерде айлана формуласындагы орбитаны мүнөздөөгө анын радиусун аныктоочу бир эле кванттык сан n жетиштүү болсо , эллипстик орбита үчүн эки чондукту - эллипстин чоӊ жана кичине жарым окторун билүү керек болот . Жарым октордун ортосундагы катнаш каалагандай болбойт , алар секириктүү гана өзгөрө алышыт , б.а., квантталат . Бул учурда чоӊ жарым ок n кванттык санына , ал эми кичине жарым ок k кванттык санына туура келет . Мында n башкы кванттык сан деп аталат жана бүтүн сандарга барабар болот , k - кошумча кванттык сан деп аталып , башкы кванттык сандан чоӊ эмес бүтүн сандарга барабар мааниге ээ болот . Ошентип , ар бир энергиялык деӊгээл , кошумча кванттык сандарга туура келген энергиялардын деӊгээлдерине ажырап кетет .
Бордун теориясы атомдун теориячын өнүктүрүүдө ири кадам болгон . Бул теория классикалык физиканын жоболорун атомдун ичиндеги кубулуштарга колдонууга болбостугун жана микродүйнөдө башкы орунга жаны механика – кванттык механиканын
закондору чыгаарын көрсөттү
Жогоруда биз баяндаган элементардык теория андан ары такталып жана өркүндөтүлгөн . Аларды кароонун кажети жок , себеби азыркы учурда Бордун теориясы тарыхый гана мааниге ээ .
Алгачкы ийгиликтерден кийин теориянын улам жаӊы жетишпегендиктери чыга берди . Теориянын өзгөчө чоӊ кемчилиги, ал суутектин атомунан кийин жайланышкан эӊ жөнөкөй атомдордун бири гелийдин атомунун түзүлүшүн түшүндүрө албаганы болгон .
Бул жетишпегендиктер Бордун теориясынын эӊ эле начар жагы , анын ички логикалык карама – каршылыктары менен түшүндүрүлөт : Бордук теория толугу менен классикалык же кванттык болгон эмес . Заттардын толкундук касиети ачылгандан кийин классикалык механикага таянган Бордун теориясы атомдук кубулуштардын ыраттуу теориясын түзүүдөгү өткөөл этабы боло тургандыгы түшүнүктүү болуп калды .
Текшерүү үчүн суроолор
Атомдун түзүлүшү жөнүндө Томсондун моделин мүнөздөгүлө
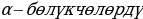 чачыратуу боюнча Резерфорддун тажрыйбасын түшүндүргүлө .
чачыратуу боюнча Резерфорддун тажрыйбасын түшүндүргүлө .
Бул тажрыйбадан Резерфорд кандай таянактарды чыгарган ?
Резерфорддун формуласын жазып түшүндүргүлө .
Атомдун спектрлериндеги законченемдүүлүктөр жөнүндө айтып бергиле .
Спектроскопиялык толкундук сан деп эмнени айтабыз ? Формуласын жазгыла .
Суутектин спектрин мүнөздөгөн Бальмердин сериялык формуласын жазып түшүндүргүлө . Башка сериялык формулаларды мүнөздөгүлө .
Бордун постулаттарын атагыла .
Франк жана Герцтин тажрыйбасынын схемасын чийип түшүндүргүлө . Аны мүнөздөгөн графигин сызгыла .
Суутектин атомунун спектрин мүнөздөгөн Бордун теориясы жөнүндө айтып бергиле .
Атомдун энергиялык деӊгээлинин формуласын жазып түшүндүргүлө .
Суутек сымал атомдор үчүн Бордун спектрдик формуласын жазып түшүндүргүлө .
Ридбергдин турактуусунун физикалык маӊызын түшүндүргүлө.
Мультиплеттүүлүк деген кандай кубулуш ?
6







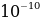 м ге барабар шар түрүндө болот (1.1-сүр.). Жогорудагыдай эле атомдо оӊ заряд электрондордун жалпы терс заряды менен тендешип турат.
м ге барабар шар түрүндө болот (1.1-сүр.). Жогорудагыдай эле атомдо оӊ заряд электрондордун жалпы терс заряды менен тендешип турат. 




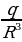 , (1.1)
, (1.1)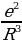 r = - kr (1.2)
r = - kr (1.2)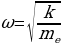 =
= 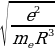 (1.3)
(1.3)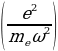 1/3 (1.4)
1/3 (1.4) = 6000 A толкун узундугуна (спектердин көрүнгөн аймагы)
= 6000 A толкун узундугуна (спектердин көрүнгөн аймагы) 
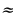
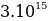 рад/с туура келет. Демек
рад/с туура келет. Демек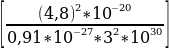 1/3
1/3 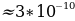 м.
м. - бөлүкчөсүн изилдөө боюнча жүргүзгөн тажрыйбалары абдан чоӊ мааниге ээ. Нурлануулар же ар кандай бөлүкчөлөрдүн – X – нурлары , электрондор (
- бөлүкчөсүн изилдөө боюнча жүргүзгөн тажрыйбалары абдан чоӊ мааниге ээ. Нурлануулар же ар кандай бөлүкчөлөрдүн – X – нурлары , электрондор (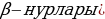 жана
жана 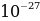 кг , б.а., гелийдин атомунун массасына барабар , анын заряды оӊ жана чондугу боюнча электрондун зарядына караганда эки эсеге чоӊ болору жана радиоактивдүү полонийден бөлүнүп чыккан
кг , б.а., гелийдин атомунун массасына барабар , анын заряды оӊ жана чондугу боюнча электрондун зарядына караганда эки эсеге чоӊ болору жана радиоактивдүү полонийден бөлүнүп чыккан 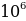 м/с га барабар экендиги белгилүү болгон . Мындан
м/с га барабар экендиги белгилүү болгон . Мындан  салыштырма санын эсептөөгө мүмкүндүк берген (1.2-сүр.).
салыштырма санын эсептөөгө мүмкүндүк берген (1.2-сүр.). 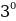 ка барабар бурчка чачыраары аныкталган . Мындай бөлүкчөлөрдүн бурчтук бөлүштүрүлүшү кокустуктуу каталарды мүнөздөгөн Гаусстун (1777-1855-жж.) Ийрлиги менен жакшы сүрөттөлгөн . Бирок , кээ бир
ка барабар бурчка чачыраары аныкталган . Мындай бөлүкчөлөрдүн бурчтук бөлүштүрүлүшү кокустуктуу каталарды мүнөздөгөн Гаусстун (1777-1855-жж.) Ийрлиги менен жакшы сүрөттөлгөн . Бирок , кээ бир 





 Резерфорддун тыянагы Вильсондун
Резерфорддун тыянагы Вильсондун  түрүндө болгон учурлар байкалат (1.4-сүр.).
түрүндө болгон учурлар байкалат (1.4-сүр.). пайда кылышат . Жогоруда келтирилген тыянакка таянып , Резерфорд
пайда кылышат . Жогоруда келтирилген тыянакка таянып , Резерфорд 
 учурунда - түртүшүү күчү . Натыйжада
учурунда - түртүшүү күчү . Натыйжада 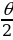 =
=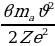 , (1.5)
, (1.5) массасы ,
массасы , 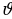 – анын
– анын  б.а., ядродон алыс жердеги ылдамдыгы , Ze – ядронун заряды , 2е -
б.а., ядродон алыс жердеги ылдамдыгы , Ze – ядронун заряды , 2е -  аркылуу мээлөө аралыгы , б.а., ядродон
аркылуу мээлөө аралыгы , б.а., ядродон 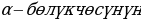 дүүлүкпөгөн түз сызыктуу изине жүргүзүлгөн перпендикулярдык узундугу белгиленет .
дүүлүкпөгөн түз сызыктуу изине жүргүзүлгөн перпендикулярдык узундугу белгиленет .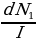 (1.6)
(1.6)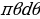 . Мындай аянтчанын ички радиусу
. Мындай аянтчанын ички радиусу 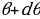 га барабар , ал эми борбору X – огунда жайланышат (1.5-сүр. Үстүндө сол жакта ).
га барабар , ал эми борбору X – огунда жайланышат (1.5-сүр. Үстүндө сол жакта ). 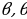 + d
+ d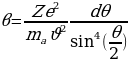
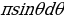 нерселик бурчун киргизип төмөндөгүнү оӊой эле алабыз :
нерселик бурчун киргизип төмөндөгүнү оӊой эле алабыз :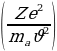 2
2 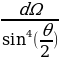 (1.7)
(1.7) 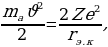 (1.9)
(1.9)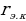
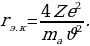 (1.10)
(1.10)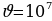 м/c ,
м/c , 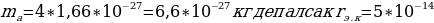 м болот .
м болот .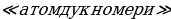 Z өскөн сайын системалуу түрдө азаят экен . Мындан , Мозли бул законченемдүүлүк атомдун зарядынын
Z өскөн сайын системалуу түрдө азаят экен . Мындан , Мозли бул законченемдүүлүк атомдун зарядынын 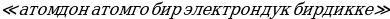 чоӊоюшу менен шартталат жана мындай бирдиктердин саны
чоӊоюшу менен шартталат жана мындай бирдиктердин саны 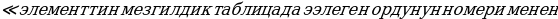
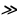 , - деген тыянакка келет .
, - деген тыянакка келет . 
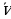 колдонулат .
колдонулат . 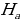 ,
, 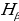 ,
, 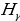 жана
жана 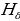 деп белгиленген сызыктардын толкун узундуктарынын ортосунда төмөндөгүдөй жөнөкөй формула
деп белгиленген сызыктардын толкун узундуктарынын ортосунда төмөндөгүдөй жөнөкөй формула 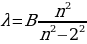 (1.12)
(1.12)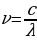 , (1.13)
, (1.13)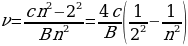 . (1.14)
. (1.14)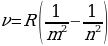 (1.15)
(1.15)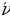 =
= 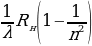 , n = 2,3,4,…. (1.16)
, n = 2,3,4,…. (1.16)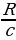 суутектин атому үчүн Ридбергдин турактуусу
суутектин атому үчүн Ридбергдин турактуусу 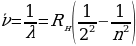 , n = 3,4,5,… (1.17)
, n = 3,4,5,… (1.17)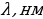
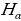
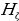
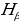
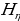
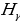
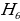
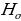
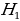
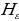



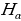
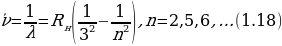
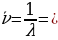
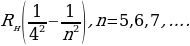 (1.19)
(1.19)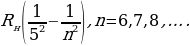 (1.20)
(1.20)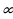 болгое учурда алынат . Бул жыштык сериянын чегарасы деп аталат . Мисалы , Бальмердин сериясы үчүн сериянын чегарасы төмөндөгүгө барабар:
болгое учурда алынат . Бул жыштык сериянын чегарасы деп аталат . Мисалы , Бальмердин сериясы үчүн сериянын чегарасы төмөндөгүгө барабар: 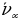 =
= 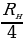 = 27419,69 см-1 же
= 27419,69 см-1 же 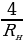 = 364,70142 нм.
= 364,70142 нм.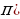 ге эселүү болот (орбиталардын радиусун кванттоо шарты) :
ге эселүү болот (орбиталардын радиусун кванттоо шарты) :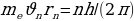 , (1.21)
, (1.21)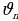 – n- орбитадагы анын ылдамдыгы,
– n- орбитадагы анын ылдамдыгы, 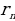 – n –орбитанын радиусу, n – бүтүн (n = 1,2,3,…) маанилерге ээ кванттык сан , h – планк турактуусу .
– n –орбитанын радиусу, n – бүтүн (n = 1,2,3,…) маанилерге ээ кванттык сан , h – планк турактуусу .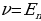 -
-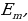 (1.22)
(1.22) жана
жана 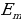 тиешелүү түрдө атомдун нурлантканга (жутканга) чейинки жана кийинки энергиялары
тиешелүү түрдө атомдун нурлантканга (жутканга) чейинки жана кийинки энергиялары 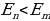 болгондо атом фотонду нурлантат (атом энергиясы чоӊ абалдан энергиясы кичине абалга , б.а., электрон ядродон алысыраак жайланышкан орбитадан жакыныраак жайланышкан орбитага өткөндө ),
болгондо атом фотонду нурлантат (атом энергиясы чоӊ абалдан энергиясы кичине абалга , б.а., электрон ядродон алысыраак жайланышкан орбитадан жакыныраак жайланышкан орбитага өткөндө ), 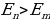 болгондо атом фотонду жутат (атом энергиясы чоӊ
болгондо атом фотонду жутат (атом энергиясы чоӊ 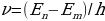 жыштыктарынын топтому атомдун сызыктуу спектрин аныктайт.
жыштыктарынын топтому атомдун сызыктуу спектрин аныктайт.


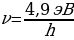 = 1,18*1015 Гц.
= 1,18*1015 Гц.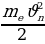
 (1.23)
(1.23)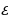 о = 8,85*10-12 Ф/м – электрдик турактуулук .
о = 8,85*10-12 Ф/м – электрдик турактуулук . 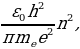 (1.24)
(1.24)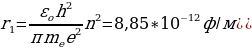
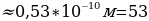 пм
пм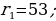
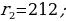
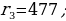
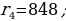
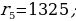 жана
жана 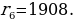
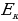 нын жана электрондун ядрого тартылуусунун потенциалдык энергиясы
нын жана электрондун ядрого тартылуусунун потенциалдык энергиясы 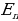 нын суммасынын турат .
нын суммасынын турат .



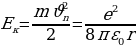 (1.25)
(1.25)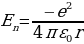 (1.26)
(1.26)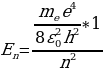 . (1.27)
. (1.27)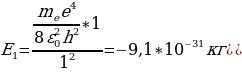
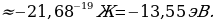
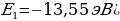 электрон ядрого эӊ жакын жайгашкан орбита (n=1) боюнча кыймылдаганда , ал эми энергиянын эӊ чон маанисине (
электрон ядрого эӊ жакын жайгашкан орбита (n=1) боюнча кыймылдаганда , ал эми энергиянын эӊ чон маанисине (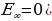 – электрон эӊ алыскы орбита ( n =
– электрон эӊ алыскы орбита ( n = 








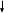



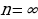


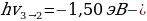 3,38 эВ) = 1,88 эВ энергиясына ээ квант нурланат . Бул нурланууларга жыштыктардын (толкун узундуктардын) төмөндөгүдөй маанилери туура келет :
3,38 эВ) = 1,88 эВ энергиясына ээ квант нурланат . Бул нурланууларга жыштыктардын (толкун узундуктардын) төмөндөгүдөй маанилери туура келет :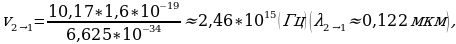
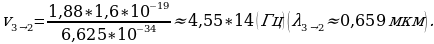
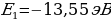 нормалдуу деӊгээл; калган деӊгээлдердин баары дүүлүккөн деп аталышат .
нормалдуу деӊгээл; калган деӊгээлдердин баары дүүлүккөн деп аталышат .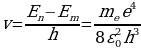
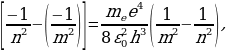 (1.28)
(1.28)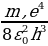 =
= 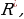 (1.29)
(1.29)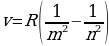 (1.30)
(1.30)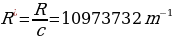 чондугу колдонулат .
чондугу колдонулат . да Ридбергдин турактуусу деп аталат .
да Ридбергдин турактуусу деп аталат . 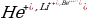 иондошкон атомдор үчүн да орун алат . Бирок бул учурда ядронун зарядын е эмес , Ze (Z – элементтин атомдук номери) деп түшүнүүбүз керек .
иондошкон атомдор үчүн да орун алат . Бирок бул учурда ядронун зарядын е эмес , Ze (Z – элементтин атомдук номери) деп түшүнүүбүз керек .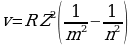 (1.31)
(1.31)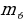 ылдамдыктын чоӊоюшу менен өсөт жана
ылдамдыктын чоӊоюшу менен өсөт жана 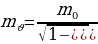
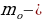 нерсенин тынч абалдагы массасы .
нерсенин тынч абалдагы массасы .  дин өзгөрүүсүн шарттайт . Мына ушуну менен бир кванттык сан менен мүнөздөлгөн энергиялык деӊгээлдин чегинде электрондун энергиялык мүнөздөмөлөрүнүн ар башка болушун түшүндүрүүгө болот . Эгерде айлана формуласындагы орбитаны мүнөздөөгө анын радиусун аныктоочу бир эле кванттык сан n жетиштүү болсо , эллипстик орбита үчүн эки чондукту - эллипстин чоӊ жана кичине жарым окторун билүү керек болот . Жарым октордун ортосундагы катнаш каалагандай болбойт , алар секириктүү гана өзгөрө алышыт , б.а., квантталат . Бул учурда чоӊ жарым ок n кванттык санына , ал эми кичине жарым ок k кванттык санына туура келет . Мында n башкы кванттык сан деп аталат жана бүтүн сандарга барабар болот , k - кошумча кванттык сан деп аталып , башкы кванттык сандан чоӊ эмес бүтүн сандарга барабар мааниге ээ болот . Ошентип , ар бир энергиялык деӊгээл , кошумча кванттык сандарга туура келген энергиялардын деӊгээлдерине ажырап кетет .
дин өзгөрүүсүн шарттайт . Мына ушуну менен бир кванттык сан менен мүнөздөлгөн энергиялык деӊгээлдин чегинде электрондун энергиялык мүнөздөмөлөрүнүн ар башка болушун түшүндүрүүгө болот . Эгерде айлана формуласындагы орбитаны мүнөздөөгө анын радиусун аныктоочу бир эле кванттык сан n жетиштүү болсо , эллипстик орбита үчүн эки чондукту - эллипстин чоӊ жана кичине жарым окторун билүү керек болот . Жарым октордун ортосундагы катнаш каалагандай болбойт , алар секириктүү гана өзгөрө алышыт , б.а., квантталат . Бул учурда чоӊ жарым ок n кванттык санына , ал эми кичине жарым ок k кванттык санына туура келет . Мында n башкы кванттык сан деп аталат жана бүтүн сандарга барабар болот , k - кошумча кванттык сан деп аталып , башкы кванттык сандан чоӊ эмес бүтүн сандарга барабар мааниге ээ болот . Ошентип , ар бир энергиялык деӊгээл , кошумча кванттык сандарга туура келген энергиялардын деӊгээлдерине ажырап кетет .  чачыратуу боюнча Резерфорддун тажрыйбасын түшүндүргүлө .
чачыратуу боюнча Резерфорддун тажрыйбасын түшүндүргүлө .
















