
АЗОТ

1. Сведения о химическом элементе

1.1. Химический знак – N
1.2. Относительная атомная масса – 14
1.3 В периодической системе химических элементов находится во 2 периоде VA группы
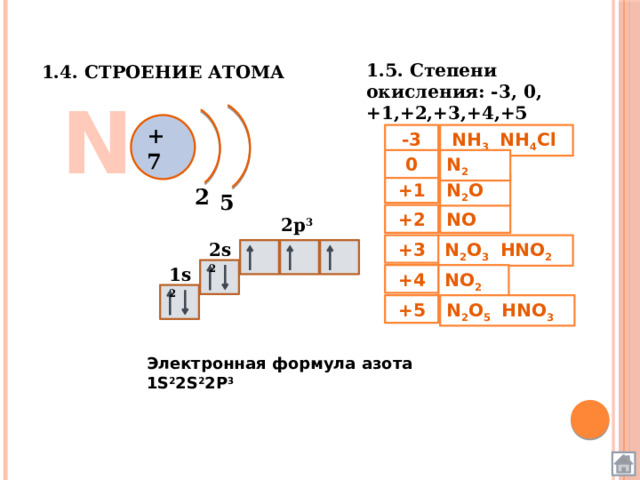
1.4. Строение атома
1.5. Степени окисления: -3, 0, +1,+2,+3,+4,+5
N
+ 7
NH 3 NH 4 Сl
-3
N 2
0
+1
N 2 О
2
5
+2
NО
2p 3
2s 2
+3
N 2 О 3 HNO 2
1s 2
NО 2
+4
+5
N 2 О 5 HNO 3
Электронная формула азота 1S 2 2S 2 2P 3
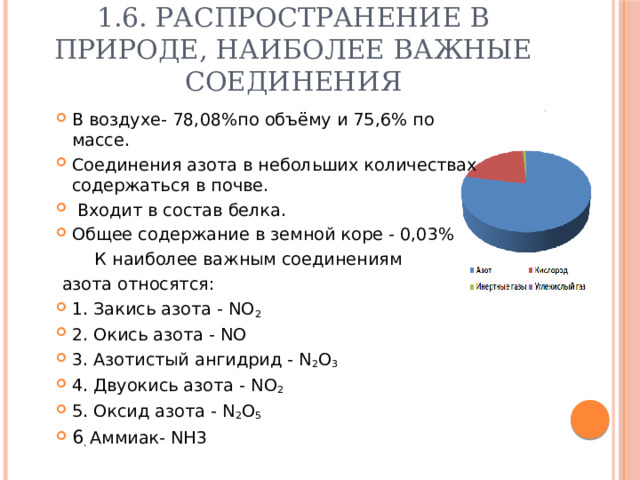
1.6. Распространение в природе, наиболее важные соединения
- В воздухе- 78,08%по объёму и 75,6% по массе.
- Соединения азота в небольших количествах содержаться в почве.
- Входит в состав белка.
- Общее содержание в земной коре - 0,03%
К наиболее важным соединениям
азота относятся:
- 1. Закись азота - NO 2
- 2. Окись азота - NO
- 3. Азотистый ангидрид - N 2 O 3
- 4. Двуокись азота - NO 2
- 5. Оксид азота - N 2 O 5
- 6 . Аммиак- NH3

2. Сведения о простом веществе
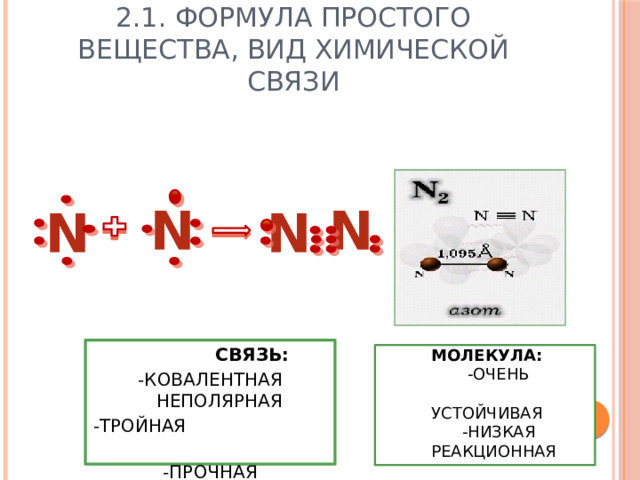
МОЛЕКУЛА:
-ОЧЕНЬ УСТОЙЧИВАЯ
-НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ
2.1. Формула простого вещества, вид химической связи
N
N
N
N
СВЯЗЬ:
-КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ
-ТРОЙНАЯ
-ПРОЧНАЯ
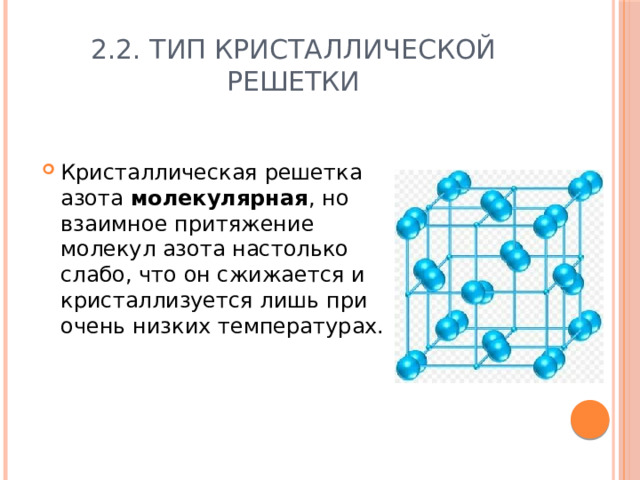
2.2. Тип кристаллической решетки
- Кристаллическая решетка азота молекулярная , но взаимное притяжение молекул азота настолько слабо, что он сжижается и кристаллизуется лишь при очень низких температурах.
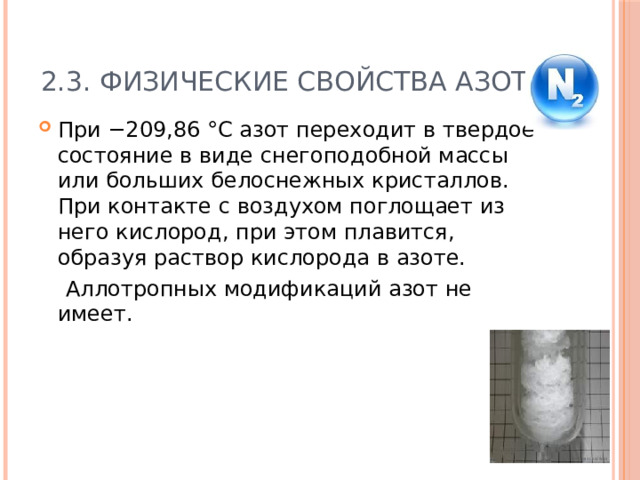
2.3. Физические свойства азота
- При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Аллотропных модификаций азот не имеет.

2.3. Физические свойства азота
- При нормальных условиях азот это бесцветный газ, не имеет запаха, мало растворим в воде.
- В жидком состоянии (при температуре −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.

2.4. Химические свойства азота
При обычных условиях азот малоактивен, при высоких температурах связи ослабевают и он становится реакционноспособным.
С металлами:
6Li + N 2 → 2Li 3 N + 39кДж
3Ca + N 2 → Ca 3 N 2
2Al + N 2 → 2AlN

2.4. Химические свойства азота
Образующиеся нитриды полностью гидролизуются водой:
Сa 3 N 2 + 6H 2 O → 3Ca(OH) 2 + 2NH 3 ↑
Li 3 N + 3H 2 O ⟶ 3LiOH + NH 3 ↑

2.4. Химические свойства азота
С кислородом азот взаимодействует при очень сильном нагревании:
N 2 + O 2 ↔ 2NO↑ - Q
При определенных условиях азот реагирует с водородом:
N 2 + Н 2 ↔ 2NН 3 ↑ + Q
C фтором:
N 2 + F 2 = 2NF 3
воздух
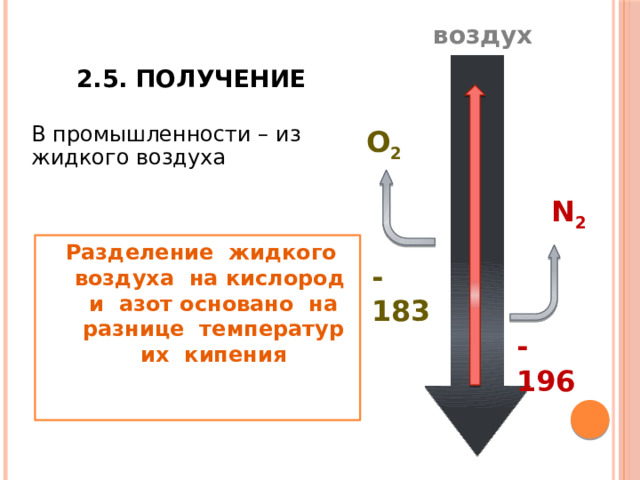
2.5. Получение
В промышленности – из жидкого воздуха
O 2
N 2
Разделение жидкого воздуха на кислород и азот основано на разнице температур их кипения
-183
-196

Получение в лаборатории
2. Разложение нитрита аммония
NH 4 NO 2 N 2 + 2H 2 O
3. Взаимодействие аммиака с оксидом меди (II)
2NH 3 + 3CuO N 2 + 3Cu + 3H 2 O
4. Горение аммиака
4NH 3 + 3O 2 2N 2 + 6H 2 O
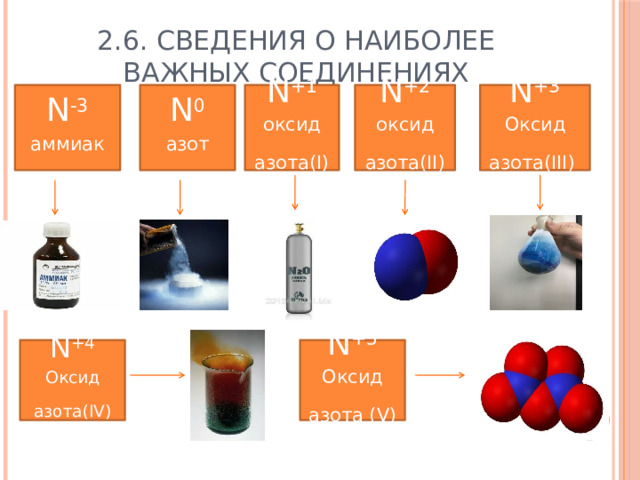
2.6. Сведения о наиболее важных соединениях
N -3
N +2
N +3
N +1
аммиак
N 0
оксид азота(II)
азот
Оксид азота(III)
оксид азота(I)
N +5
N +4
Оксид азота(IV)
Оксид азота (V)

3.1. Формула высшего оксида и его характеристика
Оксид азота (V) - N2O5 — высший оксид азота
Представляет собой бесцветные, очень летучие кристаллы (t пл.- 41 о С)
Взаимодействует с органическими веществами и полимерами, проявляет кислотные свойства
Продуктом реакции между кислотным оксидом и водой является кислота
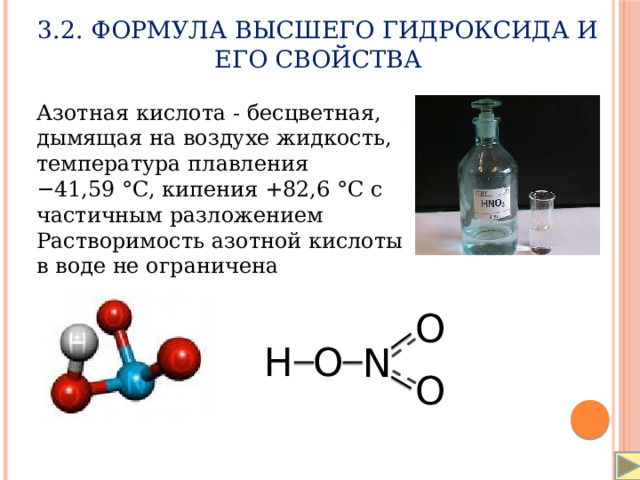
3.2. Формула высшего гидроксида и его свойства
Азотная кислота - бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением
Растворимость азотной кислоты в воде не ограничена
O
O
H
N
O

Химические свойства азотной кислоты
Типичные свойства:
а) с основными и амфотерными оксидами:
CuO + 2HNO 3 = Cu(NO 3 ) 2 + H 2 O
ZnO+ 2HNO 3 = Zn(NO 3 ) 2 + H 2 O
б) с основаниями:
KOH + HNO 3 = KNO 3 +H 2 O
в) вытесняет слабые кислоты из их солей:
CaCO 3 + 2HNO 3 = Ca(NO 3 ) 2 + H 2 O + CO 2 ↑
При кипении или под действием света азотная кислота частично разлагается:
4HNO 3 = 2H 2 O + 4NO 2 ↑ + O 2 ↑

разбавленная
концентрированная
Химические свойства азотной кислоты
1. С металлами до Н
Zn+4HNO 3 =Zn(NO 3 ) 2 +2H 2 O+2NO↑
2. С металлами после Н
Cu+4HNO 3 =Cu(NO 3 ) 2 +2H 2 O+2NO 2
3. С неметаллами
S+6HNO 3 = H 2 SO 4 +6NO 2 ↑+2H 2 O
4 . Пассивирует железо, алюминий, хром
1. С металлами до Н
3Zn+8HNO 3 =3Zn(NO 3 ) 2 +4H 2 O+2NO↑
2. С металлами после Н
3Cu+8HNO 3 =3Cu(NO 3 ) 2 +4H 2 O+2NO↑
3. С неметаллами
S+2HNO 3 = H 2 SO 4 +2NO↑
4 . С органическими веществами
C 2 H 6 +HNO 3 =C 2 H 5 NO 2
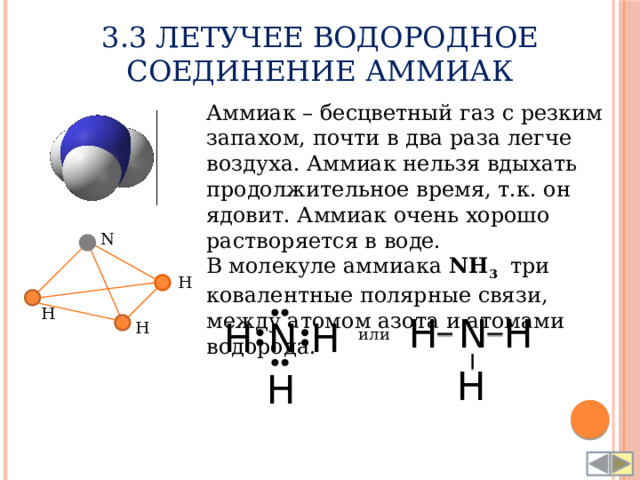
3.3 Летучее водородное соединение Аммиак
Аммиак – бесцветный газ с резким запахом, почти в два раза легче воздуха. Аммиак нельзя вдыхать продолжительное время, т.к. он ядовит. Аммиак очень хорошо растворяется в воде.
В молекуле аммиака NH 3 три ковалентные полярные связи, между атомом азота и атомами водорода.
N
H
H
H
H
N
N
H
H
H
или
H
H

Химические свойства аммиака
Реакции протекающие
с изменением степени окисления NH 3 – сильное основание
без изменения степени окисления
NH 3 – сильный восстановитель
1. Горение аммиака
4NH 3 + 3O 2 = t = 2N 2 + 6H 2 О
2. Каталитическое окисление аммиака
4NH 3 + 5O 2 = 4NO + 6H 2 O
3. С оксидами металлов
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4. С сильными окислителями
2NH 3 + 3Cl 2 = t = N 2 + 6HCl
5. Аммиак – непрочное соединение, при нагревании разлагается
2NH 3 = t = N 2 + 3H 2
1. С водой образуется аммиачная вода (нашатырный спирт) :
NH 3 + H 2 O ↔ NH 4 OH ↔ NH 3 •H 2 O ↔ NH 4 + + OH -
2. С кислотами:
NH 3 +HCl = NH 4 Cl
NH 3 +H 2 SO 4 = NH 4 HSO 4 – гидросульфат аммония
2NH 3 +H 2 SO 4 = (NH 4 ) 2 SO 4 – сульфат аммония

4. Биологическое значение азота и применение
- Азот — одно из самых распространенных веществ в биосфере, узкой оболочке Земли, где поддерживается жизнь.
- Число атомов азота во всем теле человека 9,1х 1025, а в одной клетке – 9,1 х 1011. В организме человека массой 70 кг содержится примерно 1,8 кг азота . Содержание азота в крови составляет 3077 мг/л, в волосах – 140 000–157 000 мг/кг, а в ногтях – 146 000–148 000 мг/кг.

Жидкий азот в медицине
N2
Синтез аммиака
Производство удобрений
Синтез азотной кислоты
Создание инертной среды

Фармация
Азот используется в медицинской упаковке с целью стерилизации, защиты и увеличения срока годности
Применяется для удаления кислорода и устранения возможной образующейся влаги
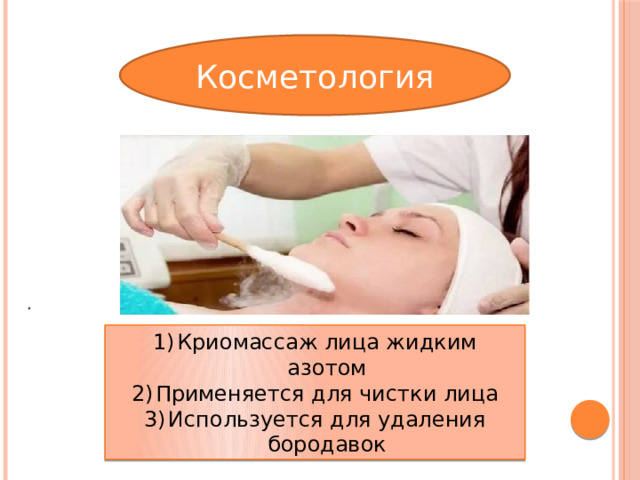
Косметология
.
- Криомассаж лица жидким азотом
- Применяется для чистки лица
- Используется для удаления бородавок
Медицина
Применяют для проведения операций процедур омоложения, хранения биоматериала, проведения научных опытов, транспортировки медицинских препаратов






















































